Để sử dụng toàn bộ tiện ích nâng cao của Hệ Thống Pháp Luật vui lòng lựa chọn và đăng ký gói cước.
| BỘ Y TẾ | CỘNG HÒA XÃ HỘI CHỦ NGHĨA VIỆT NAM |
| Số: 4921/QĐ-BYT | Hà Nội, ngày 26 tháng 12 năm 2011 |
VỀ VIỆC BAN HÀNH HƯỚNG DẪN QUY TRÌNH TRIỂN KHAI KỸ THUẬT GENE XPERT
BỘ TRƯỞNG BỘ Y TẾ
Căn cứ Nghị định số 188/2007/NĐ-CP ngày 27/12/2007 và Nghị định số 22/2010/NĐ-CP ngày 09/03/2010 của Chính phủ quy định chức năng, nhiệm vụ, quyền hạn và cơ cấu tổ chức của Bộ Y tế;
Xét đề nghị của Cục trưởng Cục Quản lý khám, chữa bệnh- Bộ Y tế;
QUYẾT ĐỊNH:
Điều 1. Ban hành kèm theo Quyết định này Quy trình triển khai kỹ thuật Gene Xpert.
Điều 2. Việc triển khai kỹ thuật Gene Xpert để chẩn đoán bệnh lao, lao kháng đa thuốc được áp dụng đối với tất cả các cơ sở khám, chữa bệnh Nhà nước và tư nhân có điều kiện phù hợp đáp ứng tiêu chuẩn do Dự án phòng chống lao quốc gia quy định.
Điều 4. Các Ông, Bà: Chánh Văn phòng Bộ, Cục trưởng Cục Quản lý khám, chữa bệnh - Bộ Y tế; Giám đốc Bệnh viện, Viện có giường bệnh trực thuộc Bộ Y tế, Giám đốc Sở Y tế các tỉnh, thành phố trực thuộc trung ương; Thủ trưởng Y tế các ngành và Thủ trưởng các đơn vị có liên quan chịu trách nhiệm thi hành Quyết định này.
|
| KT.BỘ TRƯỞNG |
QUY TRÌNH TRIỂN KHAI KỸ THUẬT GENE XPERT
(Ban hành kèm theo Quyết định số 4921/QĐ-BYT ngày 26 tháng 12 năm 2011 của Bộ trưởng Bộ Y tế)
GeneXpert là một kỹ thuật mang tính đột phá tích hợp của 3 công nghệ (tách gien, nhân gien và nhận biết gien) với tên gọi là GeneXpert đã được phát triển trong khuôn khổ hợp tác của tổ chức FIND (Foundation for Innovative New Diagnostics), Cepheid Inc và trường đại học y - nha khoa New Jersey.
Tính đến tháng 6 năm 2011 đã có 40 quốc gia trên thế giới thuộc châu Mỹ La tinh, châu Phi, châu Âu, châu Á bắt đầu triển khai kỹ thuật mới này. Riêng khu vực Tây thái bình dương GeneXpert đã có ở Campuchia (16 máy), Trung Quốc (16 máy), Philippines (4 máy).
Với công nghệ này, máy Xpert MTB/RIF cho phép xác định vi khuẩn lao với độ nhậy rất cao (99% người bệnh xét nghiệm đờm trực tiếp dương tính, 80 % người bệnh xét nghiệm đờm trực tiếp âm tính, 91% với các trường hợp nuôi cấy dương tính và 72,5% với người bệnh nuôi cấy âm). Kỹ thuật cho kết quả nhanh chỉ trong vòng 2 giờ và rất đơn giản cho người dùng. Điều đặc biệt là máy có thể cho kết quả kép, tức là cùng một lần trả lời cho phép biết bệnh phẩm có vi khuẩn lao hay không, có nhiều hay ít và vi khuẩn có kháng với thuốc rifampicin hay không.
Kỹ thuật này là bước tiến đột phá trong cuộc chiến phòng chống lao hiện nay đã được Tổ chức Y tế Thế giới chứng thực tháng 12/2010 và khuyến cáo áp dụng trong công tác phòng chống lao:
1. Xpert MTB/RIF nên được áp dụng làm xét nghiệm chẩn đoán ban đầu cho những trường hợp nghi mắc lao đa kháng thuốc hoặc lao đồng nhiễm HIV.
2. Tại những nơi tình hình dịch tễ lao đa kháng thuốc hoặc HIV không cao, Xpert MTB/RIF có thể cân nhắc áp dụng cho những trường hợp xét nghiệm đờm trực tiếp âm tính để tăng phát hiện lao phổi AFB (-).
1. Mục tiêu: Nhằm chẩn đoán nhanh bệnh lao, bệnh lao do vi khuẩn kháng rifampicin và bệnh lao ở người nhiễm HIV.
2. Phạm vi áp dụng (giai đoạn ban đầu): Theo khuyến cáo của Tổ chức Y tế Thế giới
· Tại các cơ sở quản lý lao đa kháng thuốc.
· Các cơ sở chẩn đoán lao cho người nhiễm HIV tuyến tỉnh hoặc tuyến huyện có cả cơ sở chống lao và HIV phối hợp tốt.
· Một số huyện thí điểm khả năng tăng phát hiện lao phổi AFB (-).
3. Chỉ định:
· Xét nghiệm chẩn đoán ban đầu cho những trường hợp nghi mắc lao kháng đa thuốc hoặc lao đồng nhiễm HIV.
· Chẩn đoán lao phổi AFB (-).
· Bệnh phẩm hiện nay chủ yếu là đờm. Các loại bệnh phẩm khác có thể áp dụng trong nghiên cứu đánh giá.
III. Quy trình kỹ thuật và nguyên lý vận hành Gene Xpert:
1. Quy trình kỹ thuật:
a) Xét nghiệm viên hướng dẫn bệnh nhân lấy mẫu đờm:
- Chỉ người bệnh tới nơi khạc đờm và hướng dẫn cách khạc đờm:
+ Hít thở sâu 2-3 lần
+ Mở nắp cốc đờm đưa lại gần miệng để lấy đờm
+ Đậy nắp cốc đờm, xoáy chặt
- Kiểm tra chất lượng mẫu đờm: Mẫu đờm có chất lượng tốt phải là:
+ Đờm đặc khạc sâu từ trong phổi
+ Số lượng ít nhất từ 2ml trở lên
+ Nếu là nước bọt phải yêu cầu bệnh nhân lấy lại đờm
- Nếu mẫu đờm được lấy tại cơ sở y tế lân cận nơi đặt máy thì cần lưu ý:
+ Để mẫu đờm tại nơi mát (tốt nhất để trong ngăn mát của tủ lạnh)
+ Tránh nhiệt độ cao và ánh nắng mặt trời
+ Chuyển mẫu đờm đến nơi làm xét nghiệm càng sớm càng tốt (tốt nhất là ngay trong ngày)
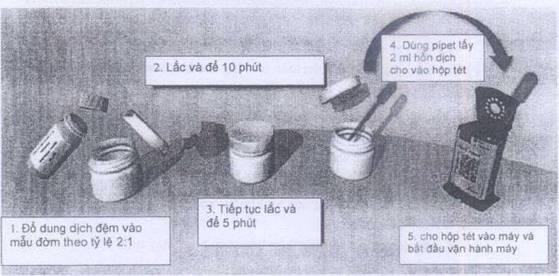
b) Chuẩn bị test:
- Đổ dung dịch đệm (dung dịch này nằm trong bộ test được chuẩn bị sẵn) vào mẫu đờm theo tỷ lệ 2:1 để làm loãng đờm và diệt vi khuẩn
- Lắc hỗn dịch và để trong 10 phút
- Tiếp tục lắc lần 2 và để thêm 5 phút
- Dùng Pipet lấy 2ml hỗn dịch đưa vào hộp xét nghiệm (cartridge)
- Scan mã số (Code) trên cartridge vào máy
- Đặt cartridge vào máy, từ đây các bước tiếp theo sẽ hoàn toàn tự động theo quy trình vận hành của máy
2. Nguyên lý kỹ thuật và quy trình vận hành của máy:
a) Nguyên lý kỹ thuật:
Kỹ thuật dựa trên tích hợp 3 công nghệ: tách gien, nhân gien và xác định gien.
- Tách gien:
Vi khuẩn bị tiêu huỷ bởi sóng siêu âm mạnh. ADN của vi khuẩn sẽ được chiết tách và có hệ thống tự kiểm định chất lượng quá trình chiết tách.
- Nhân gien (khuyếch đại gien):
Phản ứng nhân gien gọi là realtime hemi nested PCR là yếu tố quan trọng tạo nên độ nhạy đặc biệt của kỹ thuật.
- Xác định gien:
Các đoạn gien đặc hiệu của vi khuẩn lao và tính kháng rifampicin sẽ được phát hiện và đánh giá dựa trên việc sử dụng 5 primer đặc hiệu và 5 probe phân tử duy nhất để nhận biết sự hiện diện của vi khuẩn lao và tính kháng rifampicin của nó.
Hướng tiếp theo kỹ thuật sẽ sử dụng nhiều primer và probe để nhận biết tính kháng các loại thuốc khác ngoài rifampicin. Hình dưới đây mô tả 5 probe A, B, C, D, E để đánh giá tính kháng rifampicin của vi khuẩn lao.

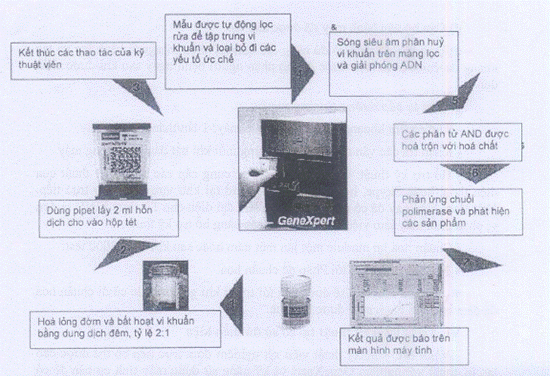
b) Quy trình vận hành: hoàn toàn tự động sau khi đưa hỗn dịch vào máy
- Hỗn dịch sau khi đưa vào máy sẽ được tự động lọc và rửa
- Vi khuẩn bị giữ lại trên màng lọc sẽ bị tiêu huỷ bởi sóng siêu âm và AND của vi khuẩn sẽ được chiết tách
- ADN sau khi được chiết tách sẽ được tự động hoà trộn với hoá chất
- Phản ứng nhân gen (PCR) xảy ra
- Các đoạn gien đặc hiệu của vi khuẩn lao và tính kháng rifampicin sẽ được phát hiện và đánh giá
- Kết quả xét nghiệm sẽ được báo trên màn hình máy tính
- Kết quả xét nghiệm sẽ bao gồm:
+ Vi khuẩn lao có được phát hiện hay không
+ Nếu có, số lượng ở mức thấp trung bình hay cao
+ Vi khuẩn được phát hiện có kháng với rifampicin hay không
c) Hạn chế của kỹ thuật:
- Độ nhậy của kỹ thuật cao, tuy nhiên giá trị dự báo dương tính của kết quả xác định kháng rifampicin phụ thuộc vào tỷ lệ kháng thuốc của nhóm bệnh nhân được xét nghiệm. Do vậy cần xem xét yếu tố lâm sàng để kết luận và định hướng điều trị.
- Yêu cầu về hậu cần: điều kiện nhiệt độ, độ ẩm và bảo quản an toàn cần thiết cao hơn vận hành kính hiển vi thông thường.
IV. Các bước tiến hành: Quy trình chẩn đoán cho các đối tượng bệnh nhân được xây dựng cụ thể trong phụ lục (đính kèm).
Người bệnh đến khám cần được đánh giá nguy cơ kháng đa thuốc, hay tình trạng nhiễm HIV.
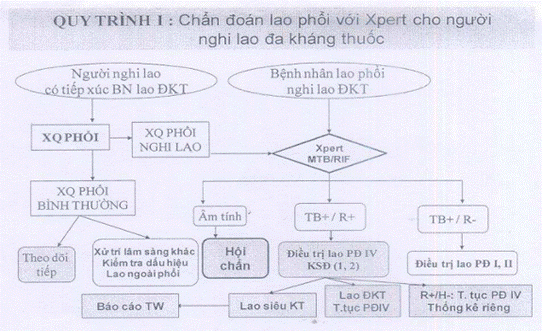
- Nếu người bệnh nghi lao đa kháng sẽ áp dụng Quy trÌnh I.
- Nếu người bệnh nghi lao có nhiễm HIV sẽ áp dụng Quy trình lIa (Người bệnh có các dấu hiệu nguy kịch) và Quy trình Ilb (Người bệnh không có dấu hiệu nguy kịch).
- Nếu người bệnh không nhiễm HIV và không có nguy cơ mắc lao đa kháng sẽ được áp dụng Quy trình III.
V. Quy trình bảo hành-bảo quản
1. Các điều kiện về nơi đặt máy: Cần căn cứ vào những tiêu chí sau đây:
a) Ưu tiên đặt máy thuộc khu vực có tỷ lệ lao kháng thuốc và/hoặc HIV cao.
b) Các điểm cần có số mẫu cần xét nghiệm tối thiểu là 15-20 mẫu/ngày đối với 1 máy GeneXpert 4-module.
c) Cơ sở hạ tầng bảo đảm: nguồn điện cung cấp liên tục, ổn định, phòng đặt máy an toàn, chống trộm cắp, nhiệt độ trong phòng đặt máy phù hợp, không quá cao, tốt nhất cần có điều hoà nhiệt độ.
d) Cán bộ vận hành máy đã được đào tạo.
đ) Đơn vị y tế phải có đủ năng lực quản lý điều trị người bệnh lao và lao kháng đa thuốc phát hiện được để thu nhận người bệnh ngay sau khi được chẩn đoán.
2. Duy tu bảo dưỡng thường xuyên:
- Khử nhiễm khoang đặt cartridge của máy: 1 lần/tháng.
- Kiểm tra các vấn đề về lỗi phần cứng mỗi khi bắt đầu khởi động máy.
- Hỗ trợ kỹ thuật: Công ty Cepheid sẽ cung cấp các hỗ trợ kỹ thuật qua điện thoại hoặc Skype, hoặc đại diện Cepheid tại khu vực sẽ hỗ trợ trực tiếp. Việt Nam hiện nay đã có một chuyên gia XN đại diện cho Tổ chức FIND là đơn vị phân phối máy làm việc thường trú và sẵn sảng hỗ trợ kỹ thuật.
- Chuẩn hoá lại module một lần một năm hoặc sau khi chạy 2000 test:
+ Module được gửi tới Pháp để chuẩn hoá.
+ Module thay thế sẽ được gửi tới trước khi gửi module cũ đi chuẩn hoá để đàm bảo vận hành máy được liên tục.
VI. Triển khai kỹ thuật tại cơ sở đủ điều kiện
- Nhân lực: Các kỹ thuật viên xét nghiệm đờm trực tiếp có thể được đào tạo kỹ thuật xét nghiệm GeneXpert và kỹ năng sử dụng máy tính cơ bản để có thể thao tác, vận hành máy tiến hành làm test. Người bệnh sau khi được chẩn đoán bệnh bảo đảm được đưa vào quản lý điều trị trong chương trình chống lao.
- Trang thiết bị kỹ thuật: bao gồm máy GeneXpert, máy tính cá nhân (hoặc máy tính xách tay) và bộ test kit kèm theo. Cốc đờm đã được cung cấp đầy đủ cho các cơ sở chống lao tuyến tỉnh, huyện định kỳ trong chương trình chống lao.
- Điều kiện hậu cần để vận hành và bảo dưỡng.
+ Các điểm triển khai cần có kho chứa test có điều hoà nhiệt độ, bảo đảm nhiệt độ kho luôn dưới 28°C. Nhiệt độ phòng xét nghiệm cần bảo đảm dưới 30°C.
+ Máy cần được bảo dưỡng định kỳ: khoang đặt cartridge cần khử trùng 1 lần/tháng, xét nghiệm viên có thể trực tiếp thực hiện việc này.
+ Trong trường hợp cần hỗ trợ kỹ thuật trong khi vận hành máy, cán bộ kỹ thuật có thể liên hệ trực tiếp với nhà sản xuất qua Skype hoặc đại diện công ty tại khu vực có thể tới hỗ trợ tại chỗ.
+ Chuẩn hoá lại module một lần một năm hoặc sau khi chạy 2000 test: nhà cung cấp sẽ gửi module thay thế tới phòng xét nghiệm để đảm bảo công việc không bị gián đoạn, module cần bảo dưỡng sẽ được gửi tới Pháp.
- Khả năng cung cấp các dung môi, hóa chất, kit phục vụ cho vận hành lâu dài: bộ test kit sẽ được tính toán và dự trù mua định kỳ theo nhu cầu sử dụng của Chương trình khi kết thúc dự án thí điểm. Để đảm bảo kinh phí thường xuyên cho hoạt động này, Chương trình chống lao sẽ ước tính nhu cầu kinh phí mua test kit và kinh phí bảo dưỡng máy trong kế hoạch hoạt động hàng năm nguồn ngân sách nhà nước.
- Điều kiện đảm bảo an toàn sinh học: Dung dịch đệm bổ sung vào mẫu đờm có tác dụng bất hoạt vi khuẩn, như vậy sau khi pha với dung dịch đệm, trong vòng 15 phút đờm không còn khả năng lây nhiễm.
|
Nơi nhận:
| KT. BỘ TRƯỞNG |
QUY TRÌNH TỔNG QUÁT ÁP DỤNG XPERT MTB/RIF TẠI VIỆT NAM
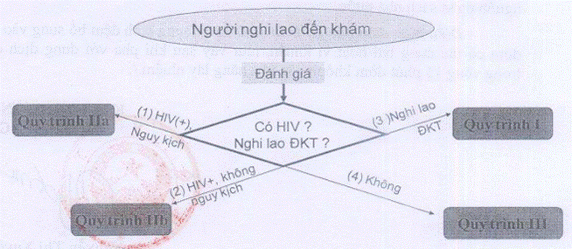
Chú thích:
(1) Nguy kịch: Thở > 301/p, Sốt>39°C, mạch >120 l/p, không tự đi lại được.
(2) Không nguy kịch: không có các dấu hiệu trên
(3) Nghi lao đa kháng: Đang điều trị ngoài CT, thất bại, tái phát, điều trị lại sau bỏ trị, tiền sử điều trị lao > 1 tháng, không âm hóa đờm sau giai đoạn tấn công
(4) Không: HIV(-), chưa mắc lao bao giờ và không tiếp xúc BN lao ĐKT
QUY TRÌNH IIa: Chẩn đoán lao phổi ở người HIV (+) nghi lao, có dấu hiệu nguy kịch

QUY TRÌNH IIb: Chẩn đoán lao ở người HIV (+) không dấu hiệu nguy kịch

QUY TRÌNH III: Người nghi lao, HIV(-) và không nghi lao kháng thuốc
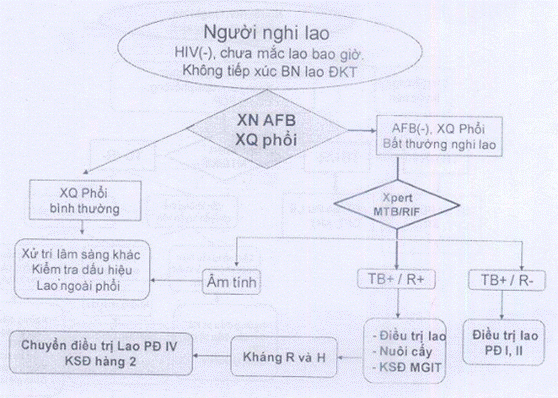
Một số chữ viết tắt trong các quy trình:
MTB = vi khuẩn lao;
RIF = Rifampicin;
XQ = Xquang;
ĐKT = Đa kháng thuốc;
T.tục PĐ = tiếp tục phác đồ;
TB-/R- = kết quả Xpert xác định không có vi khuẩn lao;
TB+/R- = kết quả Xpert xác định có vi khuẩn nhưng không kháng RMP;
TB+/R+ = kết quả Xpert xác định có vi khuẩn lao và có kháng RIF;
CPT = điều trị dự phòng nhiễm trùng cơ hội bằng Cotrimoxazole ;
ART = Điều trị kháng virus cho người nhiễm HIV;
KSĐ 1,2 = Làm kháng sinh đồ với thuốc chống lao hàng 1 và hàng 2;
PĐ I, II = Phác đồ điều trị I và II;
PCP = viêm phổi do Pneumocystis Carini
Quyết định 4921/QĐ-BYT năm 2011 hướng dẫn Quy trình triển khai kỹ thuật Gene Xpert do Bộ trưởng Bộ Y tế ban hành
- Số hiệu: 4921/QĐ-BYT
- Loại văn bản: Quyết định
- Ngày ban hành: 26/12/2011
- Nơi ban hành: Bộ Y tế
- Người ký: Nguyễn Thị Xuyên
- Ngày công báo: Đang cập nhật
- Số công báo: Đang cập nhật
- Ngày hiệu lực: 26/12/2011
- Tình trạng hiệu lực: Kiểm tra

