Để sử dụng toàn bộ tiện ích nâng cao của Hệ Thống Pháp Luật vui lòng lựa chọn và đăng ký gói cước.
| BỘ Y TẾ | CỘNG HÒA XÃ HỘI CHỦ NGHĨA VIỆT NAM
|
| Số: 4871/2004/QĐ-BYT | Hà Nội, ngày 31 tháng 12 năm 2004 |
QUYẾT ĐỊNH
VỀ VIỆC BAN HÀNH TIÊU CHUẨN NGÀNH Y TẾ.
BỘ TRƯỞNG BỘ Y TẾ
Căn cứ Nghị định số 49/2003/NĐ-CP ngày 15/5/2003 của Chính phủ về quy định chức năng, nhiệm vụ, quyền hạn và cơ cấu tổ chức của Bộ Y tế;
Căn cứ Pháp lệnh Chất lượng hàng hóa ngày 24/12/1999;
Căn cứ Nghị định số 179/2004/NĐ-CP ngày 21/10/2004 của Chính phủ về quy định quản lý nhà nước về chất lượng sản phẩm, hàng hóa;
Theo đề nghị của Cục trưởng Cục An toàn vệ sinh thực phẩm, Vụ trưởng Vụ Pháp chế, Vụ trưởng Vụ khoa học và Đào tạo Bộ Y tế,
Điều 1:Ban hành kèm theo Quyết định này 02 Tiêu chuẩn ngành y tế sau:
1. 52 TCN-TQTP 0008 : 2004 - Thường quy kỹ thuật xác định E.coli 0157 trong thực phẩm;
2. 52 TCN-TQTP 0009:2004 - Thường quy kỹ thuật định danh nấm mốc As - pergillus parasiticus, Aspergillus versi- color trong thực phẩm.
Điều 2. Quyết định này có hiệu lực sau 15 ngày, kể từ ngày đăng Công báo.
|
| KT. BỘ TRƯỞNG BỘ Y TẾ |
NGÀNH Y TẾ 52 TCN-TQTP 0008:2004 THƯỜNG QUY KỸ THUẬT XÁC ĐỊNH
Lời nói đầu
52 TCN - TQTP 0008 : 2004 do Viện Dinh dưỡng biên soạn, Cục An toàn vệ sinh thực phẩm đề nghị, Bộ trưởng Bộ Y tế ban hành theo Quyết định số 4871/2004/QĐ-BYT ngày 31 tháng 12 năm 2004.
| BỘ Y TẾ
| TIÊU CHUẨN NGÀNH Y TẾ
| NHÓM TQTP 52 TCN-TQTP 0008:2004 Có hiệu lực sau 15 ngày, kể từ ngày đăng Công báo
|
| THƯỜNG QUY KỸ THUẬT XÁC ĐỊNH E.COLI 0157 TRONG THỰC PHẨM
|
Phương pháp này để xác định E.coli O157 trong thực phẩm.
Sử dụng kỹ thuật làm giàu, xác định khuẩn lạc nghi ngờ E.coli O157 trên thạch SMAC sau khi ủ ấm ở 370c trong 24 giờ. Từ những khuẩn lạc nghi ngờ, tiến hành kiểm tra các tính chất sinh vật hóa học và ngưng kết đặc hiệu để khẳng định là E.coli O157.
3. Thiết bị, Dụng cụ, Môi trường
3.1. Thiết bị, dụng cụ
Dụng cụ và thiết bị chuyên dụng trong phòng kiểm nghiệm vi sinh vật.
3.2. Môi trường
- Canh thang m-EC
- Nước muối sinh lý 8,50/00
- Kháng huyết thanh E. coli O157
- Thạch SMAC
- Thạch CLIG
- Thạch thường
4. Chuẩn bị môi trường và mẫu thử.
4.1. Chuẩn bị môi trường
Môi trường tăng sinh, nuôi cấy và dung dịch cần thiết được điều chế theo công thức Các môi trường được đóng sẵn vào bình cầu, bình nón, ống nghiệm và được hấp tiệt trùng (1100C/30 phút HOặC 1210C/15 phút).
4.2. Chuẩn bị mẫu thử
Mẫu thử được cắt nhỏ hoặc xay nhuyễn bằng máy trong điều kiện vô trùng cho tới khi được thể đồng nhất.
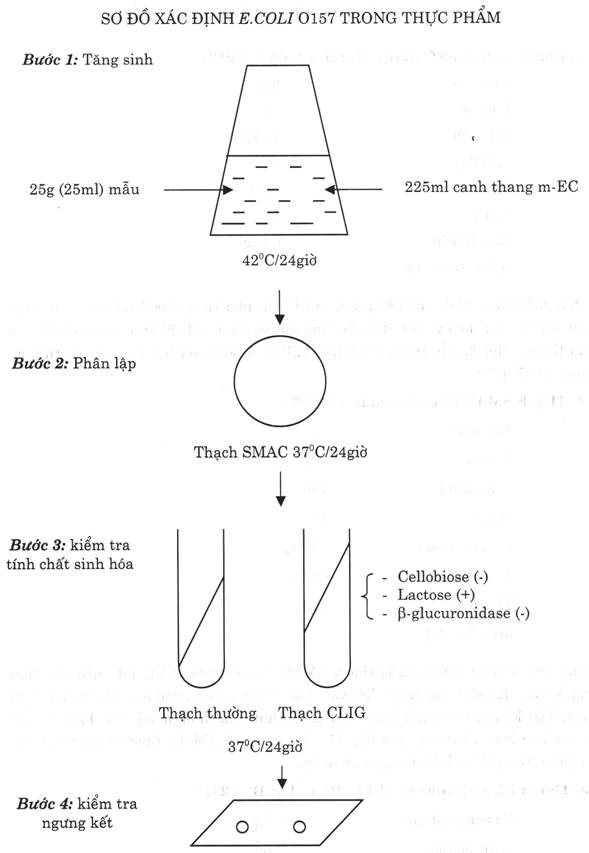
5.l. Bước 1: Tăng sinh
- Ghi ký hiệu mẫu lên bình nón có chứa 225 ml canh thang mc-EC.
- Cân chính xác 25 g thực phẩm đã chuẩn bị (hoặc dùng pipét vô trùng hút 25 ml thực phẩm lỏng) cho vào bình nón đã ghi ký hiệu mẫu, lắc đều rồi ủ ấm ở 420C/24 giờ.
5.2. Bước 2: Phân lập
- Từ bình nón canh thang m-EC đã ủ ấm, dùng que cấy vô trùng lấy canh khuẩn cấy phân vùng trên thạch SMAC để tạo các khuẩn lạc riêng rẽ.
- Ủ ấm 370C/24 giờ. Sau ủ ấm, đánh dấu những khuẩn lạc nghi ngờ E.coli O157 trên thạch SMAC có đặc điểm: tròn đều, mặt nhẵn, khống mầu, sáng đục (vì E.coli O157 không lên men đường sorbitol có trong thạch SMAC). Những khuẩn lạc E.coli khác có mầu đỏ, vì lên men đường sorbitol.
5.3. Bước 3: Kiểm tra tính chất sinh vật hóa học.
- Dùng que cấy nhọn đầu vô trùng lấy 1 khuẩn lạc nghi ngờ trên thạch SMAC cấy vào ống thạch thường và ống thạch CLIG như sau:
+ ống thạch thường: cấy ria lên mặt thạch.
+ ống thạch CLIJ:
* Phần thạch nghiêng: cấy ria lên mặt thạch.
* Phần thạch đứng: cấy đâm sâu ở chính giữa.
- Ủ ấm 370C/24 giờ. Sau ủ ấm đọc kết quả kiểm tra các tính chất sinh hóa trên ống thạch CLIG:
+ Phần thạch nghiêng: giữ nguyên mầu đỏ (cellobiose âm tính)
+ Phần thạch đứng: chuyển sang mầu vàng (lactose dương tính)
+ Ngay sau đó chiếu đèn UV có Bước sóng 365 nmi vào ống thạch CLIG, ống thạch CLIG không phát quang (b- glucuronidase âm tính).
Thạch CLIG có pH trung tính nên có mầu đỏ của chỉ thị mầu đỏ phênol. Trong thạch có 2 loại đường: cellobiose (10g/1ít) và lactose (lg/1ít). E.coli O157 không lên men đường cellobiose, nhưng lên men đường lactose tạo xít không bên vững đối với oxy. Phần nghiêng của thạch vì tiếp xúc nhiều với oxy có trong không khí nên pH vẫn trung tính, nên thạch giữ nguyên mầu đỏ. Còn phần đứng của thạch vì ít tiếp xúc với không khí nên pH thạch trở thành axit, do đó thạch chuyển sang mầu vàng.
Lưu ý: Mỗi mẫu thử nên bắt 3 khuẩn lạc nghi ngờ để kiểm tra tính chất sinh hóa. Khuẩn lạc nghi ngờ E.coli O157, có tính chất sinh vật hóa học của E.coli O157: cellobiose (-), lactose (+),b- glucuronidase (-), thì tiếp tục kiểm tra ngưng kết trên lam kính.
5.4. Bước 4: Kiểm tra ngưng kết trên lam kính
5.4.1. Kiểm tra hiện tượng tự ngưng kết
- Tiến hành: Lấy 1 lam kính trong, vô trùng, nhỏ 1 giọt nước muối sinh lý 8,50/00 vào bên trái lam kính. Dùng que cấy vô trùng lấy vi khuẩn ở ống thạch thường hòa vào giọt nước muối. Nghiêng đi nghiêng lại nhẹ nhàng lam kính vài lần sao cho vi khuẩn hòa đều vào giọt nước muối sinh lý.
- Đọc kết quả: Dùng kính lúp để quan sát. Nếu giọt nước muối sinh lý đục đều (tức không xảy ra hiện tượng ngưng kết), thì tiếp tục kiểm tra ngưng kết đặc hiệu.
5.4.2. Kiểm tra ngưng kết đặc hiệu
- Tiến hành: tiếp tục nhỏ 1 giọt kháng huyết thanh E.coli O157 lên lam kính.
Dùng que cấy vô trùng lấy vi khuẩn ở ống thạch thường hòa vào giọt kháng huyết thanh E.coli O157. Nghiêng đi nghiêng lại nhẹ nhàng lam kính vài lẩn sao cho vi khuẩn hòa đều vào giọt kháng huyết thanh E.coli O157.
Đọc kết quả: Dùng kính lúp để quan sát. Nếu giọt kháng huyết thanh E.coli O157 xuất hiện những hạt nhỏ (tức đã xảy ra hiện tượng ngưng kết giữa kháng nguyên và kháng thể). Có thể đối chiếu sự khác biệt với giọt nước muối ở bên cạnh.
Lưu ý:
- Chỉ được đọc kết quả ngưng kết trong vòng từ 30 giây đến 2 phút.
- Nếu xảy ra hiện tượng ngưng kết với nước muối sinh lý, thì không cần tiếp tục kiểm tra ngưng kết đặc hiệu (vì có thể nước muối sinh lý đã hỏng hoặc vi khuẩn phân lập không chính xác).
Tiêu chuẩn xác định là E. coli O157:
- Khuẩn lạc tròn đều, mặt nhẵn, không mầu, sáng đục.
- Không lên men đường cellobiose.
- Lên men đường lactose.
- Không có men b-glucuronidase.
- Ngưng kết với kháng huyết thanh E.coli O157.
1. Canh thang m-EC (hãng Merek - cođe l.14582)
Peptone 20g
Lactose 5g
Bile salts 1,12g
K2 HPO4 4g
KH2 PO4 l,5g
NaCL 5g
Novobiocin 0,02g
pH = 6,9 ± 0,2
Pha chế: Cân chính xác 36,7g bột m-EC, rồi pha trong 1000 ml nước cất. Đun nóng, khuấy đều cho tan bột. Rót vào bình nón có dung tíeh 500 ml, mỗi bình 225 ml canh thang. Tiệt khuẩn trong nồi hấp ở 1210C/15 phút, rồi bảo quản trong tủ lạnh không quá 7 ngày.
2. Thạch SMAC (Merck - code l.09207)
Bile salts lg
Peptone 19g
D-sorbitol l0g
Nacl 5g
Crystal violet 0,001g
Netral red 0,03g
Thạch 15g
pH = 7 ± 0,2
Pha chế: Cân chỉnh xác 25g thạch SMAC, rồi pha trong 500 ml nước cất. Đun nóng, khuấy đều cho tan thạch. Rót vào bình cầu dung tích 250 ml, mỗi bình 150 ml thạch. Tiệt khuẩn trong nồi hấp ở 1210C/15 phút. Thạch để nguội đến 450C, rồi rót vào các hộp lồng vô trùng, mỗi hộp 15 – 18 ml thạch. Để đĩa thạch đông tự nhiên, bảo quản trong tủ lạnh không quá 15 ngày.
3. Thạch CLIG (kyokuto - Nhật Bản - Lot BL.2231)
Casein peptone 7,5g
Meat peptone 2,5g
Lactose lg
Cellobiose 10g
Tryptophan 0,lg
MUG 0,02g
NaCL 5g
Phenol red 0,02g
Thạch 15g
ph = 7 ± 0,2
Pha chế: Cân chính xác 4, lg thạch CLIG , rồi phá trong 100 ml nước cất. Đun nóng, khuấy đều cho tan thạch. Rót vào ống nghiệm F = 12mm, mỗi ống 3 ml thạch. Tiệt khuẩn trong nồi hấp ở nhiệt độ l100C/80 phút, đợi thạch nguội, rồi để ống thạch nằm nghiêng (sao cho mặt nghiêng dài khọảng 2 cm) cho đến khi thạch đông, rồi bảo quản trong tủ lạnh không quá 15 ngày.
Cao thịt 1g
Peptone 2g
NaCL 1g
Thạch 3,6g
Nước cất 200ml
Pha chế: Cân chính xác cácthành phần môi trường. Đun nhỏ lửa khuấy đều đến khi sôi để hòa tan các chất. Điều chỉnh pH = 7,4 - 7,6. Rót vào ống nghiệm F= 16 mm, mỗi ống 5 ml thạch. Tiệt khuẩn trong nồi hấp ở l100C /30phút, đợi thạch nguội rồi để ống thạch nằm nghiêng cho đến khi thạch đông, rồi bảo quản trong tủ lạnh không quá 30 ngày./.
Lời nói đầu
52 TCN - TQTP 0009 : 2004 do Viện Dinh dưỡng biên soạn, Cục An toàn vệ sinh thực phẩm đề nghị, Bộ trưởng Bộ Y tế ban hành theo Quyết định số 4871/2004/QĐBYT ngày 31 tháng 12 năm 2004.
| BỘ Y TẾ
| TIÊU CHUẨN NGÀNH Y TẾ
| NHÓM TQTP 52 TCN-TQTP 0009:2004 Có hiệu lực sau 1 5 ngày, kể từ ngày đăng Công báo
|
| TRƯỜNG QUY KỸ THUẬT ĐỊNH DANH NẤM MỐC ASPERGILLUS PARASITICUS, ASPERGILLUS VERSICOLOR TRONG THỰC PHẨM |
Phương pháp này để định danh nấm mốc A.parasiticus, A.versicolor trong các sản phẩm lương thực thực phẩm.
Sử dụng kỹ thuật đổ đĩa, đếm khóm nấm trên môi trường thạch Sabouraud sau khi ủ hiếu khí ở nhiệt độ 28 ± 10C trong thời gian 5 ngày. Số lượng bào tử nấm mốc có trong 1g (1ml) mẫu kiểm tra được tính từ số khóm nấm đếm được từ các đĩa nuôi cấy theo các đậm độ pha loãng.
Sau đó, để xác định tên (định danh) nấm mốc (đến nhóm) phải tiến hành qua nhận xét đại thể về đặc điểm khóm nấm mốc (colony characters) và nhận xét vi thể về hình thái học của khóm nấm mốc (morphology).
3. Thiết bị, dụng cụ, môi trường
3.1. Thiết bị, dụng cụ
Dụng cụ và thiết bị chuyên dụng trong phòng kiểm nghiệm vi sinh vật.
3.2. Môi trường
- Thạch Sabouraud
- Thạch Czapeck
- Nước thạch 10/00
- Dung dịch Lactofenol Amann
4. Chuẩn bị môi trường và mẫu thừ
4.1. Chuẩn bị môi trường
Môi trường nuôi cấy, nước pha loãng và dung dịch cần thiết được điều chế theo công thức. Các môi trường được đóng sẵn vào bình cầu, bình nón, ống nghiệm và được hấp tiệt trùng (1100C/30 phút Hoặc 1210C/15 phút).
4.2. Chuẩn bị mẫu và dung dịch mẫu thử
4.2.1. Chuẩn bị mẫu
Mẫu thực phẩm được cắt nhỏ hoặc xay nhuyễn bằng máy trong điều kiện vô trùng cho tới khi được thể đồng nhất.
4.2.2. Chuẩn bị dung dịch mẫu thử 10-1
Cân chính xác 25g thực phẩm đã được chuẩn bị (hoặc hút 25ml thực phẩm lỏng), cho vào bình nón chứa sẵn 225ml nước thạch 10/00 . Lắc đều 2 - 3 phút, thu được dung dịch mẫu thử 10-1
4.2.3. Chuẩn bị dung dịch mẫu thử 10-2, 10-3 , 10-4...
- Hút chính xác 1 ml dung dịch mẫu thử 10-1 cho sang ống nghiệm chứa sẵn 9 ml nước thạch 10/00 . Lắc đều trong 2 - 3 phút, thu được dung dịch 10-2.
- Tiếp tục làm tương tự như vậy, ta thu được các dung dịch mẫu thử tương ứng
Bước 1: Nuôi cấy mẫu
- Ghi ký hiệu mẫu và nồng độ dung dịch mẫu thử lên hộp lồng.
- Dùng pipet 1 ml vô trùng, hút chính xác 1 ml từ dung dịch mẫu thử ở từng đậm độ cho vào giữa mỗi hộp lồng. Mỗi mẫu thực phẩm phải được nuôi cấy ít nhất 8 đậm độ pha loãng. Mỗi đậm độ pha loãng phải được nuôi cấy trong 2 hộp lồng vô trùng và dùng 1 pipet 1 ml vô trùng riêng.
- Đun nóng chảy thạch sabouraud, để nguội đến 45 ± l0C. Trong điều kiện vô trùng chỉnh pH của thạch đến 4,5 ¸ 5,5 bằng dung dịch axit lactic 20%, hoặc 40%, hay bằng dung dịch axit citric 20%.
- Rót vào từng hộp lồng 12 ¸ 15 ml thạch sabouraud, trộn đều dung dịch mẫu thử với thạch bằng cách xoay tròn sang phải và sang trái 3 lần.
- Để các đĩa thạch đông tự nhiên trên mặt phẳng ngang. Sau đó để các đĩa thạch vào tủ ấm 28 ± 10C Hoặc nhiệt độ phòng thí nghiệm tương ứng trong 5 ngày. Không lật ngược các đĩa.
Lưu ý: Thời gian từ khi bắt đầu pha loãng mẫu thử đến khi rót thạch vào hộp lồng không được quá 30 phút.
Bước 2: Sơ bộ nhận định kết quả trên thạch Sabouraud
- Chọn các đĩa có không quá 50 khóm nấm để sơ bộ đọc kết quả.
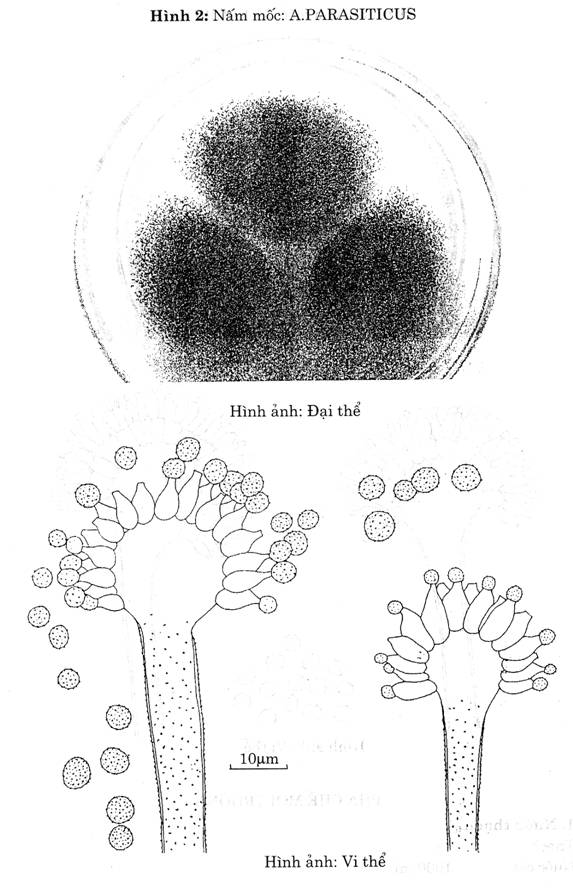
- Đếm và ghi lại số khóm nấm nghi ngờ là A.parasiticus (Có mầu xanh lá cây, hơi vàng) ở từng đậm độ. Sau đó dùng que cấy nhọn đầu lấy một ít bào tử cấy ba điểm cách đều nhau trên đĩa thạch Czapek, ủ ấm 28 ± 10C trong 5 ngày. Không lật ngược các đĩa.
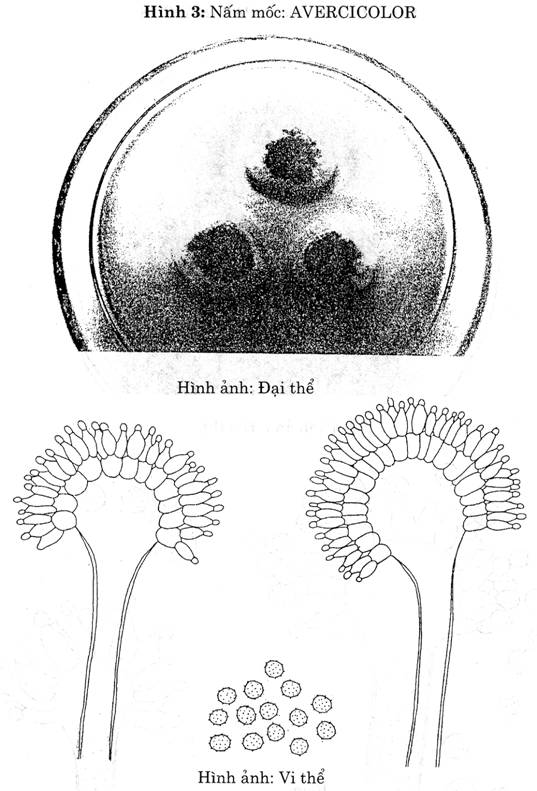
Đếm và ghi lại số khóm nấm nghi ngờ là A.versicolơr (Có nhiều mầu, viền ngoài mầu trắng rồi đến mầu xanh lục, ở giũa mẩu nâu hững. Đôi khi có mảng mầu vàng hoặc mầu hồng). ở từng đậm độ. Sau đó dùng que cấy nhọn đầu lấy một ít bào tử cấy ba điểm cách đều nhau trên (ra thạch Czapek, ủ ấm 28 + 10c: trong 5 ngày. Không lật ngược các đĩa.
Bước 3: Định danh
Để xác định tên nấm mốc, từ những khóm nấm trên thạch ezapek tiến hành nhận xét đại thể, vi thể.
Đại thể: Bằng mắt thường, hay dùng kính lúp cầm tay ta nhận xét về kích thước, mầu sắc ... của khóm nấm.
Vi thể: Để nhận xét nấm mốc về vi thể phải làm tiêu bản nấm mốc, rồi quan sát hình thái học dưới kính hiển vi ở vật kính 10, 40. Có thể chọn 1 trong 2 cách sau để làm tiêu bản nấm mốc:
Cách 1: Lấy một lam kính sạch, trong, đã sấy khô. Nhỏ 1 giọt Lactophenol Amann lên giữa lam kính. Dùng que cấy nhọn đầu lấy một phần khóm nấm mọc trên đĩa thạch Czapek (cả phần mọc trên và dưới mặt thạch) để vào giọt dung dịch Lactophenol Amann. Dùng kim có cán hay que cấy nhọn dìm nấm vào giọt dung dịch Lactophenol Amann để thấm ướt. Khi nấm bị thấm ướt hoàn toàn thì ta đậy lá kính lên trên và ép nhẹ.
Lưu ý:
- Khi đậy lá kính đừng để có bọt khí, nếu có sẽ gặp khó khăn trong khi soi kính.
- Khi ép nhẹ lá kính, nên dùng giấy thấm bớt dung dịch Laetophenol Amann thừa để dung dịch không tràn lên trên mặt lá kính.
Cách 2: Lấy một lam kính sạch, trong, đã sấy khô. Lấy một đoạn băng dính trong có kích thước rộng khoảng lam, dài khoảng 2-3cm, rồi chạm vào khóm nấm mọc trên đĩa thạch Czapek sao cho lấy được toàn bộ hình thái của nấm (từ tế bào chân đế đến hạt đính). Sau đó trải dài băng dính trong lên lam kính.
| Tên nấm mốc
| Đại thể
| Vi thể | ||||
| Hình dạng bông | Vách Cuống conidi | Hình dạng bọng | Thể bình | Hát đính (conidi)
| ||
| A.parasi ticus (Hình 2)
| Khóm nấm mốc có đường kính d = 2-3 cm trên thạch Czapek sau 5 ngày nuôi cấy. Khóm nấm mốc có mầu xanh lá cây, hơi vàng. Không bao giờ hóa nâu khi già. | Bông nhỏ Hình cầu tỏa tia
| Xù xì
| Hình gần cầu
| 1 tầng
| Hình cầu Vách có gai
|
| A. versic olor (Hình 3) .
| Khóm nấm mốc có đường kính 1-1,5 cm trên thạch Czapek sau 5 ngày nuôi cấy. Khóm nấm mốc có nhiều mầu khác. Ngoài cùng mầu trắng, rồi đến mầu xanh lục, ở giữa mầu nâu hồng. Tùy theo các chủng khác nhau, đôi khi có mảng mầu vàng, mầu hồng. | Bông nhỏ Hình cầu Tỏa tia
| Trơn
| Hình gần cầu đến elíp
| 2 tầng
| Hình cầu Vách có gai
|
Tính kết quả
Để xác định tổng số bào tử nấm mốc có trong lg (lml) mẫu kiểm nghiệm, chọn những đĩa có không quá 50 khóm nấm của 2 đậm độ pha loãng liên tiếp. Sự phân bố các khóm nấm phải hợp lý: Độ pha loãng càng cao thì số khóm nấm càng ít. Kết quả được tính theo công thức sau:
C
N = -------------------
(n1 + 0,1 x n2) x d
C : Số khóm nấm mốc đếm được trên các đĩa đã chọn.
n1, n2: Số đĩa ở 2 đậm độ pha loãng liên tiếp.
d: Hệ số pha loãng của đậm độ pha loãng thấp hơn.
N: Tổng số bào tử nấm mốc có trong lg (1ml) mẫu thực phẩm.
1. Nừu chênh lệch các giá trị ở 2 đậm đố lớn hơn 2 lần thì lấy giá trị ở đậm độ pha loãng thấp hơn để tính kết quả bằng cách tính trung bình cộng.
2. Nếu 2 đĩa của đậm độ pha loãng ban đầu có ít hơn 5 khóm nấm thì tính kết quả theo trung bình cộng.
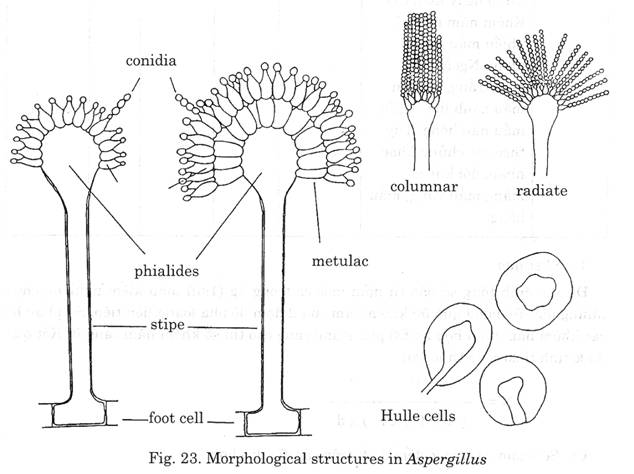
Hình ảnh 1: Hình thái học nấm mốc APERGLLUS
Foot cell: Tế bào chân đế
Conidiophore stipe: Cuốn conidi
Vesiele: Bọng
Metulac, Phialides: Thể bình
Conidia: Hạt dính hoặc bào tử
Columnar: Hình cột
Radiate: Hình tia
Hulle cells: Tế bào vỏ dầy
Pha chế: Đun nhỏ lửa, quấy đều đến khi sôi để hòa tan thạch. Rót vào các bình nón có dung tích 500 ml mỗi bình 225 ml môi trường, vào các ống nghiệm 18 mỗi ống 9 ml môi trường. Tiệt khuẩn trong nồi hấp ở nhiệt độ 1200C/15 phút.
Môi trường được bảo quản trong tủ lạnh với nhiệt độ từ đến 50C không qua 30 ngày.
2. Thạch Sabouraud
Pepton l0g
Glucose 20g
Thạch 15-20g
Nước cất 1000 ml
Pha chế: Đun nhỏ lửa, quấy đều đến khi sôi để hòa tan các chất. Rót vào bình cầu có dung tích 250 ml mỗi bình 150 ml môi trường. Tiệt khuẩn trong nồi hấp ở nhiệt độ 1100C/30 phút.
Nếu môi trường sử dụng ngay, để nguội đến 45 ± 10C ở nồi cách thủy, nếu chưa sử dụng thì bảo quản trong tủ lạnh với nhiệt độ từ 0 đến 50C không quá 30 ngày.
3. Thạch Czapek
NANO3 3,5g
K2HPO4 l,5g
MGSO4 0,5g
KCL 0,5g
FeSO4 0,lg
Đường kính 80g
Thạch 20g
Nước cất l000ml
pH = 4,5 ¸ 5,5
Pha chế: Đun nhỏ lửa, quấy đều đến khi sôi để hòa tan các chất. Để thạch nguội đến 45 ± 10C rồi chỉnh pH đến 4,5 ¸ 5,5. Rót vào bình cầu có dung tích 250 ml mỗi bình 150 ml môi trường. Tiệt khuẩn trong nồi hấp ở nhiệt độ 1100C/30 phút. Thạch để nguội đến 45 ± 10C rồi đổ vào các hộp lồng, mỗi hộp 15 ¸ 18 ml thạch. Để đĩa thạch đông tự nhiên, bảo quản trong tủ lạnh với nhiệt độ từ 0 đến 50C không quá 15 ngày.
4. Dung dịch Lactofenol Amann
A xít femc tinh khiết l0g
A xít lactic l0g
Glyxerin 20g
Nước cất l0g
Pha chế: Các thành phần trên đều cân chứ không đong. Ta cho xít fenic vào sau khi 3 chất trên đã trộn đều, lắc kỹ. Sau đó chứa đựng trong lọ thủy tinh có nút mài tối mầu, bảo quản nơi khô ráo, trong bóng tối ở nhiệt độ phòng. Dung dịch Lactofenol Amann khi mới pha thì không mầu, nhưng để lâu dung dịch chuyển sang mầu nâu nhưng vẫn dùng được./.
- 1Quyết định 26/2004/QĐ-BGTVT ban hành Tiêu chuẩn Ngành về QUY PHẠM PHÂN CẤP VÀ ĐÓNG TẦU SÔNG VỎ XIMĂNG LƯỚI THÉP do Bộ trưởng Bộ Giao thông vận tải ban hành
- 2Quyết định 33/2004/QĐ-BBCVT ban hành tiêu chuẩn Ngành về Thiết bị trạm gốc của hệ thống GSM, Máy di động do Bộ trưởng Bộ Bưu Chính, Viễn Thông ban hành
- 3Quyết định 3005/QĐ-BYT năm 2014 công bố kết quả hệ thống hóa văn bản quy phạm pháp luật về y tế tính đến ngày 31 tháng 12 năm 2013 do Bộ trưởng Bộ Y tế ban hành
- 1Quyết định 26/2004/QĐ-BGTVT ban hành Tiêu chuẩn Ngành về QUY PHẠM PHÂN CẤP VÀ ĐÓNG TẦU SÔNG VỎ XIMĂNG LƯỚI THÉP do Bộ trưởng Bộ Giao thông vận tải ban hành
- 2Quyết định 33/2004/QĐ-BBCVT ban hành tiêu chuẩn Ngành về Thiết bị trạm gốc của hệ thống GSM, Máy di động do Bộ trưởng Bộ Bưu Chính, Viễn Thông ban hành
- 3Nghị định 49/2003/NĐ-CP quy định chức năng nhiệm vụ, quyền hạn và cơ cấu tổ chức của Bộ Y tế
- 4Nghị định 179/2004/NĐ-CP quy định quản lý nhà nước về chất lượng sản phẩm, hàng hoá
- 5Tiêu chuẩn quốc gia TCVN 8989:2012 về Vi sinh vật trong thực phẩm - Phương pháp xác định Aspergillus parasiticus và Aspergillus versicolor giả định
- 6Tiêu chuẩn ngành 52 TCN-TQTP 0008:2004 - Thường quy kỹ thuật xác định E.coli 0157 trong thực phẩm
- 7Tiêu chuẩn ngành 52 TCN-TQTP 0009:2004 - Thường quy kỹ thuật định danh nấm mốc As - pergillus parasiticus, Aspergillus versi- color trong thực phẩm
Quyết định 4871/2004/QĐ-BYT ban hành Tiêu chuẩn ngành về Thường quy kỹ thuật xác định E.coli 0157 trong thực phẩm- 52 TCN-TQTP 0008 : 2004 , Thường quy kỹ thuật định danh nấm mốc As - pergillus parasiticus, Aspergillus versi- color trong thực phẩm- 52 TCN-TQTP 0009:2004 Y tế do Bộ trưởng Bộ Y tế ban hành
- Số hiệu: 4871/2004/QĐ-BYT
- Loại văn bản: Quyết định
- Ngày ban hành: 31/12/2004
- Nơi ban hành: Bộ Y tế
- Người ký: Trần Chí Liêm
- Ngày công báo: Đang cập nhật
- Số công báo: Số 10
- Ngày hiệu lực: 27/03/2005
- Ngày hết hiệu lực: 18/09/2012
- Tình trạng hiệu lực: Kiểm tra

