Để sử dụng toàn bộ tiện ích nâng cao của Hệ Thống Pháp Luật vui lòng lựa chọn và đăng ký gói cước.
| BỘ Y TẾ | CỘNG HÒA XÃ HỘI CHỦ NGHĨA VIỆT NAM |
| Số: 4401/QĐ-BYT | Hà Nội, ngày 09 tháng 11 năm 2012 |
BỘ TRƯỞNG BỘ Y TẾ
Căn cứ Nghị định số 63/2012/NĐ-CP ngày 31/8/2012 của Chính phủ quy định chức năng, nhiệm vụ, quyền hạn và cơ cấu tổ chức của Bộ Y tế;
Xét Biên bản họp ngày 17/11/2011 của Hội đồng nghiệm thu Quy trình kỹ thuật khám bệnh, chữa bệnh chuyên ngành Huyết học- Truyền máu- Miễn dịch- Di truyền của Bộ Y tế;
Theo đề nghị của Cục trưởng Cục Quản lý khám, chữa bệnh,
QUYẾT ĐỊNH:
Điều 1. Ban hành kèm theo Quyết định này 71 Quy trình kỹ thuật khám bệnh, chữa bệnh chuyên ngành Huyết học- Truyền máu- Miễn dịch- Di truyền.
Điều 2. Các Quy trình kỹ thuật khám bệnh, chữa bệnh chuyên ngành Huyết học- Truyền máu- Miễn dịch- Di truyền này áp dụng cho tất cả các cơ sở khám bệnh, chữa bệnh có đủ điều kiện thực hiện theo quy định hiện hành.
Điều 4. Các Ông, Bà: Chánh Văn phòng Bộ, Cục trưởng Cục Quản lý khám, chữa bệnh, Chánh thanh tra Bộ; các Vụ trưởng, Cục trưởng các Vụ, Cục của Bộ Y tế; Giám đốc các Bệnh viện, Viện có giường bệnh trực thuộc Bộ Y tế, Giám đốc Sở Y tế các tỉnh, thành phố trực thuộc trung ương; Thủ trưởng Y tế các Bộ, ngành và Thủ trưởng các đơn vị có liên quan chịu trách nhiệm thi hành Quyết định này./.
|
Nơi nhận: | KT. BỘ TRƯỞNG |
71 QUY TRÌNH KỸ THUẬT KHÁM BỆNH, CHỮA BỆNH CHUYÊN NGÀNH HUYẾT HỌC - TRUYỀN MÁU- MIỄN DỊCH- DI TRUYỀN
(Ban hành kèm theo Quyết định số 4401 ngày 09 tháng 11 năm 2012 của Bộ trưởng Bộ Y tế)
| TT | TÊN KỸ THUẬT |
| CHƯƠNG I. TẾ BÀO VÀ MÔ HỌC CƠ QUAN TẠO MÁU | |
| 1. | TỔNG PHÂN TÍCH TẾ BÀO MÁU NGOẠI VI (BẰNG MÁY) |
| 2. | HUYẾT ĐỒ (BẰNG MÁY) |
| 3. | LÀM THỦ THUẬT CHỌC HÚT TỦY XƯƠNG LÀM TỦY ĐỒ |
| 4. | XÉT NGHIỆM TỦY ĐỒ |
| 5. | MÁU LẮNG (PHƯƠNG PHÁP THỦ CÔNG) |
| 6. | TẬP TRUNG BẠCH CẦU |
| 7. | HẠCH ĐỒ |
| 8. | LÁCH ĐỒ |
| 9. | XÉT NGHIỆM TẾ BÀO HẠCH |
| 10. | LÀM THỦ THUẬT SINH THIẾT TỦY XƯƠNG |
| 11. | PHƯƠNG PHÁP NHUỘM PEROXYDASE |
| 12. | KỸ THUẬT NHUỘM SOUDAN ĐEN |
| 13. | KỸ THUẬT NHUỘM P.A.S |
| 14. | NHUỘM ESTERASE KHÔNG ĐẶC HIỆU |
| 15. | KỸ THUẬT NHUỘM HỒNG CẦU SẮT |
| 16. | CHẨN ĐOÁN TẾ BÀO HỌC HẠCH, LÁCH |
| 17. | KỸ THUẬT NHUỘM HỆ TIÊU BẢN SINH THIẾT MÔ MỀM |
| 18. | KỸ THUẬT NHUỘM HỆ TIÊU BẢN SINH THIẾT TỦY XƯƠNG |
| CHƯƠNG II. ĐÔNG CẦM MÁU | |
| 19. | THỜI GIAN MÁU CHẢY |
| 20. | CO CỤC MÁU ĐÔNG |
| 21. | THỜI GIAN PROTHROMBIN BẰNG MÁY TỰ ĐỘNG/BÁN TỰ ĐỘNG |
| 22. | THỜI GIAN THROMBOPLASTIN TỪNG PHẦN HOẠT HÓA |
| 23. | THỜI GIAN THROMBIN BẰNG MÁY TỰ ĐỘNG/BÁN TỰ ĐỘNG |
| 24. | NGHIỆM PHÁP VON-KAULLA |
| 25. | ĐỊNH LƯỢNG D-DIMER |
| 26. | NGƯNG TẬP TIỂU CẦU VỚI ADP/COLLAGEN/ACIDARACHIDONIC/THROMBIN/EPINEPHRIN |
| 27. | NGƯNG TẬP TIỂU CẦU VỚI RISTOCETIN |
| 28. | THỜI GIAN PHỤC HỒI CANXI |
| 29. | ĐỊNH LƯỢNG TỪNG YẾU TỐ ĐÔNG MÁU NỘI SINH (VIII , IX, XI) |
| 30. | ĐỊNH LƯỢNG TỪNG YẾU TỐ ĐÔNG MÁU NGOẠI SINH (II, V, VII, X) |
| 31. | ĐỊNH TÍNH YẾU TỐ XIII |
| 32. | PHÁT HIỆN CHẤT ỨC CHẾ ĐÔNG MÁU CON ĐƯỜNG NỘI SINH |
| 33. | ĐỊNH TÍNH ỨC CHẾ YẾU TỐ VIII:C |
| 34. | ĐỊNH LƯỢNG ỨC CHẾ YẾU TỐ VIII: C |
| 35. | ĐỊNH LƯỢNG PHỨC HỆ FIBRINMONOMER HÒA TAN (FMS/ FM: FIBRIN MONOMER SOLUBLE) |
| 36. | ĐỊNH LƯỢNG AT/AT III |
| 37. | ĐỊNH LƯỢNG KHÁNG NGUYÊN PROTEIN C |
| 38. | (Protein C Antigen) |
| 39. | ĐỊNH LƯỢNG HOẠT TÍNH PROTEIN C |
| 40. | ĐỊNH LƯỢNG PROTEIN S TỰ DO |
| 41. | PHÁT HIỆN KHÁNG ĐÔNG LUPUS (LA/LAC) |
| 42. | ĐỊNH LƯỢNG FIBRINOGEN BẰNG MÁY TỰ ĐỘNG |
| 43. | THỜI GIAN TIÊU EUGLOBULIN |
| 44. | ĐÁNH GIÁ TỔNG QUÁT CHỨC NĂNG TIỂU CẦU BẰNG MÁY TỰ ĐỘNG (PFA: Platelet Function Analyzer) |
| 45. | ĐỊNH LƯỢNG HOẠT TÍNH YẾU TỐ VON WILLEBRAND |
| 46. | ĐỊNH LƯỢNG KHÁNG NGUYÊN YẾU TỐ VON WILLEBRAND (VWF:Ag) |
| 47. | ĐÀN HỒI ĐỒ CỤC MÁU |
| 48. | ĐỊNH LƯỢNG FDP (FDP: Fibrin and fibrinogen Degradation Product) |
| 49. | ĐỊNH LƯỢNG ANTI Xa |
| 50. | XÉT NGHIỆM CÔNG THỨC NHIỄM SẮC THỂ TỦY XƯƠNG |
| CHƯƠNG III. DI TRUYỀN- MIỄN DỊCH HUYẾT HỌC | |
| 51. | ĐẾM SỐ LƯỢNG TẾ BÀO GỐC TẠO MÁU TRÊN MÁY CYTOMICS FC-500 |
| 52. | ĐỊNH LƯỢNG VIRUS CYTOMEGALO (CMV) BẰNG KỸ THUẬT REAL-TIME PCR |
| 53. | PHÁT HIỆN ĐỘT BIẾN INTRON18/BCLI BẰNG KỸ THUẬT PCR-RFLP |
| 54. | PHÁT HIỆN ĐẢO ĐOẠN INTRON 22 CỦA GEN YẾU TỐ VIII BỆNH HEMOPHILIA A BẰNG KỸ THUẬT LONGRANGE- PCR |
| 55. | XÉT NGHIỆM ĐỊNH TYP HLA BẰNG KỸ THUẬT SINH HỌC PHÂN TỬ |
| 56. | XÁC ĐỊNH GEN BỆNH MÁU BẰNG KỸ THUẬT RT-PCR |
| 57. | KHÁNG THỂ KHÁNG NHÂN ANA (antinuclear antibodies) BẰNG KỸ THUẬT ELISA |
| 58. | KHÁNG THỂ KHÁNG DsDNA (Anti double stranded DNA) BẰNG PHƯƠNG PHÁP ELISA |
| 59. | XÉT NGHIỆM HLA - B27 BẰNG KỸ THUẬT FLOWCYTOMETRY |
| 60. | PHÂN TÍCH MYELOPEROXIDASE (MPO) NỘI BÀO |
| 61. | XÉT NGHIỆM CD55-CD59 HỒNG CẦU |
| 62. | KHÁNG THỂ KHÁNG CARDIOLIPIN (ANTI-CARDIOLIPLN) BẰNG KỸ THUẬT ELISA |
| 63. | ĐIỆN DI MIỄN DỊCH TRÊN MÁY CAPILLARY2 |
| 64. | PHÂN LOẠI MIỄN DỊCH BẰNG KỸ THUẬT FLOW CYTOMETRY TRÊN MÁY CYTOMIC FC500 |
| 65. | LẤY MÁU TOÀN PHẦN TỪ NGƯỜI HIẾN MÁU |
| CHƯƠNG IV. TRUYỀN MÁU | |
| 66. | XÉT NGHIỆM SÀNG LỌC ĐƠN VỊ MÁU VÀ THÀNH PHẦN MÁU AN TOÀN |
| 67. | ĐIỀU CHẾ KHỐI TIỂU CẦU BẰNG PHƯƠNG PHÁP TÁCH LỚP TIỂU CẦU, BẠCH CẦU |
| 68. | ĐIỀU CHẾ TÙA LẠNH |
| 69 | XÉT NGHIỆM HÒA HỢP MIỄN DỊCH TRUYỀN MÁU VÀ CẤP PHÁT MÁU AN TOÀN |
| 70. | ĐỊNH NHÓM MÁU HỆ ABO (KỸ THUẬT ỐNG NGHIỆM) |
| 71. | ĐỊNH NHÓM MÁU HỆ Rh (D) (KỸ THUẬT ỐNG NGHIỆM) |
LỜI NÓI ĐẦU
Bộ Y tế đã xây dựng và ban hành Hướng dẫn Quy trình kỹ thuật bệnh viện tập I(năm 1999), tập II(năm 2000) và tập III(năm 2005), các quy trình kỹ thuật đó là quy chuẩn về quy trình thực hiện các kỹ thuật trong khám, chữa bệnh.
Tuy nhiên, trong những năm gần đây khoa học công nghệ trên thế giới phát triển rất mạnh, trong đó có các kỹ thuật công nghệ phục vụ cho ngành Y tế trong việc khám bệnh, điều trị, theo dõi và chăm sóc người bệnh. Nhiều kỹ thuật, phương pháp trong khám bệnh, chữa bệnh đã được cải tiến, phát minh, nhiều quy trình kỹ thuật chuyên môn trong khám bệnh, chữa bệnh đã có những thay đổi về mặt nhận thức cũng như về mặt kỹ thuật.
Nhằm cập nhật, bổ sung và chuẩn hóa các tiến bộ mới về số lượng và chất lượng kỹ thuật trong khám bệnh, chữa bệnh, Bộ trưởng Bộ Y tế đã thành lập Ban Chỉ đạo xây dựng quy trình kỹ thuật trong khám bệnh, chữa bệnh do Lãnh đạo Bộ Ytế làm Trưởng ban. Trên cơ sở đó Bộ Ytế có các Quyết định thành lập các Hội đồng biên soạn Quy trình kỹ thuật trong khám, chữa bệnh theo các chuyên khoa, chuyên ngành mà Chủ tịch Hội đồng là Giám đốc các Bệnh viện chuyên khoa, đa khoa hoặc các chuyên gia hàng đầu của Việt Nam. Các Hội đồng phân công các Giáo sư, Phó Giáo sư, Tiến sĩ, Bác sĩ chuyên khoa theo chuyên khoa sâu biên soạn các nhóm Hướng dẫn quy trình kỹ thuật. Mỗi Hướng dẫn quy trình kỹ thuật đều được tham khảo các tài liệu trong nước, nước ngoài và chia sẻ kinh nghiệm của các đồng nghiệp thuộc chuyên khoa, chuyên ngành. Việc hoàn chỉnh mỗi Hướng dẫn quy trình kỹ thuật cũng tuân theo quy trình chặt chẽ bởi các Hội đồng khoa học cấp bệnh viện và các Hội đồng nghiệm thu của chuyên khoa đó do Bộ Y tế thành lập. Mỗi Hướng dẫn quy trình kỹ thuật trong khám bệnh, chữa bệnh đảm bảo được nguyên tắc ngắn gọn, đầy đủ, khoa học và theo một thể thức thống nhất.
Hướng dẫn quy trình kỹ thuật trong khám bệnh, chữa bệnh là tài liệu hướng dẫn chuyên môn kỹ thuật, là cơ sở pháp lý để thực hiện tại các cơ sở khám bệnh, chữa bệnh trong toàn quốc được phép thực hiện kỹ thuật đã được cấp có thẩm quyền phê duyệt theo quy định của Luật Khám bệnh, chữa bệnh đồng thời cũng là cơ sở để xây dựng giá dịch vụ kỹ thuật, phân loại phẫu thuật, thủ thuật và những nội dung liên quan khác. Do số lượng danh mục kỹ thuật trong khám bệnh, chữa bệnh rất lớn mà mỗi Hướng dẫn quy trình kỹ thuật trong khám, chữa bệnh từ khi biên soạn đến khi Quyết định ban hành chứa đựng nhiều yếu tố, điều kiện nghiêm ngặt nên trong một thời gian ngắn không thể xây dựng, biên soạn và ban hành đầy đủ các Hướng dẫn quy trình thuật. Bộ Ytế sẽ Quyết định ban hành những Hướng dẫn quy trình kỹ thuật trong khám bệnh, chữa bệnh cơ bản, phổ biến theo từng chuyên khoa, chuyên ngành và tiếp tục ban hành bổ sung những Hướng dẫn quy trình kỹ thuật đối với mỗi chuyên khoa, chuyên ngành nhằm đảm bảo sự đầy đủ theo Danh mục kỹ thuật trong khám bệnh, chữa bệnh.
Để giúp hoàn thành các Hướng dẫn quy trình kỹ thuật này, Bộ Ytế trân trọng cảm ơn, biểu dương và ghi nhận sự nỗ lực tổ chức, thực hiện của Lãnh đạo, Chuyên viên Cục Quản lý Khám, chữa bệnh, sự đóng góp của Lãnh đạo các Bệnh viện, các Giáo sư, Phó Giáo sư, Tiến sĩ, Bác sĩ chuyên khoa, chuyên ngành là tác giả hoặc là thành viên của các Hội đồng biên soạn, Hội đồng nghiệm thu Hướng dẫn quy trình kỹ thuật trong khám bệnh, chữa bệnh và các nhà chuyên môn đã tham gia góp ý cho tài liệu.
Trong quá trình biên tập, in ấn tài liệu khó có thể tránh được các sai sót, Bộ Ytế mong nhận được sự góp ý gửi về Cục Quản lý Khám, chữa bệnh-Bộ Y tế 138A-Giảng Võ-Ba Đình-Hà Nội./.
TẾ BÀO VÀ MÔ HỌC CƠ QUAN TẠO MÁU
TỔNG PHÂN TÍCH TẾ BÀO MÁU NGOẠI VI (BẰNG MÁY)
I. ĐẠI CƯƠNG
Các chỉ số tế bào máu phản ánh trực tiếp hoặc gián tiếp tình trạng sinh lý hoặc một số bệnh lý của cơ thể. Do có quan hệ mật thiết với mọi tổ chức nên máu có khả năng cung cấp những bằng chứng sớm nhất về các thay đổi tình trạng sức khỏe và tiến triển bệnh lý.
II. CHUẨN BỊ
1. Người thực hiện
- 01 điều dưỡng lấy máu người bệnh.
- 01 kỹ thuật viên làm xét nghiệm (làm bằng máy).
2. Phương tiện - hóa chất
- Máy đếm tế bào tự động hoặc bán tự động kèm máy in.
- Máy lắc ống máu.
- Bàn sấy (đèn hoặc máy sấy tiêu bản).
- Cóng (bể) nhuộm tiêu bản.
- Giá cắm tiêu bản.
- Kính hiển vi quang học.
- Máy lập công thức bạch cầu.
- Ống nghiệm có chất chống đông.
- Giá cắm ống xét nghiệm.
- Lam kính, lam kéo.
- Bút chì đánh dấu, bút dạ ghi số, bút bi vào sổ.
- Bông cồn sát trùng, ga-rô.
- Kim lấy máu tĩnh mạch.
- Băng urgo.
- Dầu soi kính, gạc lau kính.
- Giấy xét nghiệm.
- Găng tay.
- Máu chuẩn máy.
- Dung dịch chạy máy, rửa máy.
- Cồn tuyệt đối cố định tiêu bản.
- Dung dịch Giemsa mẹ.
- Nước trung tính.
- Túi rác các loại.
3. Người bệnh
Có thể xét nghiệm ở mọi thời điểm, tốt nhất làm vào buổi sáng, chưa ăn gì và không phải chuẩn bị gì đặc biệt.
4. Phiếu xét nghiệm
Giấy chỉ định xét nghiệm (biểu mẫu số 30/BV 01), có ghi đầy đủ thông tin về người bệnh: họ tên, năm sinh, địa chỉ, khoa phòng, số giường, chẩn đoán, có đánh dấu những thông số cần xét nghiệm, ghi rõ ngày tháng năm và chữ ký bác sĩ ra y lệnh.
Nếu là xét nghiệm cấp cứu thì giấy xét nghiệm có đánh dấu chéo ô cấp cứu.
III. CÁC BƯỚC TIẾN HÀNH
1. Lấy bệnh phẩm
- Người cần xét nghiệm hoặc y tá điều dưỡng đưa giấy chỉ định xét nghiệm.
- Lấy 2ml máu tĩnh mạch trực tiếp từ người bệnh (theo quy trình lấy máu tĩnh mạch), cho vào ống chống đông, lắc đều hoặc nhận ống máu người bệnh do điều dưỡng lấy sẵn (mẫu máu phải đạt yêu cầu về số lượng và chất lượng, điều dưỡng phải ghi và ký nhận vào sổ nhận bệnh phẩm), trên ống phải ghi đầy đủ thông tin phù hợp với giấy xét nghiệm.
2. Tiến hành kỹ thuật
- Đánh số thứ tự lên giấy xét nghiệm và ống máu người bệnh (cùng một số).
- Vào sổ theo thứ tự ghi trên giấy xét nghiệm.
- Lắc đều ống máu (bằng máy lắc nếu có).
- Cho máu vào chạy máy (theo quy trình chạy máy đếm tế bào). Số thứ tự trên máy cũng cùng số với ống máu. In (ghim) kết quả vào giấy xét nghiệm.
- Kéo tiêu bản và nhuộm Giemsa (theo quy trình kéo nhuộm tiêu bản).
IV. NHẬN ĐỊNH KẾT QUẢ
- Đọc trên kính hiển vi và đối chiếu tiêu bản với kết quả chạy máy.
- Nếu phù hợp, nhân viên xét nghiệm ký, ghi ngày tháng xét nghiệm và trả.
- Nếu không phù hợp phải kiểm tra lại.
- Nếu quá khả năng phải báo cáo bác sĩ trong khoa hoặc người phụ trách.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Nhầm mẫu bệnh phẩm.
- Máy chạy không đúng hoặc nhầm kết quả.
- Mẫu bệnh phẩm lấy không đủ số lượng, bị đông, hoặc vỡ hồng cầu. Những trường hợp này cần yêu cầu lấy lại mẫu bệnh phẩm.
- Thay đổi mật độ tế bào và không giữ được tính nguyên vẹn của tế bào.
- Thời gian từ khi lấy máu ra khỏi thành mạch đến khi làm xét nghiệm quá 6 tiếng.
I. ĐẠI CƯƠNG
Nhiều tình trạng sinh lý và bệnh lý của cơ thể được phản ánh trực tiếp hoặc gián tiếp qua số lượng, hình thái cũng như thành phần các tế bào máu. Huyết đồ là bản tổng kết có bình luận các biểu hiện đó. Qua đó có thể đưa ra một số định hướng cho các bác sĩ điều trị.
II. CHUẨN BỊ
1. Người thực hiện
- 01 điều dưỡng lấy máu xét nghiệm.
- 01 kỹ thuật viên thực hiện xét nghiệm.
- 01 bác sĩ chuyên khoa huyết học đọc kết quả.
2. Phương tiện - hóa chất
- Máy đếm tế bào tự động hoặc bán tự động kèm máy in.
- Máy lắc ống máu.
- Bàn sấy (đèn hoặc máy sấy tiêu bản).
- Tủ ấm 370C
- Cóng (bể) nhuộm tiêu bản.
- Giá cắm tiêu bản.
- Kính hiển vi quang học.
- Máy lập công thức bạch cầu.
- Ống nghiệm có chất chống đông.
- Giá cắm ống xét nghiệm.
- Lam kính, lam kéo.
- Bút chì đánh dấu, bút dạ ghi số, bút bi vào sổ.
- Bông cồn sát trùng, ga-rô.
- Kim lấy máu tĩnh mạch.
- Băng urgo.
- Dầu soi kính, gạc lau kính.
- Giấy xét nghiệm.
- Găng tay.
- Máu chuẩn máy.
- Dung dịch chạy máy, rửa máy.
- Hóa chất làm hồng cầu lưới (xanh cresyl pha trong cồn).
- Cồn tuyệt đối cố định tiêu bản.
- Dung dịch Giemsa mẹ.
- Nước trung tính.
- Máy vi tính và máy in.
- Túi rác các loại.
3. Người bệnh
Có thể xét nghiệm ở mọi thời điểm, tốt nhất làm vào buổi sáng, chưa ăn gì và không phải chuẩn bị gì đặc biệt.
4. Phiếu xét nghiệm
Giấy chỉ định xét nghiệm (biểu mẫu số 33/BV - 99), có ghi đầy đủ thông tin về người bệnh: họ tên, năm sinh, địa chỉ, khoa phòng, số giường, chẩn đoán, yêu cầu xét nghiệm, ghi rõ ngày tháng năm và chữ ký bác sĩ ra y lệnh.
III. CÁC BƯỚC TIẾN HÀNH
1. Lấy bệnh phẩm
- Người cần xét nghiệm hoặc điều dưỡng viên đưa giấy chỉ định xét nghiệm.
- Lấy 2ml máu tĩnh mạch trực tiếp từ người bệnh cho vào ống chống đông, lắc đều (theo quy trình lấy máu tĩnh mạch) hoặc nhận ống máu người bệnh do điều dưỡng viên lấy sẵn (máu phải đảm bảo số lượng cũng như chất lượng, điều dưỡng viên phải ghi vào sổ nhận bệnh phẩm ngày giờ đưa xét nghiệm và ký tên), trên ống có ghi đầy đủ thông tin phù hợp với giấy xét nghiệm.
2. Tiến hành kỹ thuật
- Đánh số thứ tự lên giấy xét nghiệm và ống máu người bệnh (cùng một số).
- Vào sổ theo thứ tự ghi trên giấy xét nghiệm.
- Lắc đều ống máu (bằng máy lắc nếu có).
Cho máu vào chạy máy (theo quy trình chạy máy đếm tế bào). Số thứ tự trên máy cũng cùng số với ống máu. In kết quả vào giấy riêng rồi ghim vào giấy xét nghiệm.
- Kéo tiêu bản và nhuộm Giemsa (theo quy trình kéo nhuộm tiêu bản).
Làm hồng cầu lưới (cho vào ống nghiệm nhỏ 2 giọt máu, 1 giọt xanh cresyl, lắc đều, nút kín, cho vào tủ ấm 370C trong 15-20 phút, lấy ra kéo tiêu bản, để khô tự nhiên rồi đọc trên kính hiển vi quang học) và tính số lượng hồng cầu lưới trong 1000 hồng cầu trưởng thành, ghi kết quả vào giấy xét nghiệm.
- Lưu ý nếu sử dụng máy đếm tế bào có kèm hồng cầu lưới thì bước này không phải làm.
IV. NHẬN ĐỊNH KẾT QUẢ
- Đọc tiêu bản nhuộm Giemsa trên kính hiển vi, đối chiếu với kết quả chạy máy và ghi đầy đủ các thông số cùng với ý kiến nhận xét vào giấy xét nghiệm. Có thể đưa ra một số yêu cầu xét nghiệm thêm hoặc định hướng chẩn đoán (nếu cần). Ghi ngày tháng năm đọc kết quả và bác sĩ ký tên.
- Vào sổ lưu kết quả hoặc vào máy vi tính.
- Trả kết quả.
- Xét nghiệm trả trong vòng 24 giờ.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Nhầm mẫu bệnh phẩm.
- Nhầm tiêu bản.
- Máy chạy kết quả không đúng hoặc bị nhầm.
- Mẫu bệnh phẩm lấy không đủ số lượng, bị đông, hoặc vỡ hồng cầu. Những trường hợp này cần yêu cầu lấy lại mẫu bệnh phẩm.
- Thay đổi mật độ tế bào và không giữ được tính nguyên vẹn của tế bào.
I. ĐẠI CƯƠNG
Tủy xương là cơ quan tạo máu quan trọng và là nơi sinh máu chủ yếu ở người trưởng thành. Tủy đồ là xét nghiệm thăm dò chức năng tạo máu cũng như gợi ý các nguyên nhân gây rối loạn chức năng này ở tủy qua phân tích số lượng và hình thái các tế bào tủy xương.
II. CHỈ ĐỊNH
- Khi xét nghiệm tổng phân tích tế bào máu ngoại vi không bình thường mà không xác định được nguyên nhân bằng các xét nghiệm khác.
- Người bệnh sốt không rõ nguyên nhân.
- Chẩn đoán rối loạn sự sinh máu: rối loạn sinh tủy, lơ xê mi, rối loạn tăng sinh tủy.
- Chẩn đoán những rối loạn miễn dịch: đa u tủy xương.
- Kiểm tra tình trạng tủy của người bệnh bị u lympho ác tính và u các tổ chức khác.
- Theo dõi đáp ứng điều trị.
- Đánh giá tình trạng tủy xương ở người bệnh cấy ghép tủy.
- Tình trạng sinh máu của tủy trong các bệnh lý khác: nhiễm trùng, bệnh hệ thống, ung thư di căn, sau điều trị tia xạ hoặc lao.
III. CHỐNG CHỈ ĐỊNH
Tương đối: - Bệnh nhân hemophillia.
- Không làm thủ thuật tại vị trí đang có nhiễm trùng.
IV. CHUẨN BỊ
1. Người thực hiện
- 01 bác sĩ chuyên khoa huyết học làm thủ thuật và đọc kết quả.
- 02 kỹ thuật viên chuyên khoa phụ làm thủ thuật, làm tiêu bản...
2. Phương tiện - hóa chất
- Phòng làm thủ thuật có trang bị giường thủ thuật, đèn làm thủ thuật, điều hòa, máy sưởi, lavabo, xe đẩy dụng cụ.
- Nồi hấp ướt, hấp sấy dụng cụ vô trùng.
- Tủ thuốc cấp cứu (có đủ thuốc chống phản vệ, chống chảy máu).
- Bàn sấy (hoặc đèn hoặc máy sấy tiêu bản).
- Giá cắm tiêu bản.
- Ống nghiệm có chất chống đông EDTA.
- Giá cắm ống xét nghiệm.
- Lam kính, lam kéo.
- Bút chì đánh dấu tiêu bản, bút dạ ghi số ống, bút bi vào sổ.
- Bông cồn 700, cồn iốt sát trùng, ga-rô.
- Bơm kim tiêm lấy máu tĩnh mạch.
- Băng urgo.
- Giấy xét nghiệm, sổ sách.
- Găng tay vô trùng.
- Mũ, khẩu trang, quần áo bảo hộ lao động
- Bơm kim tiêm gây tê.
- Kim chọc tủy.
- Xi lanh hút dịch tủy loại 10ml.
- Thuốc gây tê.
- Xốp cầm máu.
- Kẹp phẫu tích, kéo.
- Khay chữ nhật, khay quả đậu, bát kền...
- Hộp đựng kim, hộp đựng dụng cụ, đồ vải hấp sấy.
- Săng vô trùng.
- Ga trải giường.
- Túi rác các loại.
3. Người bệnh
- Nên làm xét nghiệm vào buổi sáng.
- Phải được bác sĩ tư vấn, giải thích trước khi làm xét nghiệm để người bệnh yên tâm và cùng cộng tác.
- Thử test thuốc gây tê có kết quả âm tính.
4. Phiếu xét nghiệm
- Có giấy chỉ định xét nghiệm huyết tủy đồ (theo biểu mẫu số 33/BV - 99), ghi đầy đủ thông tin về người bệnh: họ tên, năm sinh, địa chỉ, khoa phòng, số giường, chẩn đoán, yêu cầu xét nghiệm, ghi rõ ngày tháng năm và chữ ký bác sĩ ra y lệnh. Có ghi ngày hẹn làm xét nghiệm của labo (trường hợp đông người bệnh).
- Có kết quả xét nghiệm HIV âm tính.
- Có kết quả thử test thuốc gây tê âm tính với chữ ký của người đọc kết quả.
V. CÁC BƯỚC TIẾN HÀNH
1. Kiểm tra hồ sơ
Có đầy đủ như trên
2. Kiểm tra người bệnh
Đã có thử test
3. Thực hiện kỹ thuật
- Chuẩn bị đầy đủ trang thiết bị, dụng cụ, hóa chất cần thiết.
- Người thực hiện kỹ thuật trang bị bảo hộ đầy đủ.
- Gọi người bệnh vào theo thứ tự (ưu tiên người bệnh nặng, người già, trẻ nhỏ).
- Cho người bệnh nằm xuống giường.
- Lấy máu tĩnh mạch (quy trình lấy máu tĩnh mạch) cho vào ống chống đông EDTA và kéo 4-6 tiêu bản máu đàn.
- Cho người bệnh nằm sấp nếu chọc ở vị trí gai chậu sau trên, nằm ngửa nếu chọc ở gai chậu trước trên hoặc xương ức.
- Bộc lộ vị trí làm thủ thuật (xương ức, gai chậu sau trên hoặc trước trên).
- Trải săng.
- Xác định vị trí chọc.
- Sát trùng vị trí chọc bằng cồn iốt, sau đó bằng cồn 700.
- Sát trùng tay bằng cồn 700.
- Gây tê vị trí chọc theo lớp (da, cơ, màng xương), khi chọc vào màng xương bơm thuốc tê sẽ có cảm giác hơi nặng tay, chờ 3-5phút.
- Chọc kim qua 3 lớp như trên, lúc qua xương vào đến ổ tủy có cảm giác nhẹ tay hơn, hút lấy 0,5ml dịch tủy, lúc hút người bệnh có cảm giác hơi đau tức, cho vào ống chống đông 0,3ml dịch, còn lại gạn lấy cặn kéo 8-10 tiêu bản, có thể làm lam áp nếu cần.
- Băng cầm máu bằng xốp cầm máu và băng urgo.
VI. THEO DÕI
Theo dõi trong vòng 15 phút không thấy máu thấm ra băng thì cho người bệnh về.
VII. XỬ TRÍ TAI BIẾN
Nói chung ít có tai biến.
Có thể người bệnh lo lắng, sợ hãi: cần giải thích rõ để người bệnh yên tâm, trẻ em có thể dùng tiền mê, an thần nhẹ.
- Đau: gây tê tốt vị trí chọc.
- Máu chảy ra ở vị trí chọc tủy, dùng tay ép chặt một lúc, đặt xốp cầm máu và băng ép là được.
- Sốc dị ứng thuốc gây tê: phải thử test trước.
- Gãy kim, tụt đốc kim: do kim sử dụng lại quá nhiều lần hoặc kim chất lượng không đảm bảo. Nên sử dụng kim dùng một lần.
- Nhiễm trùng nơi chọc: dụng cụ và thao tác phải đảm bảo vô trùng.
I. Đại cương
Tủy xương là cơ quan tạo máu quan trọng và là nơi sinh máu chủ yếu ở người trưởng thành. Tủy đồ là xét nghiệm thăm dò chức năng tạo máu cũng như gợi ý các nguyên nhân gây rối loạn chức năng này ở tủy qua phân tích số lượng và hình thái các tế bào tủy xương.
II. CHỈ ĐỊNH
- Khi xét nghiệm tổng phân tích tế bào máu ngoại vi không bình thường mà không xác định được nguyên nhân bằng các xét nghiệm khác.
- Người bệnh sốt không rõ nguyên nhân.
- Chẩn đoán rối loạn sự sinh máu: rối loạn sinh tủy, lơ xê mi, rối loạn tăng sinh tủy.
- Chẩn đoán những rối loạn miễn dịch: đa u tủy xương.
- Kiểm tra tình trạng tủy của người bệnh bị u lympho ác tính và u các tổ chức khác.
- Theo dõi đáp ứng điều trị.
- Đánh giá tình trạng tủy xương ở người bệnh cấy ghép tủy.
- Tình trạng sinh máu của tủy trong các bệnh lý khác: nhiễm trùng, bệnh hệ thống, ung thư di căn, sau điều trị tia xạ hoặc lao.
III. CHỐNG CHỈ ĐỊNH
Tương đối khi làm thủ thuật:
- Người bệnh hemophillia.
- Không làm thủ thuật tại vị trí đang có nhiễm trùng.
IV. CHUẨN BỊ
1. Người thực hiện
- 01 bác sĩ chuyên khoa huyết học đọc kết quả.
- 02 kỹ thuật viên chuyên khoa phụ làm tiêu bản, chạy máy, vào sổ kết quả.
2. Phương tiện - hóa chất
- Máy đếm tế bào tự động hoặc bán tự động kèm máy in.
- Máy lắc ống máu.
- Bàn sấy (hoặc đèn hoặc máy sấy tiêu bản).
- Tủ ấm 370C
- Cóng (bể) nhuộm tiêu bản.
- Giá cắm tiêu bản.
- Kính hiển vi quang học.
- Máy lập công thức bạch cầu.
- Giá cắm ống xét nghiệm.
- Lam kính, lam kéo.
- Bút chì đánh dấu tiêu bản, bút dạ ghi số ống, bút bi vào sổ.
- Dầu soi kính, gạc lau kính.
- Giấy xét nghiệm.
- Găng tay.
- Mũ, khẩu trang, quần áo bảo hộ lao động.
- Máy vi tính, máy in.
- Giấy và mực in.
- Máu chuẩn máy.
- Dung dịch chạy máy, rửa máy.
- Hóa chất làm hồng cầu lưới (dung dịch xanh cresyl pha trong cồn). Nếu dùng máy laser có sẵn hồng cầu lưới thì không cần pha dung dịch xanh cresyl trong cồn.
- Cồn tuyệt đối cố định tiêu bản.
- Dung dịch Giemsa mẹ.
- Nước trung tính.
3. Bệnh phẩm
- Ống đựng máu và tủy của người bệnh.
- Tiêu bản đã kéo.
4. Phiếu xét nghiệm
Giấy xét nghiệm của người bệnh có chữ ký của bác sĩ ra y lệnh.
V. CÁC BƯỚC TIẾN HÀNH
- Kiểm tra giấy xét nghiệm đối chiếu với bệnh phẩm.
- Kiểm tra bệnh phẩm có đảm bảo yêu cầu về số lượng và chất lượng không.
- Kiểm tra tiêu bản có đúng, đủ và đã đánh dấu tiêu bản của từng người bệnh.
- Chạy máy đếm tế bào máu ngoại vi và dịch tủy.
- Làm tiêu bản hồng cầu lưới cả máu và tủy (tương tự trong xét nghiệm huyết đồ) và đọc kết quả hồng cầu lưới trong máu và tủy, ghi kết quả vào giấy xét nghiệm. (Lưu ý nếu sử dụng máy đếm tế bào có cả hồng cầu lưới thì không phải làm bước này).
- Nhuộm Giemsa 2 thì hai tiêu bản máu và hai tiêu bản tủy, còn lại để tiêu bản lưu.
- Đọc trên kính hiển vi quang học, đối chiếu với kết quả chạy máy, ghi đầy đủ các thông số cần thiết và ý kiến nhận xét về kết quả huyết đồ và tủy đồ. Có thể đưa ra kết luận nếu thấy chắc chắn hoặc yêu cầu làm thêm xét nghiệm, định hướng chẩn đoán. Bác sĩ ghi ngày tháng năm và ký tên.
VI. NHẬN ĐỊNH KẾT QUẢ
- So sánh kết quả do máy đưa ra với lam tủy và lam máu, lưu ý số lượng hồng cầu lưới.
- Đặc điểm về mật độ và sự phân bố tế bào tủy xương.
- Tỉ lệ các dòng hồng cầu, bạch cầu, mẫu tiểu cầu.
- Đặc điểm hình thái các dòng tế bào máu.
- Có hay không có: ALIP (Abnomal Localization Immatune Precursors), tế bào ung thư di căn, sợi xơ.
- Vào sổ lưu kết quả hoặc máy vi tính.
- Trả kết quả: xét nghiệm trả trong vòng 48 giờ, trừ trường hợp đặc biệt (khó chẩn đoán, cần hội chẩn, làm thêm một số xét nghiệm khác).
VII. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Nhầm ống bệnh phẩm.
- Nhầm tiêu bản
- Thiếu hoặc thừa tiêu bản.
- Không đủ số lượng, chất lượng bệnh phẩm.
- Máy chạy kết quả không đúng hoặc nhầm kết quả.
- Kính hiển vi chất lượng kém.
- Trình độ của bác sĩ, tay nghề của kỹ thuật viên còn yếu kém.
- Chọc không đúng ổ tủy nên tủy nghèo hoặc kết quả giống máu ngoại vi.
Tất cả khắc phục bằng đào tạo nâng cao trình độ tay nghề thực hành kỹ thuật, cũng như trình độ đọc chẩn đoán cho bác sĩ và kỹ thuật viên. Sử dụng trang thiết bị, máy móc đảm bảo chất lượng tốt.
MÁU LẮNG (PHƯƠNG PHÁP THỦ CÔNG)
I. NGUYÊN LÝ
Máu toàn phần sau khi lấy ra khỏi cơ thể, được chống đông và pha loãng theo một tỷ lệ nhất định, cho vào ống thủy tinh có chia vạch, để đứng thẳng, sau một thời gian máu sẽ lắng và phân lớp, các thành phần hữu hình lắng xuống dưới, lớp trên là huyết tương. Chiều cao của cột huyết tương thể hiện tốc độ lắng máu. Kết quả đánh giá sau 1 giờ và 2 giờ. Tốc độ máu lắng có giá trị trong theo dõi diễn biến và tiên lượng bệnh. Tốc độ lắng máu liên quan chặt chẽ với các yếu tố huyết tương và hồng cầu như sự chênh lệch giữa tỷ trọng của hồng cầu và huyết tương, kích thước hồng cầu, độ nhớt của huyết tương, trạng thái ngưng tập của hồng cầu.
Tốc độ máu lắng tăng ở phụ nữ có thai hay trong thời kỳ kinh nguyệt, người thiếu máu, thay đổi fibrinogen và gammaglobulin, nhiễm trùng, lao, thấp khớp cấp, các bệnh thận, gan, u lympho, u tủy.
Tốc độ lắng máu giảm trong bệnh đa hồng cầu, rối loạn protein, viêm gan virut, dị ứng.
II. CHUẨN BỊ
1. Người thực hiện
- 01 điều dưỡng lấy máu.
- 01 kỹ thuật viên làm kỹ thuật.
2. Phương tiện - hóa chất
- Dụng cụ lấy máu tĩnh mạch (bông cồn sát trùng, ga-rô, bơm kim tiêm, băng urgo).
- Ống xét nghiệm có sẵn chất chống đông.
- Giá cắm ống xét nghiệm.
- Nút cao su, bông gạc.
- Que (ống) máu lắng (Pachenkob hoặc Westergreen).
- Giá lên máu lắng (Pachenkob hoặc Westergreen).
- Ống nghiệm nhỏ.
- Đồng hồ hẹn giờ.
- Dung dịch natri citrat 3,8%.
- Sổ ghi kết quả, bút dạ đánh số, bút bi ghi kết quả.
3. Người bệnh
Nên làm vào buổi sáng, người bệnh chưa ăn gì.
4. Phiếu xét nghiệm
Giấy chỉ định xét nghiệm (biểu mẫu số 30/ BV-01), có ghi đầy đủ thông tin về người bệnh: họ tên, năm sinh, địa chỉ, khoa phòng, số giường, chẩn đoán, có đánh dấu ô chỉ định xét nghiệm, ghi rõ ngày tháng năm và chữ ký bác sĩ ra y lệnh.
III. CÁC BƯỚC TIẾN HÀNH
1. Lấy bệnh phẩm
- Người cần xét nghiệm hoặc điều dưỡng viên đưa giấy chỉ định xét nghiệm.
- Lấy 2ml máu tĩnh mạch trực tiếp từ người bệnh cho vào ống chống đông, lắc đều hoặc nhận ống máu người bệnh do điều dưỡng viên lấy sẵn (máu phải đảm bảo số lượng cũng như chất lượng, điều dưỡng viên phải ghi vào sổ nhận bệnh phẩm ngày giờ đưa xét nghiệm và ký tên), trên ống có ghi đầy đủ thông tin phù hợp với giấy xét nghiệm.
2. Tiến hành kỹ thuật
- Đánh số thứ tự lên giấy xét nghiệm và ống máu người bệnh (cùng một số)
- Vào sổ theo thứ tự ghi trên giấy xét nghiệm.
- Lắc đều ống máu (bằng máy lắc nếu có).
- Tráng que máu lắng bằng dung dịch natri citrat. Lấy 0,4ml (pp Westergreen) hoặc đến vạch P (pp Pachenkob) dung dịch natri citrat 3,8% cho vào ống nghiệm nhỏ khô sạch. Hút tiếp 1,6ml (pp Westergreen) hoặc 2 lần đến vạch K (pp Pachenkob) máu người bệnh, rồi cho vào ống đã có dung dịch natri citrat. Lắc đều nhẹ nhàng. Mao dẫn máu đã được pha loãng (tỷ lệ 1/5) vào que Westergreen đến vạch 0 hoặc que Pachenkob đến vạch K, lau sạch máu bám quanh que máu lắng. Cắm que đứng thẳng lên giá.
- Vào sổ thứ tự ống máu người bệnh và thứ tự que máu lắng trên giá sao cho tương ứng.
- Đặt chuông đồng hồ hẹn sau 1 giờ và 2 giờ.
IV. NHẬN ĐỊNH KẾT QUẢ
- Đọc kết quả sau 1 giờ và 2 giờ ghi vào sổ kết quả.
- Vào giấy xét nghiệm kết quả máu lắng.
- Ghi ngày tháng năm và ký tên.
- Trả kết quả trong vòng 24 giờ.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Bệnh phẩm lấy không đủ số lượng hoặc đông dây hoặc vỡ hồng cầu.
- Lấy máu để quá lâu mới làm xét nghiệm
- Ống máu lắng bẩn, ướt hoặc sứt mẻ
- Tỷ lệ pha loãng không chính xác
- Lắc trộn máu không đều
- Có bọt khí trong ống máu lắng
- Ống máu lắng không thẳng đứng
- Đọc kết quả không đúng thời gian hoặc không đúng cách thức quy định
I. ĐẠI CƯƠNG
Trong các trường hợp có ít tế bào bất thường ở máu ngoại vi, đặc biệt ở người bệnh có số lượng bạch cầu thấp, không thể phát hiện bằng tiêu bản máu đàn. Tập trung bạch cầu là một kỹ thuật làm tăng số lượng và mật độ tế bào có nhân trên tiêu bản, giúp khắc phục khó khăn trên.
II. CHỈ ĐỊNH
Các trường hợp số lượng tế bào bất thường ở máu ngoại vi ít, đặc biệt ở người bệnh có số lượng bạch cầu máu ngoại vi thấp.
III. CHUẨN BỊ
1. Người thực hiện
- 01 kỹ thuật viên làm kỹ thuật
- 01 bác sĩ đọc kết quả
2. Phương tiện - hóa chất
- Dụng cụ lấy máu tĩnh mạch (bông cồn sát trùng, ga-rô, bơm kim tiêm, băng urgo).
- Ống có chống đông EDTA, natri citrat hoặc heparin
- Máy ly tâm
- Máy lập công thức bạch cầu
- Kính hiển vi quang học
- Pipet paster
- Lam kính, lam kéo
- Dung dịch Giemsa mẹ
- Cồn tuyệt đối
- Nước trung tính
3. Người bệnh
Không có yêu cầu đặc biệt
4. Phiếu xét nghiệm
Giấy chỉ định xét nghiệm có ghi đầy đủ thông tin về người bệnh: họ tên, năm sinh, địa chỉ, khoa phòng, số giường, chẩn đoán, có chỉ định xét nghiệm, ghi rõ ngày tháng năm và chữ ký bác sĩ ra y lệnh.
IV. CÁC BƯỚC TIẾN HÀNH
1. Lấy bệnh phẩm
- Người cần xét nghiệm hoặc điều dưỡng viên đưa giấy chỉ định xét nghiệm.
- Lấy 3-5ml máu tĩnh mạch trực tiếp từ người bệnh cho vào ống chống đông, lắc đều hoặc nhận ống máu người bệnh do điều dưỡng viên lấy sẵn (máu phải đảm bảo số lượng cũng như chất lượng, điều dưỡng viên phải ghi vào sổ nhận bệnh phẩm ngày giờ đưa xét nghiệm và ký tên), trên ống có ghi đầy đủ thông tin phù hợp với giấy xét nghiệm.
2. Tiến hành kỹ thuật
- Cắm ống máu lên giá để ở nhiệt độ phòng 30 phút, hút bỏ phần huyết tương ở trên, phần huyết tương còn lại cách khối hồng cầu khoảng 5mm.
- Hút lớp huyết tương này (gồm bạch cầu, tiểu cầu và ít hồng cầu) cho vào ống nghiệm nhỏ.
- Ly tâm 1.000 vòng /phút trong 15 phút, hút bỏ phần huyết tương ở trên, chỉ để lại 0,5ml cặn.
Lắc đều phần cặn, kéo tiêu bản máu đàn, để khô, cố định và nhuộm Giemsa.
V. NHẬN ĐỊNH KẾT QUẢ
- Đọc tiêu bản trên kính hiển vi và trả lời kết quả vào giấy xét nghiệm.
- Ghi ngày tháng năm và ký tên.
- Trả kết quả trong vòng 24 giờ.
VI. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Nhầm mẫu bệnh phẩm.
- Bệnh phẩm lấy không đủ số lượng, bị đông hoặc bị vỡ hồng cầu.
I. ĐẠI CƯƠNG
Hạch đồ là một xét nghiệm tế bào học nhằm đánh giá thành phần tế bào trong hạch. Đây là một xét nghiệm thăm dò trực tiếp nên rất có giá trị trong chẩn đoán xác định các trường hợp hạch to.
II. CHỈ ĐỊNH
Có thể chỉ định trong tất cả các trường hợp hạch to, đặc biệt các trường hợp nghi ngờ ác tính hoặc viêm đặc hiệu như:
- U lympho.
- Ung thư di căn hạch.
- Hạch viêm lao.
- Hạch viêm phản ứng.
III. CHỐNG CHỈ ĐỊNH
Khi có biểu hiện nhiễm trùng tại hạch (viêm tấy, đỏ, chảy mủ...).
IV. CHUẨN BỊ
1. Người thực hiện
- 01 bác sĩ
- 01 kỹ thuật viên
2. Phương tiện - hóa chất
- Bộ dụng cụ sát khuẩn và cầm máu tại chỗ (Bông khô, bông cồn, băng).
- Bơm tiêm 5-10ml, kim tiêm loại 20Gx1½ hoặc lớn hơn.
- Phiến kính làm tiêu bản.
- Bộ dụng cụ nhuộm Giemsa.
- Kính hiển vi quang học.
3. Người bệnh
Có thể thực hiện lấy bệnh phẩm làm xét nghiệm ở mọi thời điểm trong ngày.
4. Phiếu xét nghiệm
- Ghi rõ tên, tuổi, địa chỉ người bệnh.
- Chẩn đoán sơ bộ.
- Tên người thực hiện thủ thuật.
- Thời gian thực hiện.
- Mô tả hạch về mặt đại thể.
V. CÁC BƯỚC TIẾN HÀNH
1. Kiểm tra hồ sơ
2. Kiểm tra người bệnh
- Người bệnh được giải thích lý do tiến hành thủ thuật, tư vấn tâm lý trước khi chọc hạch.
- Tư thế: ngồi thẳng, hoặc nằm nếu người bệnh không ngồi được.
- Kiểm tra vị trí hạch to, tính chất hạch.
3. Tiến hành kỹ thuật
- Lựa chọn hạch: ưu tiên chọc hạch thượng đòn, hạch mới to
- Sát khuẩn tại chỗ.
- Cố định hạch bằng ngón trỏ và ngón cái tay trái. Tay phải cầm bơm tiêm lắp sẵn kim, chọc nhẹ nhàng qua da, khi chọc qua vỏ hạch sẽ có cảm giác mật độ chắc hơn. Tùy theo kích thước hạch to hay nhỏ mà quyết định độ sâu của kim. Nói chung nên chọc vào hạch 0,5-1cm hoặc đến vùng trung tâm hạch. Hút mạnh 4-5 lần (áp lực -5ml đến -8ml) nếu hạch có mật độ chắc thì có thể giữ bơm tiêm ở áp lực âm quay bơm tiêm 2-3 vòng đồng tâm. Thả từ từ pít-tông của bơm tiêm đến khi hết áp lực âm. Rút bơm tiêm và kim tiêm.
- Bơm chất hạch lên phiến kính, đàn tiêu bản.
- Để khô tiêu bản tự nhiên, cố định, nhuộm Giemsa.
- Đọc tiêu bản trên kính hiển vi, trả lời kết quả.
VI. THEO DÕI
Theo dõi trong vòng 15 phút không thấy máu thấm ra băng thì cho người bệnh về.
VII. XỬ TRÍ TAI BIẾN
1. Tai biến sớm
- Chảy máu: do chọc vào mạch máu, cần băng cầm máu ngay cho người bệnh.
- Choáng, ngất: do tâm lý người bệnh không ổn định, do chảy máu, hoặc do đau. Cần cho người bệnh nằm nghỉ nơi yên tĩnh, kín gió, theo dõi sát.
2. Tai biến muộn
Nhiễm trùng tại vùng chọc hạch: sử dụng kháng sinh nếu có biểu hiện nhiễm trùng.
I. ĐẠI CƯƠNG
Lách đồ là một xét nghiệm tế bào học nhằm đánh giá thành phần tế bào trong lách. Đây là một xét nghiệm thăm dò trực tiếp nên rất có giá trị trong chẩn đoán xác định bệnh tại lách hoặc bệnh hệ tạo máu.
II. CHỈ ĐỊNH
Trong trường hợp:
- Cường lách
- U lách
- Nghi ngờ sinh máu tại lách
- Nghi ngờ thực bào tại lách
Chỉ tiến hành chọc lách khi người bệnh không có rối loạn đông máu và số lượng TC > 100 G/L.
III. CHỐNG CHỈ ĐỊNH
- Khi có rối loạn đông máu
- Số lượng tiểu cầu < 100 G/L
IV. CHUẨN BỊ
1. Người thực hiện
- 01 bác sĩ.
- 01 kỹ thuật viên.
2. Phương tiện - hóa chất
- Bộ dụng cụ sát khuẩn và cầm máu tại chỗ (Bông khô, bông cồn, băng).
- Bơm tiêm 510ml, kim tiêm loại 20Gx1½ hoặc lớn hơn.
- Phiến kính làm tiêu bản.
- Bộ dụng cụ nhuộm Giemsa.
- Kính hiển vi quang học.
3. Người bệnh
Có thể thực hiện lấy bệnh phẩm làm xét nghiệm ở mọi thời điểm trong ngày.
4. Phiếu xét nghiệm
- Ghi rõ tên, tuổi, địa chỉ người bệnh.
- Chẩn đoán sơ bộ.
- Tên người thực hiện thủ thuật.
- Thời gian thực hiện.
- Mô tả lách về mặt đại thể.
V. CÁC BƯỚC TIẾN HÀNH
1. Kiểm tra hồ sơ
2. Kiểm tra người bệnh
- Người bệnh được giải thích lý do tiến hành thủ thuật, tư vấn tâm lý trước khi chọc hạch.
- Tư thế: người bệnh nằm ngửa, thoải mái.
3. Tiến hành kỹ thuật
- Chọn vị trí chọc: thường chọc vào mỏm lách trên đường nách trước.
- Sát khuẩn tại chỗ.
- Chọc nhẹ nhàng kim đã lắp sẵn bơm tiêm đến hết chiều dày thành bụng. Cho người bệnh hít sâu và nín thở, chọc thật nhanh vào lách, hút 1- 3 lần với áp lực từ -5ml đến -8ml. Thả từ từ pít-tông của bơm tiêm đến khi hết áp lực âm. Rút bơm tiêm cùng kim tiêm. Cho người bệnh thở bình thường.
- Bơm chất hút được lên phiến kính, đàn tiêu bản.
- Để khô tiêu bản tự nhiên, cố định, nhuộm Giemsa.
- Đọc tiêu bản trên kính hiển vi, trả lời kết quả.
VI. THEO DÕI
Người bệnh nằm bất động tại giường và theo dõi trong vòng 2 giờ.
VII. XỬ TRÍ TAI BIẾN
1. Tai biến sớm
- Chảy máu tại vị trí chọc: do chọc vào mạch máu, cần băng cầm máu ngay cho người bệnh.
- Chảy máu trong ổ bụng: cần theo dõi sát tình trạng đau, biểu hiện mất máu (lâm sàng, xét nghiệm tổng phân tích tế bào máu, siêu âm ổ bụng), cần xử trí cấp cứu, nếu cần có thể phải can thiệp ngoại khoa.
- Choáng, ngất: do tâm lý người bệnh không ổn định, do chảy máu, hoặc do đau. Cần cho người bệnh nằm nghỉ nơi yên tĩnh, kín gió, truyền dịch, theo dõi sát toàn trạng, tìm nguyên nhân.
2. Tai biến muộn
Nhiễm trùng tại vùng chọc lách: sử dụng kháng sinh nếu có biểu hiện nhiễm trùng.
I. ĐẠI CƯƠNG
Là xét nghiệm mô bệnh học. Sinh thiết hạch cho phép quan sát cấu trúc hạch, hình thái và phân bố tế bào trong hạch.
II. CHỈ ĐỊNH
Tất cả các trường hợp hạch to chưa rõ nguyên nhân.
III. CHỐNG CHỈ ĐỊNH
- Có rối loạn đông máu.
- Đang sử dụng thuốc làm tăng nguy cơ chảy máu như: aspirin, heparin.
IV. CHUẨN BỊ
1. Người thực hiện
- 01 bác sĩ và 01 điều dưỡng (Hoặc kỹ thuật viên) trong quá trình lấy hạch.
- Kỹ thuật viên xử lý, cắt, nhuộm mảnh sinh thiết.
2. Phương tiện - hóa chất
- Phòng vô khuẩn (Tốt nhất là phòng mổ) khi lấy hạch.
- Bộ dụng cụ tiểu phẫu: dao mổ, kẹp, kim và chỉ khâu.
- Bông, băng, gạc, cồn 700, cồn iốt
- Thuốc gây tê tại chỗ (lindocain 1%)
- Hóa chất giúp cố định, xử lý mảnh sinh thiết và nhuộm Giemsa tiêu bản mảnh sinh thiết.
- Dụng cụ chuyển đúc, cắt và nhuộm tiêu bản mảnh sinh thiết.
- Kính hiển vi quang học.
3. Người bệnh
- Nên làm xét nghiệm vào buổi sáng.
- Được bác sĩ tư vấn, giải thích trước khi làm thủ thuật.
- Thử test thuốc tê có kết quả âm tính
4. Phiếu xét nghiệm
Có giấy chỉ định xét nghiệm ghi đầy đủ thông tin người bệnh.
V. CÁC BƯỚC TIẾN HÀNH
1. Kiểm tra hồ sơ
2. Kiểm tra người bệnh
- Kiểm tra lại tên, tuổi, số giường, khoa.
- Khám kỹ hạch, đặc biệt chú ý vùng cổ.
3. Lấy bệnh phẩm
- Lựa chọn hạch
+ Chọn hạch ở ngoại biên nông, kích thước vừa (đường kính < 2cm).
+ Tốt nhất hạch ở vùng cổ hoặc phía trên cơ hoành.
- Gây tê tại chỗ bằng lindocain.
- Rạch da và lớp cơ, cân.
- Lấy hạch bằng kẹp. Thường lấy cả hạch, cắt một phần khi hạch quá to.
- Chuyển mảnh sinh thiết vào dung dịch cố định, sát khuẩn và khâu vết rạch.
4. Tiến hành kỹ thuật
4.1. Xử lý mảnh sinh thiết
- Cố định mảnh sinh thiết trong dung dịch formol 10% trong 24 giờ.
- Chuyển trong hóa chất.
+ Rửa mẫu trong nước chảy nhẹ trong 1 giờ.
+ Đẩy nước bằng ngâm trong cồn.
Ngâm trong cồn 900: 30 phút. Ngâm trong cồn tuyệt đối I: 1 giờ.
Ngâm trong cồn tuyệt đối II: 1 giờ.
Ngâm trong cồn tuyệt đối II: 3 giờ.
- Đẩy cồn bằng xylen lấy mảnh sinh thiết thấm khô bằng giấy thấm.
Ngâm trong xylen I: 30 phút.
Ngâm trong xylen III: 1 giờ.
- Vùi mẫu trong paraphin và đúc khuôn.
Lấy mẫu từ xylen III và thấm khô bằng giấy thấm.
Ngâm trong paraphin nóng chảy trong 12 giờ.
Đúc mảnh sinh thiết trong khuôn paraphin nóng chảy.
Bảo quản khuôn mảnh sinh thiết trong ngăn tủ mát (20C - 80C).
4.2. Nhuộm Giemsa mảnh sinh thiết
- Cắt dán tiêu bản và để khô trong tủ 370C trong 2 giờ
- Tẩy paraphin bằng cách chuyển mẫu qua Toluen I,II,III ® cồn tuyệt đối I,II và cồn 800C. Mỗi loại 5 phút.
- Rửa dưới vòi nước chảy nhẹ: 5 phút.
- Tráng qua cồn tuyệt đối.
- Nhuộm Giemsa 1/10: 15 phút.
- Rửa dưới nước chảy nhẹ.
- Đẩy nước bằng cồn tuyệt đối ngâm trong Toluen.
- Gắn lamen và để khô
VI. NHẬN ĐỊNH KẾT QUẢ
- Quan sát tiêu bản ở vật kính nhỏ (x 4 hoặc x 10) để có nhận xét tổng thể về cấu trúc hạch và đặc điểm phân bố tế bào.
- Quan sát ở vật kính x 40 để xem xét thành phần và hình thái tế bào.
VII. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Biến chứng chảy máu vùng sinh thiết (đặc biệt vị trí mũi, tai và họng).
- Biến chứng nhiễm trùng (đặc biệt vị trí mũi, họng).
- Đảm bào thời gian ở mỗi khâu trong quá trình xử trí, nhuộm Giemsa.
- Chảy máu
+ Giảm nguy cơ chảy máu: xem xét kỹ xét nghiệm đông máu trước khi làm xét nghiệm. Dừng thuốc có khả năng làm tăng nguy cơ chảy máu trước 1 tuần.
+ Băng ép cầm máu tại chỗ.
+ Có thể cân nhắc dùng thuốc cầm máu.
- Nhiễm trùng: dùng kháng sinh dự phòng trong 5 ngày.
I. NGUYÊN LÝ
Sinh thiết tủy xương là kỹ thuật khảo sát cấu trúc mô bệnh học của tủy tạo máu. Bằng kỹ thuật cố định, cắt lát và nhuộm tổ chức học, xét nghiệm sinh thiết tủy xương cho phép khảo sát:
- Cấu trúc mô bệnh học của tủy sinh máu.
- Số lượng, hình thái, cấu trúc, thành phần và vị trí nguyên ủy của tế bào máu và các bất thường của hệ thống liên võng (xơ, sợi).
II. CHỈ ĐỊNH
Xét nghiệm sinh thiết tủy xương được chỉ định khi cần:
- Chọc hút tủy thất bại.
- Chẩn đoán xác định, chẩn đoán giai đoạn, theo dõi điều trị các bệnh thuộc hội chứng tăng sinh tủy mạn tính, hội chứng tăng sinh lympho...
- Chẩn đoán xác định bệnh suy tủy xương.
- Hỗ trợ chẩn đoán (lơ xê mi cấp, rối loạn sinh tủy, xuất huyết giảm tiểu cầu...) trong các trường hợp tủy đồ nghèo tế bào.
- Chẩn đoán các trường hợp ung thư di căn tủy xương, u lympho xâm lấn tủy xương.
III. CHỐNG CHỈ ĐỊNH
- Có rối loạn đông máu.
- Đang sử dụng thuốc làm tăng nguy cơ chảy máu như: aspirin, heparin
- Người bệnh có các bệnh lý nội khoa nặng khác kèm theo như: suy tim, suy hô hấp, hôn mê.
IV. CHUẨN BỊ
1. Người thực hiện
- 01 bác sĩ và 01 kỹ thuật viên thực hiện thủ thuật.
- 01 bác sĩ và 01 kỹ thuật viên xử lý, cắt nhuộm và đọc kết quả mảnh sinh thiết.
2. Phương tiện - hóa chất
- Phòng thủ thuật vô khuẩn và dụng cụ đó tiệt trùng (khay quả đậu, xe tiêm, hộp dụng cụ).
- Vật liệu sát trùng: bông, cồn iốt 5%, cồn 700.
- Vật liệu cầm máu.
- Thuốc gây tê tại chỗ (lylocain 2%).
- Bơm tiêm 5ml.
- Kim sinh thiết tủy xương (kim Jamshidi).
- Lọ thủy tinh 60ml (lọ cổ to).
- Dung dịch cố định Helly
3. Người bệnh
- Người bệnh được giải thích về sự cần thiết, các tai biến có thể gặp của thủ thuật.
- Thử test thuốc tê.
4. Phiếu xét nghiệm
Có phiếu chỉ định xét nghiệm ghi đầy đủ thông tin của người bệnh.
V. CÁC BƯỚC TIẾN HÀNH
1. Kiểm tra hồ sơ
2. Kiểm tra người bệnh
Kiểm tra đối chiếu các thông tin giữa người bệnh và chỉ định xét nghiệm:
- Tên tuổi, số giường, khoa/ phòng.
- Không có các chống chỉ định xét nghiệm
- Người bệnh đã có kết quả xét nghiệm HIV âm tính.
- Người bệnh đã được thử test thuốc tê âm tính.
3. Tiến hành kỹ thuật
- Xác định vị trí chọc sinh thiết.
- Sát trùng.
- Gây tê từng lớp.
- Đưa kim qua da.
- Dựng kim thẳng đứng khoan nhẹ nhàng qua lớp cơ.
- Xác định lại điểm mốc.
- Khoan nhẹ kim trên màng xương, góc quay kim khoảng 10-1500.
- Khi có cảm giác đó khoan qua màng xương (vào phần tủy xương xốp), tay trái giữ cố định phần vỏ kim, tay phải rút nòng kim để vào hộp vô trùng.
- Đệm một miếng gạc vô trùng lên đốc kim, tiếp tục khoan nhẹ nhàng 1-1,5cm.
- Lắc nhẹ kim để cắt rời mảnh sinh thiết khỏi tổ chức xương xung quanh.
- Xoay kim tại chỗ theo một chiều 2-3 vòng.
- Từ từ rút kim, khi thân kim qua khỏi màng xương, nghiêng kim, nhẹ nhàng rút kim khỏi mặt da.
- Cầm máu, dán băng.
- Thả mảnh sinh thiết vào dung dịch cố định.
VI. THEO DÕI
Theo dõi trong vòng 15 phút không thấy máu thấm ra băng thì cho người bệnh về.
VII. XỬ TRÍ TAI BIẾN
- Biến chứng chảy máu vị trí sinh thiết.
- Biến chứng nhiễm trùng vị trí sinh thiết.
- Chảy máu.
+ Giảm nguy cơ chảy máu: hạn chế chỉ định sinh thiết tủy xương khi người bệnh có rối loạn đông cầm máu. Dừng thuốc có khả năng làm tăng nguy cơ chảy máu trước khi tiến hành thủ thuật 1 tuần.
+ Băng ép cầm máu tại chỗ.
+ Dùng thuốc cầm máu (nếu cần).
- Nhiễm trùng: dùng thuốc kháng sinh phổ rộng 5-7 ngày.
I. NGUYÊN LÝ
Nhuộm peroxydase là phương pháp hóa học tế bào giúp đánh giá mức độ biệt hóa của các tế bào trong phân loại bệnh lơ xê mi cấp, đồng thời giúp phân biệt một số bệnh lý huyết học khác lơ xê mi cấp. Dưới tác dụng của peroxydase, hydrogen peroxid (H2O2) sẽ giải phóng ra một oxy nguyên tử, oxy hóa cơ chất (benzidin) tạo chất tủa màu tương ứng trong bào tương bạch cầu.
|
| Peroxydase | Cơ chất | |
| H2O2 -----------® H2O + O ® ¯ Oxy hóa | |||
|
| Chất màu | ||
II. CHUẨN BỊ
1. Người thực hiện
01 kỹ thuật viên hoặc cử nhân kỹ thuật chuyên khoa Huyết học - Truyền máu.
2. Phương tiện - hóa chất
- Bàn sấy hoặc quạt sấy tiêu bản.
- Kính hiển vi quang học.
- Bể nhuộm tiêu bản dung tích 100ml: 01 chiếc
- Giá gỗ cài tiêu bản: 02 chiếc
- Pipet pasture: 02 chiếc
- Gạc thấm nước: 03 chiếc
- Bút chì hoặc bút viết kính: 01 chiếc
- Cồn tuyệt đối: 90ml
- Formandehyt 40%: 10ml
- Nước cất: 4ml
- Giemsa mẹ: 1ml
- Dầu soi kính hiển vi.
- Benzidin 0,1%: 1ml
* Cách pha benzidin 0,1%:
- Benzidin: 100mg
- Cồn tuyệt đối: 10ml
- Nước cất vừa đủ: 100ml
- Oxy già (30 thể tích): vài giọt
Sau đó lắc đều, bảo quản ở nhiệt độ phòng xét nghiệm. Lắc đều trước khi sử dụng.
3. Người bệnh
- Tiêu bản máu hoặc tủy xương theo chỉ định; đã ghi thông tin (tên, tuổi...), ký hiệu (Pe), đã khô.
- Số lượng: 01 lam/1người bệnh.
4. Phiếu xét nghiệm
Có phiếu chỉ định xét nghiệm ghi đầy đủ thông tin của người bệnh.
III. CÁC BƯỚC TIẾN HÀNH
- Pha dung dịch cồn formol 10%.
- Cố định tiêu bản bằng cách ngâm trong cồn formol 10%: 10 phút.
- Rửa dưới vòi nước chảy 30 giây ® để khô tự nhiên.
- Nhuộm benzidin 0,1% : 5-10 phút (tùy trường hợp).
- Rửa dưới vòi nước chảy mạnh: 1 phút ® để khô tự nhiên.
- Nhuộm Giemsa 1/5: 10 phút.
- Rửa dưới vòi nước chảy mạnh: 30 giây ® để khô tự nhiên.
IV. NHẬN ĐỊNH KẾT QUẢ
Phương pháp nhuộm này cho các hạt dương tính màu vàng xỉn (gỉ sắt) trong bào tương tế bào. Tính số lượng tế bào dương tính trong tổng số 100 tế bào cần xem xét. Đối với lơ xê mi cấp thì đó là 100 tế bào Blast. Người ta chỉ quan sát để có nhận xét chung về mức độ dương tính chứ không cần thiết tính score trong phương pháp nhuộm peroxydase.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Cố định tiêu bản chưa đạt hiệu quả.
- Tiêu bản chưa khô hẳn trước khi nhuộm các thì khác
- Nồng độ của benzidin không đạt.
- Thời gian để phản ứng chưa phù hợp.
- Dung dịch nhuộm nền (Giemsa) chưa đạt tiêu chuẩn.
I. NGUYÊN LÝ
Nhuộm soudan là phương pháp nhuộm hạt mỡ trong các tế bào dòng hạt, nhất là trong lúc thiếu oxy, phản ứng soudan black để phân biệt những bạch cầu chưa biệt hóa thuộc dòng hạt, từ đó giúp chẩn đoán các bệnh bạch cầu cấp dòng tủy và phân biệt các bệnh lý huyết học khác dòng.
Chất màu soudan black có thuộc tính hòa tan trong lipid, người ta lợi dụng đặc điểm này để phát hiện thành phần lipid có trong tế bào.
II. CHUẨN BỊ
1. Người thực hiện
01 kỹ thuật viên hoặc cử nhân kỹ thuật chuyên khoa Huyết học - Truyền máu.
2. Phương tiện - hóa chất
- Bàn sấy hoặc quạt sấy tiêu bản
- Kính hiển vi quang học
- Bể nhuộm tiêu bản dung tích 100ml: 02 chiếc
- Giá gỗ cài tiêu bản: 02 chiếc
- Pipet pasture: 02 chiếc
- Gạc thấm nước: 03 chiếc
- Bút chì hoặc bút viết kính: 01 chiếc
- Cồn 700: bình bóp >100ml
- Formandehyt 40%: 10ml
- Nước cất: 4ml
- Giemsa mẹ: 1ml
- Dầu soi kính hiển vi.
- Dung dịch soudan black: 100ml (để trong bể nhuộm - bịt kín)
Cách pha dung dịch Soudan black:
(A) Soudan black B: 0,1g
Cồn tuyệt đối: 30ml
(B) Dung dịch phenol:
Dung dịch phenol: 2,96ml
Na2HPO4 . 12 H2O: 0,06g
Cồn tuyệt đối: 6ml
Nước cất: 20ml
Þ Trộn (A) & (B) ta được dung dịch soudan black (chú ý rất sốc mùi).
3. Người bệnh
- Tiêu bản máu hoặc tủy xương theo chỉ định; đã ghi thông tin (tên, tuổi...), ký hiệu (Sou), đã khô.
- Số lượng: 01 lam/1người bệnh.
4. Phiếu xét nghiệm
Có phiếu chỉ định xét nghiệm ghi đầy đủ thông tin của người bệnh.
III. CÁC BƯỚC TIẾN HÀNH
- Nhỏ 01 giọt (»30ml) vào bể nhuộm 100ml khô sạch.
- Cố định tiêu bản bằng hơi focmol trong bể nhuộm: 10 phút.
- Rửa dưới vòi nước chảy nhẹ và nhanh (10 giây) ® để khô tự nhiên.
- Nhuộm soudan (ngâm trong bể soudan): 30 phút.
- Tráng cồn 700: 10 giây.
- Rửa dưới vòi nước chảy nhẹ: 30 giây ® để khô tự nhiên.
- Nhuộm Giemsa 1/5: 10 phút.
- Rửa dưới vòi nước chảy mạnh 1 phút ® để khô tự nhiên.
IV. NHẬN ĐỊNH KẾT QUẢ
Các tế bào dương tính chứa các hạt, cục màu đen trong bào tương và thường chờm lên nhân, có khi che kín cả tế bào. Tính số lượng tế bào dương tính trong tổng số 100 tế bào cần xem xét. Đối với lơ xê mi cấp thì đó là 100 tế bào Blast.
Cũng giống như phương pháp nhuộm peroxydase, người ta chỉ quan sát để có nhận xét chung về mức độ dương tính chứ không cần thiết tính score trong phương pháp nhuộm soudan black.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Cố định không tốt.
- Tiêu bản chưa khô hẳn trước khi nhuộm các thì khác.
- Thời gian ngâm tiêu bản trong dung dịch soudan quá dài hoặc quá ngắn.
- Dung dịch soudan black đã nhạt (do để lâu ngày).
I. NGUYÊN LÝ
Dưới tác động của periodic (HIO4. 2H2O), nhóm chức rượu của glycogen được chuyển thành aldehyt(R-CHO), sẽ tác dụng với thuốc thử schiff, cho hợp chất màu hồng tươi trong bào tương tế bào.
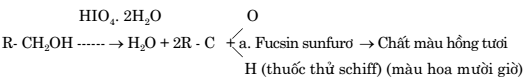
II. CHUẨN BỊ
1. Người thực hiện
01 kỹ thuật viên hoặc cử nhân kỹ thuật chuyên khoa Huyết học - Truyền máu.
2. Phương tiện - hóa chất
- Bàn sấy hoặc quạt sấy tiêu bản
- Kính hiển vi quang học
- Bể nhuộm tiêu bản dung tích 100ml: 01 chiếc
- Giá gỗ cài tiêu bản: 02 chiếc
- Pipet pasture: 02 chiếc
- Ống nghiệm tan huyết khô sạch
- Gạc thấm nước: 03 chiếc
- Bút chì hoặc bút viết kính: 01 chiếc
- Dầu soi kính hiển vi.
- Cồn tuyệt đối: 90ml
- Formandehyt 40%: 10ml
- Dung dịch periodic 1%:1ml
- Schiff (để trong tủ sinh phẩm 20-80C): 4ml (lấy ra trước khi làm).
- Dung dịch hematoxylin: 1ml
Ghi chú: Ngày nay có dung dịch thành phẩm schiff reagent và hematoxylin.
3. Người bệnh
- Tiêu bản tủy xương theo chỉ định; đã ghi thông tin (tên, tuổi...), ký hiệu (PAS), đã khô.
- Số lượng: 01 lam/1người bệnh.
4. Phiếu xét nghiệm
Có phiếu chỉ định xét nghiệm ghi đầy đủ thông tin của người bệnh.
III. CÁC BƯỚC TIẾN HÀNH
- Ngâm tiêu bản trong cồn formol 10%: 10 phút.
- Rửa dưới vòi nước chảy mạnh: 30 giây ® để khô tự nhiên.
- Nhuộm periodic 1%: 10-15 phút.
- Rửa dưới vòi nước chảy mạnh: 30 giây ® để khô tự nhiên.
- Nhuộm Schiff (phủ lên tiêu bản): 10-20 phút.
- Rửa dưới vòi nước chảy mạnh: 30 giây ® để khô tự nhiên.
- Nhuộm hematoxylin (phủ lên tiêu bản): 20 phút.
- Rửa dưới vòi nước chảy mạnh: 30 giây ® để khô tự nhiên.
IV. NHẬN ĐỊNH KẾT QUẢ
Các tế bào dương tính có các hạt, cục màu đỏ tươi (màu hoa mười giờ) trong bào tương. Các tế bào dương tính lan tỏa (bào tương có màu đỏ tươi mịn, không có hạt) không có giá trị.
Cũng giống như phương pháp nhuộm peroxydase và soudan black, người ta chỉ quan sát để có nhận xét chung về mức độ dương tính chứ không cần thiết tính score trong phương pháp nhuộm soudan black.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Cố định không tốt.
- Tiêu bản chưa khô hẳn trước khi nhuộm các thì khác
- Thời gian phản ứng với periodic quá dài hoặc quá ngắn.
- Thời gian phản ứng với schiff quá dài hoặc quá ngắn.
- Dung dịch schiff hoặc hematoxylin đã nhạt (do để lâu ngày).
I. NGUYÊN LÝ
Trong điều kiện pH và nhiệt độ thích hợp, naphtol tự do được giải phóng từ cơ chất (ví dụ à Naphtol ASD acetate) dưới tác dụng của men esterase của bạch cầu hạt và mono sẽ kết hợp với muối diazo (tan, không màu) để tạo thành một chất tủa và có màu (azo).
|
| Diazo |
| Cơ chất ® Naphtol tự do ® ¯ Oxy hóa (men esterase) | |
|
| Azo (màu, tủa) |
Tuy nhiên, có sự khác nhau giữa hoạt tính men esterase trong bạch cầu mono và bạch cầu hạt khi thêm NaF vào dung dịch nhuộm: men esterase trong bạch cầu mono bị mất hoạt tính (ức chế) gần như hoàn toàn, ngược lại, hoạt tính men esterase trong bạch cầu hạt hầu như không thay đổi. Chính vì đặc điểm này mà người ta sử dụng hai phương pháp nhuộm esterase không đặc hiệu là ức chế và không ức chế để phân định dòng hạt và mono.
Chú ý: Tiêu bản phải được cố định ngay, càng sớm càng tốt kể từ khi lấy bệnh phẩm ra khỏi cơ thể.
II. CHUẨN BỊ
1. Người thực hiện
01 kỹ thuật viên hoặc cử nhân kỹ thuật chuyên khoa Huyết học - Truyền máu.
2. Phương tiện - hóa chất
- Bàn sấy hoặc quạt sấy tiêu bản
- Kính hiển vi quang học
- Bể nhuộm tiêu bản dung tích 100ml: 01 chiếc
- Bainmarie hoặc bình nước cách thủy 370C
- Giá gỗ cài tiêu bản: 02 chiếc
- Pipet pasture: 05 chiếc
- Ống đong 5ml: 02 chiếc
- Gạc thấm nước: 03 chiếc
- Bút chì hoặc bút viết kính:
- Formandehyt 40%
- Đệm Tris pH=8
- Naphtol acetate 0,3%
- Dimethyl phomamid
- Muối Fast blue RR salr
- Dầu soi kính hiển vi.
Pha dung dịch Tris pH=8:
- Tris: 2,43g
- Nước cất: 25ml
- Acid HCl 1N:18,5ml
- Nước cất vừa đủ 100ml
Pha dung dịch µ Naphtol - AS acetate:
- µ Naphtol - AS acetate:10 mg
- Dimethyl formamide: 0,3ml
Cách pha dung dịch Nuclear fas red:
- Nuclear fas red (C14H8NNaO7S): 200mg
- Al2NH4(SO4)3: 5g
- Nước cất (H20): 100ml
Cho 100ml nước cất vào cốc ® cho Al2NH4(SO4)3 vào đun sôi cho tan hết, cho tiếp Nuclear fas red vào để sôi 1 phút bắc ra để nguội và cho thêm vài hạt thymol vào để bảo quản ở nhiệt độ phòng, khi dùng phải lọc để trong tủ ấm.
3. Người bệnh
- Tiêu bản máu hoặc tủy xương theo chỉ định; đã ghi thông tin (tên, tuổi...), ký hiệu, đã khô.
- Số lượng: 02 lam/1 người bệnh gồm: 01 lam ký hiệu (Es), 01 lam ký hiệu (Es-NaF).
4. Phiếu xét nghiệm
Có phiếu chỉ định xét nghiệm ghi đầy đủ thông tin của người bệnh.
III. CÁC BƯỚC TIẾN HÀNH
- Nhỏ 01 giọt (» 30ml) vào bể nhuộm 100ml khô sạch.
- Cố định tiêu bản bằng hơi formol trong bể nhuộm: 10 phút.
- Rửa dưới vòi nước chảy nhẹ và nhanh (10 giây) ® để khô tự nhiên.
- Pha dung dịch nhuộm.
+ Hút 4,95ml đệm Tris vào ống 1.
+ Hút 100ml => lắc cho tan thành dung dịch.
+ Cho một lượng rất ít muối Fast blue RR salr để cho dung dịch ủ có màu vàng chanh.
+ Chia 1/2 số dung dịch nhuộm vào ống 2 và cho thêm »30mg NaF ® lắc cho tan hết.
- Phủ dung dịch nhuộm:
+ Ống 1 vào lam ký hiệu Es.
+ Ống 2 (có NaF) vào làm ký hiệu Es - NaF.
- Ủ tiêu bản trong Bainmarie 370: 60 phút
- Rửa nước chảy mạnh 30 giây ® để khô tự nhiên.
- Nhuộm dung dịch nuclear fas red: 15 phút.
- Rửa nước chảy mạnh 30 giây ® để khô tự nhiên, đọc kết quả.
IV. NHẬN ĐỊNH KẾT QUẢ
Các tế bào dương tính có hạt màu xanh thẫm trong bào tương bắt màu hồng.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Cố định không tốt.
- Tiêu bản chưa khô hẳn trước khi nhuộm các thì khác
- Thời gian ngâm tiêu bản trong dung dịch nhuộm quá ngắn.
- Dung dịch nuclear fast red đã nhạt.
I. NGUYÊN LÝ
Trong môi trường acid, ion sắt của ferritin (Fe+++) sẽ tác dụng với ferrocyanid tạo ra ferric ferrocyanid có màu xanh phổ (xanh coban đậm).
II. CHUẨN BỊ
1. Người thực hiện
01 kỹ thuật viên hoặc cử nhân kỹ thuật chuyên khoa Huyết học - Truyền máu.
2. Phương tiện - hóa chất
- Bàn sấy hoặc quạt sấy tiêu bản.
- Kính hiển vi quang học
- Bể nhuộm tiêu bản dung tích 100ml: 01 chiếc
- Bainmarie hoặc bình cách thủy 370C.
- Giá gỗ cài tiêu bản: 02 chiếc
- Pipet pasture: 02 chiếc
- Gạc thấm nước: 03 chiếc
- Bút chì hoặc bút viết kính: 01 chiếc
- Cồn tuyệt đối etylic
- Dung dịch ferocyanua kali 2%: 4,95ml
Lưu ý: Dung dịch ferocyanua kali 2% trước khi làm phải được để trong bình cách thủy 370C.
- Acid HCl 1N: 0,5ml
- Nước cất 2 lần: 5ml
III. CÁC BƯỚC TIẾN HÀNH
- Tiêu bản máu, tủy cố định bằng cồn etylic: 10 phút
- Rửa tiêu bản ® để khô.
- Nhuộm dung dịch nhuộm ủ trong bình cách thủy 370C: 60 phút
- Rửa tiêu bản, nước chảy càng mạnh càng tốt đ tráng lại bằng nước cất ® để khô tự nhiên.
- Nhuộm nhân bằng dung dịch nuclear fast red: 15 phút.
- Rửa tiêu bản thật sạch, tráng lại nước cất, để khô và đọc kết quả.
IV. NHẬN ĐỊNH KẾT QUẢ
Tiêu bản đẹp khi xem trên kính thấy nhân có màu hồng đỏ, nguyên sinh chất màu hồng nhạt hơn. Các tế bào dương tính trên nguyên sinh chất có hạt hoặc cục màu xanh phổ Berlin.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Cố định không tốt.
- Tiêu bản chưa khô hẳn trước khi nhuộm các thì khác.
- Thời gian ngâm tiêu bản trong dung dịch nhuộm quá ngắn.
- Dung dịch nuclear fast red đã nhạt.
- Dung dịch ferocyanua kali không đúng nồng độ.
CHẨN ĐOÁN TẾ BÀO HỌC HẠCH, LÁCH
(Kỹ thuật làm và nhuộm tiêu bản Giemsa)
I. NGUYÊN LÝ
Là kỹ thuật làm tiêu bản và phương pháp nhuộm để phát hiện các bất thường của tổ chức hạch, lách giúp chẩn đoán các bệnh lý liên quan.
II. CHUẨN BỊ
1. Người thực hiện
01 kỹ thuật viên hoặc cử nhân kỹ thuật chuyên khoa Huyết học - Truyền máu.
2. Phương tiện - hóa chất
- Kính hiển vi quang học
- Bàn sấy hoặc quạt sấy tiêu bản
- Bơm tiêm 10 ml: 1 chiếc /1 trường hợp.
- Kim tiêm G20: 1 chiếc /1 trường hợp.
- Lam kính khô sạch: 05 cái / 1 chiếc /1 trường hợp.
- Bộ bể nhuộm 20ml: 02 bộ
- Gạc thấm nước.
- Cồn tuyệt đối: 100ml
- Nước cất 2 lần: 100ml
- Giemsa mẹ: 1ml/1 tiêu bản.
- Giemsa 1/5: 1ml/1 tiêu bản.
- Dầu soi
3. Người bệnh
Là các tiêu bản chọc hút tế bào hạch, lách của người bệnh đã làm và để khô.
4. Phiếu xét nghiệm
III. CÁC BƯỚC TIẾN HÀNH
- Nhận bơm tiêm có bệnh phẩm từ nhân viên làm thủ thuật ® bơm mỗi lam kính 01 giọt (» 10ml) ® làm thành tiêu bản giọt đặc hoặc tiêu bản giọt đàn.
- Làm khô tiêu bản ® ghi ký hiệu, tên tiêu bản ® Cố định bằng cồn tuyệt đối.
- Nhuộm thì 1 bằng Giemsa mẹ: 7-10 giây.
- Rửa nước (nhúng trong bể nước sạch hoặc nước cất 2 lần): 10 giây.
- Nhuộm thì 2 bằng Giemsa 1/5: 7-10 phút.
- Rửa nước (nhúng trong bể nước sạch hoặc nước cất 2 lần): 15 giây.
- Cài tiêu bản lên giá ® sấy khô ® đọc kết quả.
IV. NHẬN ĐỊNH KẾT QUẢ
- Trên tiêu bản đẹp thấy được hình ảnh đầy đủ nhân, nguyên sinh chất, tính chất, đặc điểm của tế bào và các dấu hiệu bất thường (nếu có).
- Nhân viên có kiến thức về tế bào - tổ chức học nhận định hình thái cũng như kết luận xét nghiệm này.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Cố định tiêu bản chưa tốt.
- Nồng độ Giemsa, thời gian nhuộm chưa phù hợp.
- Tiêu bản quá dày, không phù hợp với quy trình.
NHUỘM HE TIÊU BẢN SINH THIẾT MÔ MỀM
I. NGUYÊN LÝ
Nhuộm HE (Hematoxylin Erythrosin) là phương pháp nhuộm hóa học mô tế bào làm xuất hiện những đặc điểm trên tế bào của tổ chức; Từ đó đánh giá được đặc điểm hình thái tế bào, tính chất phát triển của tổ chức và phát hiện các dấu hiệu bất thường của tổ chức nhằm hỗ trợ chẩn đoán các bệnh lý liên quan đến mô và tổ chức.
II. CHUẨN BỊ
1. Người thực hiện
01 kỹ thuật viên hoặc cử nhân kỹ thuật chuyên khoa Huyết học - Truyền máu.
2. Phương tiện - hóa chất
- Máy cắt tiêu bản
- Bàn sấy 370C
- Kính hiển vi quang học
- Bể nhuộm tiêu bản dung tích 100ml: 06 chiếc
- Bể nhuộm tiêu bản dung tích 200ml: 06 chiếc
- Giá cài tiêu bản vừa bể nhuộm 200ml: 01 chiếc
- Giá gỗ cài tiêu bản: 02 chiếc
- Pipet pasture: 04 chiếc
- Gạc thấm nước: 03 chiếc
- Bút chì hoặc bút viết kính: 01 chiếc
- Lamen 22 x 24 hoặc 22 x 22
- Toluen 1,2,3: để sẵn trong 3 bể nhuộm 100ml
- Cồn tuyệt đối etylic 1,2,3: để sẵn trong bể nhuộm 100ml.
- Cồn 800: pha sẵn và để trong bể 100ml.
- Dung dịch hematoxylin (thành phẩm): để sẵn trong bể 200ml.
- Dung dịch erythrosin: để sẵn trong bể nhuộm 200ml.
- Acid HCl %: để trong bể nhuộm 200ml.
- Boom Canada: lấy ra cốc nhỏ, để trong tủ 600C.
* Pha hóa chất:
- Dung dịch erythrosin:
Erythrosin B (C20H6I4Na2O5): 0,1g
H2O cất: 100ml
Khuấy đều ta được dung dịch erythrosin B (C20H6I4Na2O5) nồng độ 1‰.
- Dung dịch hematoxylin: là hóa chất thành phẩm có trên thị trường.
3. Bệnh phẩm
Là các tiêu bản mảnh sinh thiết đã cắt sẵn, đảm bảo khô: sau khi mảnh sinh thiết được đúc thành khuôn, tiến hành cắt dán trên lam kính và để khô trong tủ ấm 370C trong 03 giờ.
4. Phiếu xét nghiệm
Có phiếu chỉ định xét nghiệm ghi đầy đủ thông tin của người bệnh.
III. CÁC BƯỚC TIẾN HÀNH
- Tẩy paraphin bằng cách chuyển mẫu qua Toluen I, II, III ® cồn 800, cồn tuyệt đối I, II: mỗi loại 5 phút.
- Rửa dưới nước chảy nhẹ: 5 phút
- Nhuộm trong hematoxylin: 2-5 phút
- Rửa dưới nước chảy nhẹ: 5 phút
- Tẩy qua acid HCl 1%: 4-8 giây (nếu cần)
- Rửa dưới nước chảy nhẹ: 5 phút
- Nhuộm trong erythrosin: 30-60 giây
- Rửa dưới nước chảy nhẹ: 5 phút
- Đẩy nước bằng cồn tuyệt đối ® ngâm tiêu bản trong Toluen
- Gắn lamen, để khô và nhận định kết quả.
IV. NHẬN ĐỊNH KẾT QUẢ
Trên tiêu bản đẹp: thấy rõ các tế bào có đủ nhân, nguyên sinh chất và các hạt của các dòng tế bào. Bên cạnh đó thấy được hình thái và tính chất của tổ chức như lớp vỏ, lớp tủy và các đặc điểm của mỗi phần.
Việc nhận xét hình thái tế bào và tổ chức học đòi hỏi nhân viên kỹ thuật phải có kiến thức về tế bào-tổ chức học và giải phẫu bệnh. Vì vậy nhân viên làm kỹ thuật quan tâm nhiều đến việc sau khi nhuộm thì các tế bào và cấu trúc tổ chức có bắt màu tốt hay không cũng như các đặc điểm.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Nhuộm các thì hóa chất không phù hợp.
- Hóa chất đã bị thay đổi nồng độ.
NHUỘM HE TIÊU BẢN SINH THIẾT TỦY XƯƠNG
I. NGUYÊN LÝ
Nhuộm HE (Hemalun dermaye Erythrosin) mảnh sinh thiết tủy xương là phương pháp nhuộm hóa học tế bào làm xuất hiện những đặc điểm trên tế bào trong cấu trúc trúc tủy xương; Từ đó đánh giá được đặc điểm hình thái tế bào, tính chất phát triển của tổ chức và phát hiện các dấu hiệu bất thường của tổ chức tủy xương, đánh giá tình trạng sinh máu và các bệnh lý nhằm hỗ trợ chẩn đoán các bệnh lý liên quan đến cơ quan tạo máu.
II. CHUẨN BỊ
1. Người thực hiện
01 kỹ thuật viên hoặc cử nhân kỹ thuật chuyên khoa Huyết học - Truyền máu.
2. Phương tiện - hóa chất
- Máy cắt tiêu bản.
- Bàn sấy 370C.
- Kính hiển vi quang học.
- Bể nhuộm tiêu bản dung tích 100ml: 06 chiếc
- Bể nhuộm tiêu bản dung tích 200ml: 06 chiếc
- Giá cài tiêu bản vừa bể nhuộm 200ml: 01 chiếc
- Giá gỗ cài tiêu bản: 02 chiếc
- Pipet pasture: 04 chiếc
- Gạc thấm nước: 03 chiếc
- Bút chì hoặc bút viết kính: 01 chiếc
- Lamen 22 x 24 hoặc 22 x 22
- Toluen 1,2,3: để sẵn trong 3 bể nhuộm 100ml.
- Cồn tuyệt đối etylic 1,2,3: để sẵn trong bể nhuộm 100ml.
- Cồn 800: pha sẵn và để trong bể 100ml.
- Dung dịch hemalun demayer: để sẵn trong bể 200ml.
- Dung dịch erythrosin: để sẵn trong bể nhuộm 200ml.
- Dung dịch lugol.
- Dung dịch Na2S2O3 5%.
- Dung dịch Na2CO3 1%.
- Acid HCl %: để trong bể nhuộm 200ml.
- Boom Canada: lấy ra cốc nhỏ, để trong tủ 600C.
* Pha hóa chất:
- Dung dịch erythrosin:
Erythrosin B (C20H6I4Na2O5): 0,1g
H2O cất: 100ml
Khuấy đều ta được dung dịch erythrosin B (C20H6I4Na2O5) nồng độ 1‰.
- Dung dịch hemalun demayer.
+ Công thức:
Alunde K (KAl(SO4)2.12H2O): 5g
Hematine (C6H12O6): 300mg
Axít acetic (CH3COOH): 5ml
H2O cất: 250ml
+ Cách pha:
Đun sôi nước cho Alunde K.(KAl(SO4)2.12H2O) vào đun tiếp khoảng 1® 2 phút cho tan hết, sau đó cho tiếp Hematine (C6H12O6), đun thêm 1 phút và tắt bếp bắc ra để nguội ® cho tiếp acid acetic (CH3COOH) vào ta được dung dịch hemalun demayer.
- Dung dịch Na2S2O3 5%:
Na2S2O3: 5g
H2O cất: 100ml
Lắc đều cho tan hết Na2S2O3 sẽ được dung dịch Na2S2O3 5%:
- Dung dịch Na2CO3 1%:
Na2CO3: 1g
H2O cất: 100ml
Trộn dung môi và chất tan lẫn nhau, sau đó lắc đều cho tan hết Na2CO3 ta được dung dịch cần pha.
- Dung dịch lugol:
+ Công thức:
KI: 2g
Iốt tinh thể: 1g
H2O cất: 100ml
+ Cách pha:
Cho KI hòa tan trong nước trước sau đó cho tiếp iốt tinh thể vào, khuấy đều cho đến khi tan hết ta được dung dịch lugol.
3. Bệnh phẩm
Là các tiêu bản mảnh sinh thiết đã cắt sẵn, đảm bảo khô: sau khi mảnh sinh thiết được đúc thành khuôn, tiến hành cắt dán trên lam kính và để khô trong tủ ấm 370C trong 03 giờ.
4. Phiếu xét nghiệm
Có phiếu chỉ định xét nghiệm ghi đầy đủ thông tin của người bệnh.
III. CÁC BƯỚC TIẾN HÀNH
- Chuyển xylen 1,2,3, cồn 1,2 và cồn 800 mỗi loại 5 phút.
- Rửa nước chảy 10 phút và rửa sạch paraphin.
- Nhuộm lugol: 10 phút
- Rửa nước chảy: 10 phút
- Nhuộm Na2S2O3: 5 phút
- Rửa nước chảy: 10 phút
- Nhúng vào hemlundemaye: 4 phút
- Rửa nước chảy: 10 phút
- Tẩy cồn HCl 1%: 8 giây
- Rửa nước chảy: 10 phút (nước có sẵn trong cóng).
- Làm xanh tiêu bản bằng Na2CO3: 1 phút
- Rửa nước chảy: 10 phút
- Nhúng nền bằng erythrosin: 2-4 giây
- Rửa nước chảy: 5 phút
- Gắn lamen: rửa sạch tiêu bản, tráng lại bằng nước cất, tẩy nước bằng cồn tuyệt đối, nhúng qua xylen 1,2,3 (đã để trong tủ ấm) và gắn lamen.
IV. NHẬN ĐỊNH KẾT QUẢ
Trên tiêu bản đẹp: thấy rõ các tế bào có đủ nhân, nguyên sinh chất và các hạt của các dòng tế bào. Bên cạnh đó thấy được hình thái và tính chất của tổ chức như các khoang sinh máu, các bè xương và các đặc điểm của mỗi phần.
Việc nhận xét hình thái tế bào và tổ chức học đòi hỏi nhân viên phải có kiến thức về tế bào - tổ chức học kiến thức chuyên ngành Huyết học và Giải phẫu bệnh. Vì vậy nhân viên làm kỹ thuật quan tâm nhiều đến việc sau khi nhuộm thì các tế bào và cấu trúc tổ chức có bắt màu tốt hay không cũng như các đặc điểm nếu có.
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Xử lý mảnh sinh thiết không tốt.
- Tiêu bản chưa khô hẳn trước khi nhuộm.
- Thời gian nhuộm các thì hóa chất không phù hợp.
- Hóa chất đã bị thay đổi nồng độ.
- Kỹ năng chuyên môn của người làm chưa ổn định.
I. NGUYÊN LÝ
Đo thời gian từ lúc tạo một vết thương chuẩn ở vùng giữa dái tai đến khi máu ngừng chảy. Đây là xét nghiệm đánh giá giai đoạn cầm máu ban đầu.
II. CHỈ ĐỊNH
Tất cả những trường hợp nghi ngờ có bất thường đông cầm máu, nhất là các bệnh lý về thành mạch (thiếu vitamin C...) bệnh lý về số lượng, chất lượng tiểu cầu (xuất huyết giảm tiểu cầu, Glanzmann...).
III. CHỐNG CHỈ ĐỊNH
Người bệnh đang có viêm nhiễm hoặc xuất huyết ở dái tai.
IV. CHUẨN BỊ
1. Người thực hiện
01 kỹ thuật viên.
2. Phương tiện - hóa chất
- Kim chích (Blood lancet).
- Đồng hồ bấm giây.
- Giấy thấm.
- Bông thấm, dung dịch sát trùng (ether, cồn).
3. Người bệnh
Không cần chuẩn bị gì đặc biệt.
4. Phiếu xét nghiệm
Chỉ định xét nghiệm được ghi rõ trong bệnh án; Giấy chỉ định xét nghiệm ghi đầy đủ thông tin về người bệnh: họ tên, tuổi, giường bệnh, khoa phòng, chẩn đoán.
V. CÁC BƯỚC TIẾN HÀNH
- Người bệnh ở tư thế nằm hoặc ngồi, thoải mái
- Sát trùng vùng dái tai bằng cồn hoặc ether.
- Dùng kim chích tạo một vết thương chuẩn theo quy định. Khởi động đồng hồ bấm giây.
- Cứ 30 giây 1 lần, dùng giấy thấm, thấm máu chảy ra từ vết chích cho đến khi máu ngừng chảy. Bấm đồng hồ dừng lại.
VI. NHẬN ĐỊNH KẾT QUẢ
- Ghi kết quả vào giấy xét nghiệm
- Điền đầy đủ ngày, tháng năm và kỹ thuật viên tiến hành xét nghiệm ký tên.
I. NGUYÊN LÝ
Nhằm mục đích khảo sát tình trạng số lượng, chất lượng tiểu cầu và sợi huyết, nhất là trong điều kiện không có khả năng triển khai những kỹ thuật cao cấp, phức tạp; Người ta tiến hành đánh giá khả năng co của cục máu sau khi đông.
II. CHỈ ĐỊNH
Tất cả những trường hợp nghi ngờ bất thường số lượng và / chất lượng tiểu cầu, sợi huyết.
III. CHỐNG CHỈ ĐỊNH
Không có chống chỉ định.
IV. CHUẨN BỊ
1. Người thực hiện
01 kỹ thuật viên xét nghiệm.
2. Phương tiện - hóa chất
- Bình cách thủy 370C.
- Ống nghiệm tan máu sạch, khô, kích thước 75x9,5mm.
- Bơm kim tiêm nhựa lấy máu.
- Bông, cồn sát trùng, dây ga-rô.
3. Người bệnh
Không cần chuẩn bị gì đặc biệt.
4. Phiếu xét nghiệm
Chỉ định xét nghiệm được ghi rõ trong bệnh án; Giấy chỉ định xét nghiệm ghi đầy đủ thông tin về người bệnh: họ tên, tuổi, giường bệnh, khoa phòng, chẩn đoán.
V. CÁC BƯỚC TIẾN HÀNH
- Chuẩn bị 2 ống nghiệm tan máu khô, sạch, điền đầy đủ thông tin người bệnh: tên, tuổi, khoa phòng.
- Ga-rô, sát trùng, lấy khoảng 2-3ml máu tĩnh mạch.
- Phân phối đều vào 2 ống nghiệm tan máu đã chuẩn bị sẵn, mỗi ống 1-1,5ml
- Đặt vào bình cách thủy 370C.
- Sau 2-4 giờ, đọc kết quả dựa vào mức độ co của cục đông: co hoàn toàn, co không hoàn toàn, không co, cục đông bị tan.
VI. NHẬN ĐỊNH KẾT QUẢ
- Cục máu co hoàn toàn: tạo cục máu bờ rõ ràng, phần huyết thanh còn lại chiếm khoảng 50-65% thể tích máu ban đầu, không có hồng cầu tự do.
- Cục máu co không hoàn toàn: tạo cục máu bờ không rõ ràng, phần huyết thanh còn lại < 40% thể tích máu ban đầu hoặc còn hồng cầu tự do.
- Cục máu không co: không tạo riêng phần huyết thanh.
- Cục máu bị nát: hầu hết hồng cầu tự do trong huyết thanh.
- Ghi kết quả vào giấy xét nghiệm.
- Điền đầy đủ ngày, tháng, năm và kỹ thuật viên tiến hành xét nghiệm ký tên.
(PT: Prothrombin Time. Tên khác: TQ - Thời gian Quick; Tỷ lệ prothrombin; Tỷ lệ phức hệ prothrombin)
I. NGUYÊN LÝ
Đây là một trong những xét nghiệm được sử dụng rộng rãi để đánh giá đường đông máu ngoại sinh sau khi bổ sung đầy đủ một lượng thromboplastin tổ chức và canxi.
II. CHỈ ĐỊNH
Tất cả những trường hợp nghi ngờ có bất thường đông máu: suy giảm chức năng gan, thiếu hụt vitamin K... Đây cũng là một trong những xét nghiệm tiền phẫu, xét nghiệm theo dõi hiệu quả điều trị kháng vitamin K.
III. CHỐNG CHỈ ĐỊNH
Không có chống chỉ định.
IV. CHUẨN BỊ
1. Người thực hiện
01 kỹ thuật viên xét nghiệm.
2. Phương tiện - hóa chất
- Tủ lạnh.
- Máy ly tâm.
- Bình cách thủy 370C / máy đông máu bán tự động /tự động.
- Pipet 100ml, 1.000ml.
- Đồng hồ bấm giây.
- Bơm tiêm nhựa lấy máu.
- Bông cồn sát trùng, dây ga-rô.
- Ống nghiệm tan máu sạch, khô, kích thước 75x9,5mm.
- Ống nghiệm plastic có chống đông natri citrat 3,2%.
- Thromboplastin canxi đông khô.
- Nước cất.
3. Người bệnh
Không cần chuẩn bị gì đặc biệt.
4. Phiếu xét nghiệm
Chỉ định xét nghiệm được ghi rõ trong bệnh án; Giấy chỉ định xét nghiệm ghi đầy đủ thông tin về người bệnh: họ tên, tuổi, giường bệnh, khoa phòng, chẩn đoán.
V. CÁC BƯỚC TIẾN HÀNH
- Ga-rô, sát trùng, lấy khoảng 2ml máu tĩnh mạch.
- Trộn máu và chất chống đông citrat natri 3,2% theo tỷ lệ 9 thể tích máu /1 thể tích chống đông.
- Ly tâm mạnh thu huyết tương nghèo tiểu cầu.
- Tách lấy huyết tương làm xét nghiệm.
- Mỗi người bệnh, chuẩn bị hai ống nghiệm tan máu, ghi tên, tuổi, khoa, phòng.
- Phân phối 100ml huyết tương của mẫu cần kiểm tra vào ống nghiệm tan máu đã chuẩn bị .
- Cho thêm vào 200ml thromboplastin canxi. Khởi động đồng hồ ngay; khi xuất hiện màng đông, bấm đồng hồ dừng lại.
VI. NHẬN ĐỊNH KẾT QUẢ
- Thời gian (giây), luôn đi kèm thời gian của chứng bình thường.
- %: dựa vào đường thẳng chuẩn.
- INR (International Normalized Ratio), được tính theo công thức: PT bệnh (giây) ISI
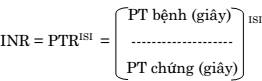
(ISI: International Sensitivity Index: chỉ số độ nhạy quốc tế).
- Ghi kết quả: thời gian, %, INR vào giấy xét nghiệm.
- Điền đầy đủ ngày, tháng năm và kỹ thuật viên tiến hành xét nghiệm ký tên.
THỜI GIAN THROMBOPLASTIN TỪNG PHẦN HOẠT HÓA
(APTT: Activated Partial Thromboplastin Time. Tên khác: TCK - Thời gian Cephalin Kaolin)
I. NGUYÊN LÝ
Đây là xét nghiệm được sử dụng để đánh giá đường đông máu nội sinh sau khi thay thế yếu tố 3 tiểu cầu bằng cephalin và hoạt hóa tối đa các yếu tố tiếp xúc bằng các chất hoạt hóa.
II. CHỈ ĐỊNH
Những trường hợp nghi ngờ bất thường đông cầm máu, nhất là bất thường đường đông máu nội sinh: nghi ngờ hemophilia, có biểu hiện xuất huyết, huyết khối trên lâm sàng, chảy máu khó cầm sau can thiệp,.. APTT cũng được chỉ định trước can thiệp, phẫu thuật trong bộ xét nghiệm tiền phẫu.
III. CHỐNG CHỈ ĐỊNH
Không có chống chỉ định.
IV. CHUẨN BỊ
1. Người thực hiện
01 kỹ thuật viên xét nghiệm.
2. Phương tiện - hóa chất
- Tủ lạnh.
- Máy ly tâm.
- Bình cách thủy 370C / máy đông máu bán tự động /tự động.
- Đồng hồ bấm giây.
- Bơm tiêm nhựa lấy máu.
- Bông cồn sát trùng, dây ga-rô.
- Ống nghiệm tan máu kích thước 75x9,5mm.
- Ống nghiệm plastic có chống đông natri citrat 3,2%.
- Pipet 100ml, 1.000ml.
- Đồng hồ bấm giây.
- Nước cất.
- CaCl2 M/40.
- Cephalin - kaolin
3. Người bệnh
Không cần chuẩn bị gì đặc biệt.
4. Phiếu xét nghiệm
Chỉ định xét nghiệm được ghi rõ trong bệnh án; Giấy chỉ định xét nghiệm ghi đầy đủ thông tin về người bệnh: họ tên, tuổi, giường bệnh, khoa phòng, chẩn đoán.
V. CÁC BƯỚC TIẾN HÀNH
- Ga-rô, sát trùng, lấy khoảng 2ml máu tĩnh mạch.
- Trộn đều máu với chất chống đông citrat natri 3,2% theo tỷ lệ: 1 thể tích chống đông trộn với 9 thể tích máu.
- Ly tâm mạnh để thu huyết tương nghèo tiểu cầu.
- Mỗi người bệnh, chuẩn bị hai ống nghiệm tan máu, ghi tên, tuổi, khoa, phòng.
- Phân phối 100ml huyết tương nghèo tiểu cầu cần kiểm tra vào ống nghiệm, để vào bình cách thủy 370C.
- Thêm vào 100ml hỗn dịch cephalin - kaolin; ủ ở bình cách thủy 370C trong 3-5 phút.
- Cho thêm vào 100ml CaCl2 M/40. Ghi thời gian đông.
VI. NHẬN ĐỊNH KẾT QUẢ
- Ghi kết quả: thời gian, chỉ số bệnh /chứng vào giấy xét nghiệm.
- Điền đầy đủ ngày, tháng năm và kỹ thuật viên tiến hành xét nghiệm ký tên.
I. NGUYÊN LÝ
Thrombin có tác dụng chuyển fibrinogen thành fibrin, tạo cục đông máu. Sử dụng thrombin nồng độ thích hợp để đo thời gian hình thành fibrin sẽ cho phép đánh giá con đường đông máu chung: khả năng và tốc độ chuyển fibrinogen thành fibrin.
II. CHỈ ĐỊNH
Tất cả những trường hợp bất thường đông máu nghi ngờ do giảm số lượng và chất lượng fibrinogen, do ức chế giai đoạn này của quá trình đông máu bởi ngăn cản quá trình trùng hợp tạo fibrin: tăng cao các sản phẩm thoái giáng fibrin...thường gặp trong đông máu rải rác trong lòng mạch, tiêu sợi huyết tiên phát...
III. CHỐNG CHỈ ĐỊNH
Không có chống chỉ định.
IV. CHUẨN BỊ
1. Người thực hiện
01 kỹ thuật viên xét nghiệm.
2. Phương tiện - hóa chất
- Tủ lạnh.
- Máy ly tâm.
- Bình cách thủy 370C / máy đông máu bán tự động /tự động.
- Đồng hồ bấm giây.
- Bơm tiêm nhựa lấy máu.
- Bông cồn sát trùng, dây ga-rô.
- Ống nghiệm tan máu kích thước 75x9,5mm.
- Ống nghiệm plastic có chống đông natri citrat 3,2%.
- Pipet 100ml, 1.000ml.
- Thrombin pha loãng nồng độ thích hợp theo hướng dẫn.
3. Người bệnh
Không cần chuẩn bị gì đặc biệt.
4. Phiếu xét nghiệm
Chỉ định xét nghiệm được ghi rõ trong bệnh án; Giấy chỉ định xét nghiệm ghi đầy đủ thông tin về người bệnh: họ tên, tuổi, giường bệnh, khoa phòng, chẩn đoán.
V. CÁC BƯỚC TIẾN HÀNH
- Ga-rô, sát trùng, lấy khoảng 2ml máu tĩnh mạch
- Trộn đều máu với chất chống đông citrat natri 3,2% theo tỷ lệ: 1 thể tích chống đông trộn với 9 thể tích máu.
- Ly tâm mạnh để thu huyết tương nghèo tiểu cầu.
- Phân phối 100ml huyết tương nghèo tiểu cầu cần kiểm tra vào ống nghiệm, để vào bình cách thủy 370C.
- Cho thêm 100ml thrombin ở nồng độ thích hợp đã xác định. Khởi động đồng hồ.
- Quan sát khi xuất hiện màng đông, bấm đồng hồ dừng lại.
VI. NHẬN ĐỊNH KẾT QUẢ
- Ghi kết quả: thời gian, chỉ số bệnh /chứng vào giấy xét nghiệm.
- Điền đầy đủ ngày, tháng năm và kỹ thuật viên tiến hành xét nghiệm ký tên.
I. NGUYÊN LÝ
Bộc lộ tình trạng tiêu sợi huyết bằng cách loại bỏ các chất ức chế, chỉ giữ lại chất hoạt hóa quá trình này, nghiệm pháp Von Kaulla cho phép đánh giá tình trạng hệ thống tiêu sợi huyết ở người bệnh, đặc biệt trong những trường hợp tiêu sợi huyết cấp tính và ở những cơ sở không thể tiến hành những kỹ thuật xét nghiệm chuyên sâu về đánh giá tình trạng bệnh lý này.
II. CHỈ ĐỊNH
Những trường hợp nghi ngờ đông máu rải rác trong lòng mạch (DIC), tiêu sợi huyết tiên phát, một số trường hợp điều trị thuốc tiêu sợi huyết.
III. CHỐNG CHỈ ĐỊNH
Không có chống chỉ định.
IV. CHUẨN BỊ
1. Người thực hiện
- 01 kỹ thuật viên xét nghiệm.
- 01 bác sĩ đọc kết quả.
2. Phương tiện - hóa chất
- Máy ly tâm.
- Bình cách thủy 370C.
- Đồng hồ bấm giây.
- Pipet 100ml, 3.000ml.
- Pipet pasteur.
- Bơm kim tiêm nhựa lấy máu.
- Bông, cồn sát trùng, dây ga-rô.
- Giấy thấm khô.
- Ống nghiệm tan máu kích thước 75x9,5mm.
- Ống nghiệm plastic có chống đông natri citrat 3,2%.
- Nước cất.
- Đệm michaelis pH 7,35.
- CaCl2 M/10.
- Acid acetic 2%.
3. Người bệnh
Không cần chuẩn bị gì đặc biệt.
4. Phiếu xét nghiệm
Chỉ định xét nghiệm được ghi rõ trong bệnh án; Giấy chỉ định xét nghiệm ghi đầy đủ thông tin về người bệnh: họ tên, tuổi, giường bệnh, khoa phòng, chẩn đoán.
V. CÁC BƯỚC TIẾN HÀNH
- Ga-rô, sát trùng, lấy khoảng 2ml máu tĩnh mạch
- Trộn đều máu với chất chống đông citrat natri 3,2% theo tỷ lệ: 1 thể tích chống đông trộn với 9 thể tích máu.
- Ly tâm mạnh để thu huyết tương nghèo tiểu cầu.
- Phân phối 300ml huyết tương nghèo tiểu cầu cần kiểm tra vào ống nghiệm tan máu.
- Cho thêm 3ml nước cất.
- Cho vào 1 đến 2 giọt acid acetic 2% sao cho pH đạt 5,2; Trộn đều.
- Ly tâm 3.000 vòng /phút x 15 phút.
- Gạn bỏ nước trong, giữ lại phần tủa.
- Cho vào 300l dung dịch đệm Michaelis pH 7,35 đã pha loãng 1/4 với dung dịch NaCl 0,9%.
- Cho thêm vào 1 giọt CaCl2 M/10, trộn đều và đặt ống nghiệm vào bình cách thủy 370C.
- Bấm đồng hồ theo dõi thời gian tan hoàn toàn kể từ khi đông.
VI. NHẬN ĐỊNH KẾT QUẢ
- Cục đông tan trước 15 phút: tiêu sợi huyết tối cấp.
+ 15-30 phút: tiêu sợi huyết cấp.
+ 30-45 phút: tiêu sợi huyết bán cấp.
+ 45-60 phút: tiêu sợi huyết tiềm tàng.
+ Trên 60 phút: bình thường.
- Ghi kết quả vào giấy xét nghiệm: dương tính hay âm tính, nếu dương tính: mức độ.
- Điền đầy đủ ngày, tháng năm và bác sĩ ký tên.
I. NGUYÊN LÝ
Phát hiện một tình trạng hoạt hóa quá mức hệ thống đông máu bằng cách đánh giá sự có mặt của phức hệ hòa tan monomer fibrin với fibrinogen và sản phẩm thoái giáng fibrin.
II. CHỈ ĐỊNH
Những tình trạng bệnh lý nghi ngờ hệ thống đông máu được hoạt hóa quá mức, nhất là đông máu rải rác trong lòng mạch (DIC).
III. CHỐNG CHỈ ĐỊNH
Không có chống chỉ định.
IV. CHUẨN BỊ
1. Người thực hiện
- 01 kỹ thuật viên tiến hành xét nghiệm.
- 01 bác sĩ đọc kết quả.
2. Phương tiện - hóa chất
- Tủ lạnh.
- Máy ly tâm.
- Đồng hồ bấm giây.
- Pipet 50ml, 1.000ml.
- Bơm kim tiêm nhựa lấy máu.
- Bông, cồn sát trùng, dây ga-rô.
- Ống nghiệm tan máu kích thước 75x9,5mm.
- Ống nghiệm plastic có chống đông natri citrat 3,2%.
- Nước cất.
- Cồn tuyệt đối 990.
3. Người bệnh
Không cần chuẩn bị gì đặc biệt.
4. Phiếu xét nghiệm
Chỉ định xét nghiệm được ghi rõ trong bệnh án; Giấy chỉ định xét nghiệm ghi đầy đủ thông tin về người bệnh: họ tên, tuổi, giường bệnh, khoa phòng, chẩn đoán.
V. CÁC BƯỚC TIẾN HÀNH
- Ga-rô, sát trùng, lấy khoảng 2ml máu tĩnh mạch.
- Trộn đều máu với chất chống đông citrat natri 3,2% theo tỷ lệ: 1 thể tích chống đông trộn với 9 thể tích máu.
- Ly tâm nhẹ hoặc để tự lắng để thu huyết tương giàu tiểu cầu.
- Phân phối 450ml huyết tương giàu tiểu cầu cần kiểm tra vào ống nghiệm tan máu.
- Cho thêm 150ml cồn tuyệt đối (cồn 990) đã pha loãng 1/2 với nước cất, trộn đều.
- Đặt vào tủ lạnh ở điều kiện 40C trong 10 phút.
VI. NHẬN ĐỊNH KẾT QUẢ
- Nhận định kết quả tùy thuộc vào tình trạng tạo gel, hình thành tủa hay không có thay đổi: dương tính, nghi ngờ, âm tính.
- Ghi kết quả nghiệm pháp rượu dương tính/âm tính/nghi ngờ vào giấy xét nghiệm.
- Điền đầy đủ ngày, tháng năm và bác sĩ ký tên.
I. NGUYÊN LÝ
D - Dimer là sản phẩm thoái giáng của fibrin dưới tác dụng của plasmin. Nồng độ D - Dimer tăng phản ánh một tình trạng tăng tiêu sợi huyết thường gặp trong hội chứng đông máu rải rác trong lòng mạch (DIC), tiêu sợi huyết tiên phát, huyết khối... Chính vì vậy, định lượng D - Dimer bằng phương pháp miễn dịch gắn latex là xét nghiệm thông dụng và rất hữu ích trong phát hiện tình trạng bệnh lý tăng tiêu sợi huyết.
II. CHỈ ĐỊNH
Đông máu rải rác trong lòng mạch (DIC), tiêu sợi huyết tiên phát, nghi ngờ huyết khối.
III. CHỐNG CHỈ ĐỊNH
Không có chống chỉ định.
IV. CHUẨN BỊ
1. Người thực hiện
01 kỹ thuật viên xét nghiệm.
2. Phương tiện - hóa chất
- Tủ lạnh.
- Máy ly tâm.
- Máy đông máu tự động có kênh miễn dịch.
- Đồng hồ bấm giây.
- Pipet 50ml, 1.000ml.
- Bơm kim tiêm nhựa lấy máu.
- Bông, cồn sát trùng, dây ga-rô.
- Ống nghiệm tan máu kích thước 75x9,5mm.
- Ống nghiệm plastic có chống đông natri citrat 3,2%.
Bộ kit làm xét nghiệm D- Dimer, bao gồm:
- Latex reagent: hỗn dịch latex gắn kháng thể kháng kháng nguyên D - Dimer.
- D - Dimer để hiệu chuẩn.
- Dung dịch đệm để pha loãng.
- Chứng âm.
- Chứng dương.
- Tấm card chuyên dụng để thực hiện phản ứng (trường hợp tiến hành bằng tay - bán định lượng).
- Hoặc máy đông máu tự động có chương trình làm xét nghiệm định lượng D - Dimer.
3. Người bệnh
4. Phiếu xét nghiệm
Chỉ định xét nghiệm được ghi rõ trong bệnh án; Giấy chỉ định xét nghiệm ghi đầy đủ thông tin về người bệnh: họ tên, tuổi, giường bệnh, khoa phòng, chẩn đoán...
V. CÁC BƯỚC TIẾN HÀNH
- Ga-rô, sát trùng, lấy khoảng 2ml máu tĩnh mạch.
- Trộn đều máu với chất chống đông citrat natri 3,2% theo tỷ lệ: 1 thể tích chống đông trộn với 9 thể tích máu.
- Ly tâm mạnh để thu huyết tương nghèo tiểu cầu.
Tiến hành thủ công:
- Trong một vòng tròn trên tấm card làm xét nghiệm, cho huyết tương cần kiểm tra theo các nồng độ đã pha loãng.
- Trong một vòng tròn tiếp theo, cho chứng dương.
- Trong một vòng tròn khác, cho chứng âm.
- Cho thêm vào mỗi vòng tròn trên đây: Latex reagent (hỗn dịch Latex gắn kháng thể kháng kháng nguyên D - Dimer). Trộn đều. Nghiêng và trộn trong vòng 2 đến 3 phút.
- Kiểm tra ngưng kết xuất hiện ở các vòng tròn, so sánh với vòng tròn có chứng dương và chứng âm để đánh giá kết quả.
- Trường hợp dương tính, tiếp tục bán định lượng bằng cách pha loãng huyết tương mẫu cần kiểm tra các nồng độ 1/2, 1/4, 1/8, 1/16 và tiến hành kỹ thuật.
VI. NHẬN ĐỊNH KẾT QUẢ
| Mẫu kiểm tra | Nồng độ (mg/ml) | |||||
| Để nguyên | Pha 1/2 | Pha 1/4 | Pha 1/8 | Pha 1/16 | ||
| (-) |
|
|
|
| < 0,05 | |
| (+) | (-) | (-) | (-) | (-) | ≥ 0,5 | < 1,0 |
| (+) | (+) | (-) | (-) | (-) | ≥ 1,0 | < 2,0 |
| (+) | (+) | (+) | (-) | (-) | ≥ 2,0 | < 4,0 |
| (+) | (+) | (+) | (+) | (-) | ≥ 4,0 | < 8,0 |
| (+) | (+) | (+) | (+) | (+) | ≥ 8,0 | |
- Ghi kết quả vào giấy xét nghiệm.
- Điền đầy đủ ngày, tháng năm và bác sĩ ký tên.
Tiến hành bằng máy đông máu tự động:
Tùy theo từng loại máy, từng serie máy, các bước thao tác có thể không hoàn toàn giống nhau; Tuy nhiên, thường tiến hành qua các bước sau:
- Mẫu huyết tương: máu chống đông bằng citrat natri, theo tỷ lệ 1 thể tích chống đông trộn với 9 thể tích máu; Ly tâm mạnh, thu huyết tương nghèo tiểu cầu.
- Bật máy, chờ đủ nhiệt độ.
- Đặt các hóa chất, huyết tương bệnh, huyết tương chứng vào đúng vị trí theo quy định của từng loại máy.
- Vào chương trình làm test định lượng D- Dimer.
- Ghi kết quả nồng độ D- Dimer vào giấy xét nghiệm.
- Điền đầy đủ ngày, tháng năm và bác sĩ ký tên.
NGƯNG TẬP TIỂU CẦU VỚI ADP/COLLAGEN/ACIDARACHIDONIC/THROMBIN/EPINEPHRIN
I. NGUYÊN LÝ
Khả năng ngưng tập của tiểu cầu xảy ra khi cho thêm chất kích tập từ ngoài vào như ADP. Collagen phản ánh một trong những chức năng quan trọng của tế bào này. Vì vậy kỹ thuật đo độ ngưng tập tiểu cầu qua đo thay đổi mật độ quang học hoặc độ trở kháng được sử dụng rộng rãi để đánh giá chức năng tiểu cầu.
II. CHỈ ĐỊNH
Tất cả những trường hợp nghi ngờ giảm chất lượng tiểu cầu: có xuất huyết, nhất là xuất huyết dưới da, niêm mạc nhưng số lượng tiểu cầu trong giới hạn bình thường; Những trường hợp nghi ngờ huyết khối tắc mạch do tăng ngưng tập tiểu cầu; Đánh giá hiệu quả điều trị thuốc chống ngưng tập tiểu cầu như aspirin.
III. CHỐNG CHỈ ĐỊNH
Giảm số lượng tiểu cầu.
IV. CHUẨN BỊ
1. Người thực hiện
- 01 kỹ thuật viên xét nghiệm.
- 01 bác sĩ nhận định kết quả.
2. Phương tiện - hóa chất
- Tủ lạnh.
- Máy ly tâm.
- Pipet 2ml, 5ml.
- Bơm kim tiêm nhựa lấy máu.
- Bông, cồn sát trùng, dây ga-rô.
- Ống nghiệm plastic có chống đông citrat natri 3,2%.
- Máy đo ngưng tập tiểu cầu theo nguyên lý quang hoặc trở kháng.
- Chất kích tập: ADP, collagen, với nồng độ thích hợp.
3. Người bệnh
Nhịn ăn trong 10 giờ trước khi lấy máu, ngừng các thuốc ảnh hưởng ngưng tập tiểu cầu (Aspirin...) 10 ngày trước khi tiến hành xét nghiệm.
4. Phiếu xét nghiệm
Chỉ định xét nghiệm được ghi rõ trong bệnh án; Giấy chỉ định xét nghiệm ghi đầy đủ thông tin về người bệnh: họ tên, tuổi, giường bệnh, khoa phòng, chẩn đoán.
V. CÁC BƯỚC TIẾN HÀNH
- Ga-rô, sát trùng, lấy khoảng 2ml máu tĩnh mạch.
- Trộn đều máu với chất chống đông citrat natri 3,2% theo tỷ lệ: 1 thể tích chống đông trộn với 9 thể tích máu.
- Ly tâm nhẹ để thu huyết tương giàu tiểu cầu.
- Tiếp tục ly tâm mạnh để thu huyết tương nghèo tiểu cầu.
- Trong một số trường hợp, có thể sử dụng máu toàn phần để làm xét nghiệm.
- Đặt baselin bằng huyết tương nghèo tiểu cầu.
- Đo độ ngưng tập tiểu cầu bằng cách cho chất kích tập (ADP/Collagen/ Risticetin) vào huyết tương giàu tiểu cầu.
VI. NHẬN ĐỊNH KẾT QUẢ
- Đánh giá mức độ ngưng tập qua độ ngưng tập tối đa (MA) của đường cong ngưng tập.
- Ghi kết quả độ ngưng tập tiểu cầu tối đa (%)vào giấy xét nghiệm.
- Điền đầy đủ ngày, tháng năm và bác sĩ ký tên.
NGƯNG TẬP TIỂU CẦU VỚI RISTOCETIN
I. NGUYÊN LÝ
Khi cho ristocetin vào huyết tương giàu tiểu cầu, sẽ xảy ra hiện tượng ngưng tập (aggregation) các tế bào này. Mức độ ngưng tập tiểu cầu với ristocetin bị suy giảm trong một số tình trạng bệnh lý. Vì vậy, ngưng tập tiểu cầu với ristocetin được sử dụng để phát hiện một số bệnh lý suy giảm chức năng ngưng tập với ristocetin.
II. CHỈ ĐỊNH
Tất cả những trường hợp nghi ngờ giảm chất lượng tiểu cầu nói chung và đặc biệt trong những trường hợp nghi ngờ bệnh Von Willebrand.
III. CHỐNG CHỈ ĐỊNH
Những trường hợp giảm số lượng tiểu cầu.
IV. CHUẨN BỊ
1. Người thực hiện
- 01 kỹ thuật viên xét nghiệm.
- 01 bác sĩ nhận định kết quả.
2. Phương tiện - hóa chất
- Tủ lạnh.
- Máy ly tâm.
- Pipet 2ml, 5ml.
- Bơm kim tiêm nhựa lấy máu.
- Bông, cồn sát trùng, dây ga-rô.
- Ống nghiệm plastic có chống đông natri citrat 3,2%.
- Máy đo ngưng tập tiểu cầu theo nguyên lý quang hoặc trở kháng.
- Chất kích tập ristocetin với nồng độ thích hợp.
3. Người bệnh
Nhịn ăn trong 10 giờ trước khi lấy máu, ngừng các thuốc ảnh hưởng ngưng tập tiểu cầu (Aspirin...) 10 ngày trước khi tiến hành xét nghiệm.
4. Phiếu xét nghiệm
Chỉ định xét nghiệm được ghi rõ trong bệnh án; Giấy chỉ định xét nghiệm ghi đầy đủ thông tin về người bệnh: họ tên, tuổi, giường bệnh, khoa phòng, chẩn đoán.
V. CÁC BƯỚC TIẾN HÀNH
- Ga-rô, sát trùng, lấy khoảng 2ml máu tĩnh mạch.
- Trộn đều máu với chất chống đông citrat natri 3,2% theo tỷ lệ: 1 thể tích chống đông trộn với 9 thể tích máu.
- Ly tâm nhẹ để thu huyết tương giàu tiểu cầu.
- Tiếp tục ly tâm mạnh để thu huyết tương nghèo tiểu cầu.
- Trong một số trường hợp, có thể sử dụng máu toàn phần để làm xét nghiệm.
- Đặt baselin bằng huyết tương nghèo tiểu cầu.
- Đo độ ngưng tập tiểu cầu bằng cách cho ristocetin vào huyết tương giàu tiểu cầu.
VI. NHẬN ĐỊNH KẾT QUẢ
- Đánh giá mức độ ngưng tập qua độ ngưng tập tối đa (MA) hoặc qua độ dốc (Slop) của đường cong ngưng tập.
- Ghi kết quả độ ngưng tập tiểu cầu tối đa (%)vào giấy xét nghiệm.
- Điền đầy đủ ngày, tháng năm và bác sĩ ký tên.
I. NGUYÊN LÝ
Chống đông bằng natri citrat sẽ làm ngừng quá trình đông máu ở giai đoạn cần ion canxi. Khi phục hồi canxi, quá trình đông máu sẽ tiếp tục. Dựa vào đặc tính này người ta khảo sát thời gian đông máu của huyết tương sau khi trả lại canxi để đánh giá đường đông máu nội sinh với sự có mặt của tiểu cầu. Đây là xét nghiệm được sử dụng để đánh giá đường đông máu nội sinh, nhất là ở những phòng xét nghiệm không triển khai được những xét nghiệm chuyên sâu hơn.
II. CHỈ ĐỊNH
Những trường hợp nghi ngờ bất thường đông cầm máu, nhất là bất thường đường đông máu nội sinh: nghi ngờ hemophilia, có biểu hiện xuất huyết, chảy máu khó cầm sau can thiệp,…
III. CHỐNG CHỈ ĐỊNH
Không có chống chỉ định.
IV. CHUẨN BỊ
1. Người thực hiện
01 kỹ thuật viên xét nghiệm.
2. Phương tiện - hóa chất
- Bình cách thủy 370C.
- Đồng hồ bấm giây.
- Bơm tiêm nhựa lấy máu
- Bông cồn sát trùng, dây ga-rô
- Ống nghiệm tan máu kích thước 75x9,5mm.
- Ống nghiệm plastic có chống đông natri citrat 3,2%.
- Pipet 200ml.
- CaCl2 M/40.
3. Người bệnh
Không cần chuẩn bị gì đặc biệt.
4. Phiếu xét nghiệm
Chỉ định xét nghiệm được ghi rõ trong bệnh án; Giấy chỉ định xét nghiệm ghi đầy đủ thông tin về người bệnh: họ tên, tuổi, giường bệnh, khoa phòng, chẩn đoán.
V. CÁC BƯỚC TIẾN HÀNH
- Ga-rô, sát trùng, lấy khoảng 2ml máu tĩnh mạch.
- Trộn đều máu với chất chống đông citrat natri 3,2% theo tỷ lệ: 1 thể tích chống đông trộn với 9 thể tích máu.
- Ly tâm nhẹ hoặc để tự lắng thu huyết tương giàu tiểu cầu.
- Mỗi ống nghiệm tan máu cho vào 200ml huyết tương giàu tiểu cầu của bệnh hoặc chứng.
- Đặt vào bình cách thủy 370C, chờ 3 đến 5 phút.
- Cho thêm vào 200ml CaCl2 M/40. Trộn đều, khởi động đồng hồ ngay khi cho canxi vào. Để yên ở bình cách thủy 370C trong thời gian 1 phút.
- Từ 1 phút 15 giây, cứ 15 giây một lần nghiêng kiểm tra đông cho đến khi đông chặt. Bấm đồng hồ dừng lại và ghi thời gian đông.
- Lặp lại tương tự với ống thứ hai của mẫu kiểm tra.
- Tiến hành tương tự với mẫu chứng.
VI. NHẬN ĐỊNH KẾT QUẢ
- Ghi kết quả: ghi thời gian Howell cả bệnh và chứng vào giấy xét nghiệm.
- Điền đầy đủ ngày, tháng năm và kỹ thuật viên tiến hành xét nghiệm ký tên.
ĐỊNH LƯỢNG TỪNG YẾU TỐ ĐÔNG MÁU NỘI SINH (VIIIC, IX, XI)
I. NGUYÊN LÝ
Thiếu hụt một hoặc nhiều yếu tố đông máu tham gia đường đông máu nội sinh: VIII, IX, XI và XII sẽ làm xét nghiệm APTT-một xét nghiệm đánh giá con đường đông máu này bị kéo dài. APTT sẽ được điều chỉnh khi bổ sung huyết tương có yếu tố thiếu hụt và mức độ điều chỉnh phụ thuộc nồng độ yếu tố thiếu hụt trong huyết tương bổ sung. Dựa vào đó, người ta pha loãng huyết tương cần xét nghiệm ra các nồng độ khác nhau và trộn với huyết tương không có yếu tố cần khảo sát để theo dõi mức độ điều chỉnh và tính ra nồng độ yếu tố đông máu đó.
II. CHỈ ĐỊNH
Tất cả những trường hợp nghi ngờ thiếu hụt một hoặc nhiều yếu tố tham gia đường đông máu nội sinh: APTT kéo dài, Mix test âm tính.
III. CHỐNG CHỈ ĐỊNH
Không có chống chỉ định.
IV. CHUẨN BỊ
1. Người thực hiện
- 01 kỹ thuật viên xét nghiệm.
- 01 bác sĩ nhận định kết quả.
2. Phương tiện - hóa chất
- Tủ lạnh.
- Máy ly tâm.
- Bình cách thủy 370C/ máy đông máu bán tự động /tự động.
- Đồng hồ bấm giây.
- Pipet: 50ml, 100ml, 1.000ml.
- Bơm kim tiêm nhựa lấy máu.
- Bông, cồn sát trùng, dây ga-rô.
- Ống nghiệm tan máu kích thước 75x9,5mm.
- Ống nghiệm plastic có chống đông natri citrat 3,2%.
- Nước cất.
- Huyết tương chứng đã biết nồng độ yếu tố cần định lượng (VIII/IX/XI).
- Huyết tương không có yếu tố yếu tố cần định lượng (VIII/IX/XI).
- Canxi M/40.
- Cephalin-kaolin.
3. Người bệnh
Không cần chuẩn bị gì đặc biệt.
4. Phiếu xét nghiệm
Chỉ định xét nghiệm được ghi rõ trong bệnh án; Giấy chỉ định xét nghiệm ghi đầy đủ thông tin về người bệnh: họ tên, tuổi, giường bệnh, khoa phòng, chẩn đoán, điều trị.
V. CÁC BƯỚC TIẾN HÀNH
- Ga-rô, sát trùng, lấy khoảng 2ml máu tĩnh mạch.
- Trộn đều máu với chất chống đông citrat natri 3,2% theo tỷ lệ: 1 thể tích chống đông trộn với 9 thể tích máu.
- Ly tâm mạnh để thu huyết tương nghèo tiểu cầu.
- Pha loãng huyết tương chứng ít nhất ở 3 nồng độ:1/10, 1/20, 1/40.
- Pha loãng huyết tương bệnh 1/10.
* Xây dựng đồ thị chuẩn: trong một dãy ống nghiệm:
+ Mỗi ống cho 100ml huyết tương chứng ở mỗi nồng độ pha loãng, 100ml huyết tương không có yếu tố cần định lượng (VIII/IX/XI), 0,1ml hỗn dịch cephalin - kaolin.
+ Ủ ở bình cách thủy 370C trong 2 phút.
+ Sau đó thêm 100ml CaCl2 M/40.
+ Bấm đồng hồ, theo dõi thời gian đông.
+ Dựa vào thời gian đông ở các độ pha loãng, ta dựng một đồ thị trong đó trục tung là thời gian đông của các độ pha loãng, trục hoành là hoạt tính của yếu tố cần định lượng. Đồ thị sẽ là một đường thẳng.
Xét nghiệm mẫu kiểm tra: các bước tiến hành như đối với huyết tương chứng. Dựa vào đồ thị ta tính được nồng độ yếu tố VIII/IX/XI.
VI. NHẬN ĐỊNH KẾT QUẢ
- Kết quả: ghi % hoạt tính yếu tố cần định lượng vào giấy xét nghiệm.
- Điền đầy đủ ngày, tháng năm và bác sĩ ký tên.
Trường hợp tiến hành trên máy tự động:
- Pha loãng huyết tương để hiệu chuẩn: tùy thuộc tiến hành theo high cure hay low cure.
- Pha loãng huyết tương bệnh hay không pha loãng, pha nồng độ nào: tùy từng loại máy.
- Chọn chương trình định lượng yếu tố đông máu tham gia đường đông máu nội sinh.
- Ghi kết quả theo đơn vị tính là %.
- Ghi kết quả % yếu tố cần định lượng vào giấy xét nghiệm.
- Điền đầy đủ ngày, tháng năm và bác sĩ ký tên.
ĐỊNH LƯỢNG TỪNG YẾU TỐ ĐÔNG MÁU NGOẠI SINH (II, V, VII, X)
I. NGUYÊN LÝ
Thiếu hụt một hoặc nhiều yếu tố đông máu tham gia đường đông máu ngoại sinh: II, V, VII, X sẽ làm xét nghiệm PT - một xét nghiệm đánh giá con đường đông máu này bị kéo dài. PT sẽ được điều chỉnh khi bổ sung huyết tương có yếu tố thiếu hụt. Dựa vào đó, người ta pha loãng huyết tương cần xét nghiệm ra các nồng độ khác nhau và trộn với huyết tương không có yếu tố cần khảo sát để theo dõi mức độ điều chỉnh và tính ra nồng độ yếu tố đông máu đó.
II. CHỈ ĐỊNH
Tất cả những trường hợp nghi ngờ thiếu hụt một hoặc nhiều yếu tố tham gia đường đông máu ngoại sinh: PT kéo dài.
III. CHỐNG CHỈ ĐỊNH
Không có chống chỉ định.
IV. CHUẨN BỊ
1. Người thực hiện
- 01 kỹ thuật viên xét nghiệm.
- 01 bác sĩ nhận định kết quả.
2. Phương tiện - hóa chất
- Tủ lạnh.
- Máy ly tâm.
- Bình cách thủy 370C/ máy đông máu bán tự động /tự động.
- Đồng hồ bấm giây.
- Pipet: 50ml, 100ml, 1.000ml.
- Bơm kim tiêm nhựa lấy máu.
- Bông, cồn sát trùng, dây ga-rô.
- Ống nghiệm tan máu kích thước 75x9,5mm.
- Ống nghiệm plastic có chống đông natri citrat 3,2%.
- Nước cất.
- Huyết tương chứng đã biết nồng độ yếu tố cần định lượng (II/V/VII/X).
- Huyết tương không có yếu tố yếu tố cần định lượng (II/V/VII/X).
- Thromboplastin.
- CaCl2 M/40.
3. Người bệnh
4. Phiếu xét nghiệm
Chỉ định xét nghiệm được ghi rõ trong bệnh án; Giấy chỉ định xét nghiệm ghi đầy đủ thông tin về người bệnh: họ tên, tuổi, giường bệnh, khoa phòng, chẩn đoán, điều trị.
V. CÁC BƯỚC TIẾN HÀNH
- Ga-rô, sát trùng, lấy khoảng 2ml máu tĩnh mạch.
- Trộn đều máu với chất chống đông citrat natri 3,2% theo tỷ lệ: 1 thể tích chống đông trộn với 9 thể tích máu.
- Ly tâm mạnh để thu huyết tương nghèo tiểu cầu.
- Pha loãng huyết tương chứng ít nhất ở 3 nồng độ: 1/10, 1/20, 1/40.
- Pha loãng huyết tương bệnh 1/10.
* Xây dựng đồ thị chuẩn: trong một dãy ống nghiệm:
Mỗi ống cho 100ml huyết tương chứng ở mỗi nồng độ pha loãng, 100ml huyết tương không có yếu tố cần định lượng (II/V/VII/X), 100ml thromboplastin.
- Ủ ở bình cách thủy 370C trong 30 giây.
- Sau đó thêm 100ml CaCl2 M/40.
- Bấm đồng hồ, theo dõi thời gian đông.
Dựa vào thời gian đông ở các độ pha loãng, ta dựng một đồ thị trong đó trục tung là thời gian đông của các độ pha loãng, trục hoành là hoạt tính của yếu tố cần định lượng. Đồ thị sẽ là một đường thẳng.
Xét nghiệm mẫu kiểm tra: các bước tiến hành như đối với huyết tương chứng.
Dựa vào đồ thị ta tính được nồng độ yếu tố II/V/VII/X.
* Trường hợp tiến hành trên máy tự động:
- Pha loãng huyết tương để hiệu chuẩn: tùy thuộc tiến hành theo high cure hay low cure.
- Pha loãng huyết tương bệnh hay không pha loãng, pha nồng độ nào: tùy từng loại máy.
- Chọn chương trình định lượng yếu tố đông máu tham gia đường đông máu ngoại sinh.
VI. NHẬN ĐỊNH KẾT QUẢ
- Kết quả theo đơn vị tính là %.
- Ghi kết quả % yếu tố cần định lượng vào giấy xét nghiệm.
- Điền đầy đủ ngày, tháng năm và bác sĩ ký tên.
I. NGUYÊN LÝ
Yếu tố XIII hoạt hóa có tác dụng làm ổn định cục fibrin. Khi thiếu hụt yếu tố XIII, cục fibrin hình thành sẽ kém bền vững, hòa tan trong dung dịch ure 5mol/l. Kỹ thuật đánh giá yếu tố XIII có bị thiếu hụt hay không dựa trên nguyên lý này. Đây là kỹ thuật hiện nay được sử dụng rộng rãi, nhất là trong điều kiện ở Việt Nam.
II. CHỈ ĐỊNH
Những trường hợp nghi ngờ thiếu hụt yếu tố XIII, nhất là thiếu yếu tố XIII bẩm sinh.
III. CHỐNG CHỈ ĐỊNH
Không có chống chỉ định.
IV. CHUẨN BỊ
1. Người thực hiện
- 01 kỹ thuật viên xét nghiệm.
- 01 bác sĩ nhận định kết quả.
2. Phương tiện - hóa chất
- Bình cách thủy 370C.
- Đồng hồ bấm giây.
- Bơm tiêm nhựa lấy máu.
- Bông cồn sát trùng, dây ga-rô.
- Ống nghiệm tan máu kích thước 75x9,5mm.
- Ống nghiệm plastic có chống đông natri citrat 3,2%.
- Pipet 200ml.
- CaCl2 M/40.
- Ure 5mol/l (300 g/l).
3. Người bệnh
Không cần chuẩn bị gì đặc biệt.
4. Phiếu xét nghiệm
Chỉ định xét nghiệm được ghi rõ trong bệnh án; Giấy chỉ định xét nghiệm ghi đầy đủ thông tin về người bệnh: họ tên, tuổi, giường bệnh, khoa phòng, chẩn đoán.
V. CÁC BƯỚC TIẾN HÀNH
- Ga-rô, sát trùng, lấy khoảng 2ml máu tĩnh mạch.
- Trộn đều máu với chất chống đông citrat natri 3,2% theo tỷ lệ: 1 thể tích chống đông trộn với 9 thể tích máu.
- Ly tâm thu huyết tương.
- Chuẩn bị 2 ống nghiệm tan máu, kích thước 75x9,5mm.
- Cho 200ml huyết tương chứng hoặc bệnh vào mỗi ống.
- Cho thêm 200l CaCl2 M/40 vào từng ống.
- Ủ ở bình cách thủy 370C trong 30 phút, sau đó cho thêm 3ml dung dịch ure 5mol/l.
- Lắc cục đông trong dung dịch ure. Để ống nghiệm trong nhiệt độ phòng qua đêm và kiểm tra cục đông vào hôm sau.
VI. NHẬN ĐỊNH KẾT QUẢ
- Đánh giá kết quả: thiếu hụt nặng yếu tố XIII, nếu cục đông tan hết.
- Ghi kết quả: yếu tố XIII bình thường hay giảm vào giấy xét nghiệm.
- Điền đầy đủ ngày, tháng năm và kỹ thuật viên tiến hành xét nghiệm ký tên.
PHÁT HIỆN CHẤT ỨC CHẾ ĐÔNG MÁU CON ĐƯỜNG NỘI SINH
I. NGUYÊN LÝ
Thời gian đông của xét nghiệm đánh giá đường nội sinh kéo dài do hai nguyên nhân chính: thiếu hụt một hoặc nhiều yếu tố tham gia đường đông máu nội sinh hoặc do có chất ức chế con đường đông máu đó. Sử dụng kỹ thuật phát hiện chất ức chế để phân biệt hai nguyên nhân này: khi trộn huyết tương người bệnh với huyết tương bình thường, các kết quả xét nghiệm sẽ trở về bình thường nếu người bệnh thiếu hụt yếu tố đông máu. Kết quả xét nghiệm không về bình thường trong trường hợp có chất ức chế quá trình đông máu.
II. CHỈ ĐỊNH
Tất cả những trường hợp kết quả xét nghiệm đánh giá đường đông máu nội sinh (APTT, Howell) kéo dài bất thường.
III. CHỐNG CHỈ ĐỊNH
Không có chống chỉ định.
IV. CHUẨN BỊ
1. Người thực hiện
- 01 kỹ thuật viên xét nghiệm.
- 01 bác sĩ nhận định kết quả.
2. Phương tiện - hóa chất
- Tủ lạnh.
- Máy ly tâm.
- Bình cách thủy 370C / máy đông máu bán tự động /tự động.
- Đồng hồ bấm giây.
- Bơm tiêm nhựa lấy máu.
- Bông cồn sát trùng, dây ga-rô.
- Ống nghiệm tan máu kích thước 75x9,5mm.
- Ống nghiệm plastic có chống đông natri citrat 3,2%.
- Pipet 100ml.
- Đồng hồ bấm giây.
- Nước cất.
- CaCl2 M/40.
- Cephalin-kaolin.
- Huyết tương chứng.
3. Người bệnh
Không cần chuẩn bị gì đặc biệt.
4. Phiếu xét nghiệm
Chỉ định xét nghiệm được ghi rõ trong bệnh án; Giấy chỉ định xét nghiệm ghi đầy đủ thông tin về người bệnh: họ tên, tuổi, giường bệnh, khoa phòng, chẩn đoán.
V. CÁC BƯỚC TIẾN HÀNH
- Ga-rô, sát trùng, lấy khoảng 2ml máu tĩnh mạch.
- Trộn đều máu với chất chống đông citrat natri 3,2% theo tỷ lệ: 1 thể tích chống đông trộn với 9 thể tích máu.
- Ly tâm mạnh để thu huyết tương nghèo tiểu cầu.
- Tiến hành xét nghiệm APTT đồng thời với 3 mẫu huyết tương trong cùng điều kiện:
+ Mẫu huyết tương chứng.
+ Mẫu huyết tương bệnh.
+ Mẫu huyết tương hỗn hợp chứng và bệnh theo tỷ lệ 1:1.
- Ghi thời gian đông của cả 3 mẫu.
VI. NHẬN ĐỊNH KẾT QUẢ
Tính chỉ số Rosner:
| APTT (bệnh + chứng) APTT chứng | x 100 |
| APTT bệnh |
- Khi chỉ số này < 12: kháng đông nội sinh âm tính.
- Khi chỉ số này > 12 và < 15: kháng đông nội sinh nghi ngờ.
- Khi chỉ số này > 15: kháng đông nội sinh dương tính.
- Ghi kết quả kháng đông nội sinh dương tính hay âm tính vào giấy xét nghiệm.
- Điền đầy đủ ngày, tháng năm và bác sĩ ký tên.
ĐỊNH TÍNH ỨC CHẾ YẾU TỐ VIII: C
I. NGUYÊN LÝ
Ức chế yếu tố VIII:C thường xuất hiện ở những người bệnh hemophilia A di truyền đã được điều trị thay thế hoặc những người bệnh hemphilia mắc phải. Phát hiện ức chế VIII:C rất cần thiết ở người bệnh hemophilia để áp dụng phác đồ điều trị đặc thù. Kỹ thuật phát hiện ức chế VIII:C dựa trên nguyên lý của nghiệm pháp trộn (mix test) và đặc điểm của ức chế VIII:C là chất ức chế hoạt động phụ thuộc thời gian và nhiệt độ.
II. CHỈ ĐỊNH
Tất cả những trường hợp nghi ngờ có ức chế VIII:C: Người bệnh hemophilia A di truyền đã được điều trị chế phẩm máu, điều trị không hiệu quả... người bệnh hemophilia A mắc phải.
III. CHỐNG CHỈ ĐỊNH
Không có chống chỉ định.
IV. CHUẨN BỊ
1. Người thực hiện
- 01 kỹ thuật viên xét nghiệm.
- 01 bác sĩ nhận định kết quả.
2. Phương tiện - hóa chất
- Tủ lạnh.
- Máy ly tâm.
- Bình cách thủy 370C/ máy đông máu bán tự động /tự động.
- Đồng hồ bấm giây.
- Bơm tiêm nhựa lấy máu.
- Bông cồn sát trùng, dây ga-rô.
- Ống nghiệm tan máu kích thước 75 x 9,5mm.
- Ống nghiệm plastic có chống đông natri citrat 3,2%.
- Pipet 100ml, 200ml, 1.000ml.
- Đồng hồ bấm giây.
- Nước cất.
- CaCl2 M/40.
- Cephalin - kaolin.
- Huyết tương chứng.
3. Người bệnh
Nhịn ăn sáng (trừ trường hợp cấp cứu).
4. Phiếu xét nghiệm
Chỉ định xét nghiệm được ghi rõ trong bệnh án; Giấy chỉ định xét nghiệm ghi đầy đủ thông tin về người bệnh: họ tên, tuổi, giường bệnh, khoa phòng, chẩn đoán, điều trị.
V. CÁC BƯỚC TIẾN HÀNH
- Ga-rô, sát trùng, lấy khoảng 2ml máu tĩnh mạch.
- Trộn đều máu với chất chống đông citrat natri 3,2% theo tỷ lệ: 1 thể tích chống đông trộn với 9 thể tích máu.
- Ly tâm mạnh để thu huyết tương nghèo tiểu cầu.
- Trong ống nghiệm, cho vào:
+ 100ml huyết tương bệnh.
+ 100ml huyết tương chứng.
Trộn đều, ủ ở bình cách thủy 370C trong 2 giờ.
- Tiến hành làm xét nghiệm APTT cho mẫu huyết tương chứng, huyết tương bệnh và huyết tương trộn chứng và bệnh sau ủ 2 giờ ở bình cách thủy 370C.
VI. NHẬN ĐỊNH KẾT QUẢ
- Huyết tương người bệnh có ức chế VIII:C khi APTT ở mẫu hỗn hợp bệnh và chứng không điều chỉnh sau ủ 370C trong 2 giờ.
- Ghi kết quả: ức chế VIII:C dương tính hay âm tính được ghi rõ vào giấy xét nghiệm.
- Điền đầy đủ ngày, tháng năm và bác sĩ ký.
ĐỊNH LƯỢNG ỨC CHẾ YẾU TỐ VIII: C
I. NGUYÊN LÝ
Ức chế yếu tố VIII: C tồn tại trong huyết tương người bệnh với những mức độ khác nhau. Định lượng ức chế VIII: C cho phép biết được nồng độ chất ức chế này và rất hữu ích trong điều trị cũng như theo dõi người bệnh. Định lượng ức chế VIII: C bằng phương pháp Bethesda đang được áp dụng rộng rãi trên thế giới.
II. CHỈ ĐỊNH
Tất cả những trường hợp kết quả xét nghiệm định tính ức chế yếu tố VIII: C cho kết quả dương tính.
III. CHỐNG CHỈ ĐỊNH
Không có chống chỉ định.
IV. CHUẨN BỊ
1. Người thực hiện
- 01 kỹ thuật viên xét nghiệm.
- 01 bác sĩ nhận định kết quả.
2. Phương tiện - hóa chất
- Tủ lạnh.
- Máy ly tâm.
- Bình cách thủy 370C/ máy đông máu bán tự động /tự động.
- Đồng hồ bấm giây.
- Giấy log kép để tính nồng độ yếu tố VIII: C (trường hợp sử dụng phương pháp thủ công).
- Bơm tiêm nhựa lấy máu.
- Bông cồn sát trùng, dây ga-rô.
- Ống nghiệm tan máu kích thước 75x9,5mm.
- Ống nghiệm plastic có chống đông natri citrat 3,2%.
- Pipet 100ml, 200ml, 1.000ml.
- Đồng hồ bấm giây.
- Nước cất.
- CaCl2 M/40.
- Cephalin-kaolin.
- Huyết tương nồng độ yếu tố VIII: C 100%.
- Huyết tương không có yếu tố VIII: C.
3. Người bệnh
Nhịn ăn sáng, trừ trường hợp cấp cứu.
4. Phiếu xét nghiệm
Chỉ định xét nghiệm được ghi rõ trong bệnh án; Giấy chỉ định xét nghiệm ghi đầy đủ thông tin về người bệnh: họ tên, tuổi, giường bệnh, khoa phòng, chẩn đoán, điều trị
V. CÁC BƯỚC TIẾN HÀNH
- Ga-rô, sát trùng, lấy khoảng 2ml máu tĩnh mạch.
- Trộn đều máu với chất chống đông citrat natri 3,2% theo tỷ lệ: 1 thể tích chống đông trộn với 9 thể tích máu.
- Ly tâm mạnh để thu huyết tương nghèo tiểu cầu.
- Pha loãng huyết tương bệnh: 1/2, 1/4, 1/8, 1/16.
- Phân phối 200ml huyết tương đã pha loãng vào ống nghiệm 1.
- Phân phối 200ml huyết tương không có yếu tố VIII: C vào ống nghiệm 2.
- Cho thêm vào ống 1 và 2: 200ml huyết tương bình thường có hoạt tính yếu tố VIII: C 100%.
- Trộn và ủ ở bình cách thủy 370C trong 2 giờ.
- Định lượng nồng độ VIII: C sau ủ.
- Tính nồng độ VIII: C còn lại trong huyết tương sau ủ.
VI. NHẬN ĐỊNH KẾT QUẢ
- Từ nồng độ hoạt tính yếu tố VIII: C còn lại tính ra nồng độ ức chế VIII: C bằng đơn vị Bethesda: 1 đơn vị Bethesda là lượng chất ức chế yếu tố trung hòa 50% yếu tố VIII: C trong thời gian 2 giờ ở điều kiện 370C.
- Ghi kết quả: ghi nồng độ ức chế VIII: C được tính bằng đơn vị Bethesda vào giấy xét nghiệm.
- Điền đầy đủ ngày, tháng năm và bác sĩ ký tên.
ĐỊNH LƯỢNG PHỨC HỆ MONOMER FIBRIN HÒA TAN
(Fms/ Fm: Fibrin monomer soluble)
I. NGUYÊN LÝ
Trong hội chứng đông máu rải rác trong lòng mạch (DIC: Disseminated intravascular coagulation), hệ thống đông máu được hoạt hóa lan rộng không kiểm soát được. Trong quá trình này, thrombin chuyển fibrinogen thành fibrin và tạo nên sản phẩm trung gian là monomer fibrin; các monomer fibrin này sẽ liên kết với các phân tử khác như fibrinogen, FDP (Fibrinogen degradation products) tạo nên phức hệ hòa tan. Phát hiện các phức hệ này bằng kỹ thuật ngưng kết nhìn thấy bằng mắt thường.
II. CHỈ ĐỊNH
Nghi ngờ hội chứng DIC.
III. CHỐNG CHỈ ĐỊNH
Không có chống chỉ định.
IV. CHUẨN BỊ
1. Người thực hiện
- 01 kỹ thuật viên xét nghiệm.
- 01 bác sĩ nhận định kết quả.
2. Phương tiện - hóa chất
- Tủ lạnh.
- Máy ly tâm.
- Đồng hồ bấm giây.
- Bơm tiêm nhựa lấy máu.
- Bông cồn sát trùng, dây ga-rô.
- Ống nghiệm tan máu kích thước 75x9,5mm.
- Ống nghiệm plastic có chống đông natri citrat 3,2%.
- Pipet 100ml, 200ml, 1.000ml.
- Đồng hồ bấm giây.
- Huyết tương chứng.
- Bộ hóa chất sinh phẩm FS, bao gồm:
+ Hồng cầu người được phủ fibrin monomer đã đông khô.
+ Chứng dương: phức hệ FS hòa tan.
+ Chứng âm: huyết tương bình thường, không có phức hệ FS hòa tan.
3. Người bệnh
Nhịn ăn sáng (trừ trường hợp cấp cứu).
4. Phiếu xét nghiệm
Chỉ định xét nghiệm được ghi rõ trong bệnh án; Giấy chỉ định xét nghiệm ghi đầy đủ thông tin về người bệnh: họ tên, tuổi, giường bệnh, khoa phòng, chẩn đoán, điều trị.
V. CÁC BƯỚC TIẾN HÀNH
- Ga-rô, sát trùng, lấy khoảng 2ml máu tĩnh mạch.
- Trộn đều máu với chất chống đông citrat natri 3,2% theo tỷ lệ: 1 thể tích chống đông trộn với 9 thể tích máu.
- Ly tâm mạnh để thu huyết tương nghèo tiểu cầu.
- Tiến hành kỹ thuật:
+ 100ml huyết tương bệnh vào ống nghiệm 1.
+ 100ml chứng dương vào ống nghiệm 2.
+ 100ml chứng âm vào ống nghiệm 3.
+ Cho thêm vào mỗi ống nghiệm 50ml hồng cầu người được phủ fibrin monomer; Ủ tất cả các ống ở bình cách thủy 370C trong 10 phút.
Đọc kết quả ngưng kết trên test Card.
VI. NHẬN ĐỊNH KẾT QUẢ
- Ghi kết quả: kết quả được thể hiện: dương tính hay âm tính, nếu dương tính, tùy mức độ, chia làm: +, ++, +++.
- Điền đầy đủ ngày, tháng năm và bác sĩ ký tên.
(Định lượng Anti thrombin/Anti thrombin III)
I. NGUYÊN LÝ
Antithrombin thuộc nhóm những chất ức chế đông máu sinh lý: ức chế thrombin và các yếu tố đông máu đã hoạt hóa: Xa, IXa, XIa, XIIa, plasmin. Thiếu hụt AT là một trong những nguyên nhân và cũng là hậu quả của huyết khối. Chính vì vậy đây là một trong những xét nghiệm hữu ích trong chẩn đoán nguyên nhân, tiến triển...của huyết khối. Nồng độ AT trong huyết tương được xác định bằng phương pháp cơ chất tạo màu.
II. CHỈ ĐỊNH
Những trường hợp nghi ngờ huyết khối tiên phát do thiếu hụt AT; Những trường hợp điều trị heparin không hiệu quả. AT cũng được chỉ định trong những trường hợp đông máu rải rác trong lòng mạch (DIC), xơ gan...
III. CHỐNG CHỈ ĐỊNH
Không có chống chỉ định.
IV. CHUẨN BỊ
1. Người thực hiện
- 01 kỹ thuật viên xét nghiệm.
- 01 bác sĩ nhận định kết quả.
2. Phương tiện - hóa chất
- Tủ lạnh.
- Máy ly tâm.
- Máy đông máu tự động.
- Đồng hồ bấm giây.
- Bơm tiêm nhựa lấy máu.
- Bông cồn sát trùng, dây ga-rô.
- Ống nghiệm tan máu kích thước 75x9,5mm.
- Ống nghiệm plastic có chống đông natri citrat 3,2%.
- Pipet 100ml, 200ml.
- Huyết tương chứng.
- NaCl 0,15 M.
Bộ sinh phẩm làm xét nghiệm AT: bao gồm 4 loại: thrombin bò, cơ chất màu, heparin, đệm.
3. Người bệnh
Nhịn ăn sáng (trừ trường hợp cấp cứu).
4. Phiếu xét nghiệm
Chỉ định xét nghiệm được ghi rõ trong bệnh án; Giấy chỉ định xét nghiệm ghi đầy đủ thông tin về người bệnh: họ tên, tuổi, giường bệnh, khoa phòng, chẩn đoán, điều trị.
V. CÁC BƯỚC TIẾN HÀNH
- Ga-rô, sát trùng, lấy khoảng 2ml máu tĩnh mạch.
- Trộn đều máu với chất chống đông citrat natri 3,2% theo tỷ lệ: 1 thể tích chống đông trộn với 9 thể tích máu.
- Ly tâm mạnh để thu huyết tương nghèo tiểu cầu.
- Chuẩn bị sinh phẩm, hóa chất: trả lại nước cất vào các lọ chứa thrombin, cơ chất màu theo hướng dẫn, để ở nhiệt độ phòng khoảng 30 phút trước khi làm xét nghiệm, đảm bảo toàn bộ chất đông khô được hòa tan hoàn toàn. Các lọ chứa heparin và đệm cần phải lắc đều trước khi tiến hành xét nghiệm.
Tiến hành kỹ thuật:
+ 100ml huyết tương bệnh đã pha loãng 1/30 với NaCl 0,15 M.
+ Cho thêm: 100ml thrombin bò.
+ Ủ ở 370C trong 1 phút.
+ Cho thêm: 100ml cơ chất tạo màu.
+ Tiến hành đo ở bước sóng 405nm.
VI. NHẬN ĐỊNH KẾT QUẢ
Kết quả nồng độ AT III được tính dựa vào đường chuẩn được thành lập của từng phòng xét nghiệm. Nồng độ AT III giảm trong những trường hợp: thiếu hụt AT III bẩm sinh, thiếu hụt AT III mắc phải (Huyết khối, suy giảm chức năng gan, điều trị chống đông).
Ghi kết quả: Nồng độ AT III được tính theo phần trăm; Ghi kết quả của mẫu cần kiểm tra và giá trị bình thường vào giấy xét nghiệm.
Điền đầy đủ ngày, tháng năm và bác sĩ ký tên.
ĐỊNH LƯỢNG KHÁNG NGUYÊN PROTEIN C
I. NGUYÊN LÝ
Protein c (PC) thuộc nhóm ức chế đông máu sinh lý phụ thuộc vitamin K. Sự thiếu hụt PC có thể do bẩm sinh hoặc mắc phải và đều có thể gây nên tắc mạch, huyết khối. Xác định nồng độ của PC qua hai bước: hoạt hóa PC bằng chất hoạt hóa và sau đó đo nồng độ PC đã hoạt hóa bằng phương pháp cơ chất tạo màu.
II. CHỈ ĐỊNH
Những trường hợp huyết khối, đặc biệt là huyết khối ở người trẻ tuổi; Những trường hợp nghi ngờ thiếu hụt PC mắc phải: xơ gan, DIC…
III. CHỐNG CHỈ ĐỊNH
Không có chống chỉ định.
IV. CHUẨN BỊ
1. Người thực hiện
- 01 kỹ thuật viên xét nghiệm.
- 01 bác sĩ nhận định kết quả.
2. Phương tiện - hóa chất
- Tủ lạnh.
- Máy ly tâm.
- Máy đông máu tự động.
- Đồng hồ bấm giây.
- Bơm tiêm nhựa lấy máu.
- Bông cồn sát trùng, dây ga-rô.
- Ống nghiệm tan máu kích thước 75x9,5mm.
- Ống nghiệm plastic có chống đông natri citrat 3,2%.
- Pipet 100ml, 200ml.
- Huyết tương chứng.
- NaCl 0,15 M.
Bộ sinh phẩm làm xét nghiệm PC: bao gồm hai loại: chất hoạt hóa PC đã đông khô, cơ chất tạo màu đã đông khô.
3. Người bệnh
Nhịn ăn sáng (trừ trường hợp cấp cứu).
4. Phiếu xét nghiệm
Chỉ định xét nghiệm được ghi rõ trong bệnh án; Giấy chỉ định xét nghiệm ghi đầy đủ thông tin về người bệnh: họ tên, tuổi, giường bệnh, khoa phòng, chẩn đoán, điều trị.
V. CÁC BƯỚC TIẾN HÀNH
- Ga-rô, sát trùng, lấy khoảng 2ml máu tĩnh mạch.
- Trộn đều máu với chất chống đông citrat natri 3,2% theo tỷ lệ: 1 thể tích chống đông trộn với 9 thể tích máu.
- Ly tâm mạnh để thu huyết tương nghèo tiểu cầu.
- Chuẩn bị sinh phẩm, hóa chất: trả lại một lượng nước cất nước cất vào các lọ chứa chất hoạt hóa PC, chất so màu theo chỉ dẫn. Nghiêng nhẹ nhàng, đảm bảo tan hết chất đông khô trong lọ. Để yên ở nhiệt độ phòng khoảng 15-30 phút mới sử dụng làm xét nghiệm.
- Tiến hành kỹ thuật:
+ 100ml huyết tương bệnh.
+ Cho thêm: 100ml chất hoạt hóa PC.
+ Cho thêm: 100ml cơ chất tạo màu.
+ Trộn đều và ủ ở 370C trong 3 phút
+ Tiến hành đo ở bước sóng 405nm.
VI. NHẬN ĐỊNH KẾT QUẢ
- Hoạt tính PC được tính dựa vào đường chuẩn được thành lập của từng phòng xét nghiệm.
- Ghi kết quả: nồng độ PC được tính theo phần trăm; Ghi kết quả của mẫu cần kiểm tra và giá trị bình thường vào giấy xét nghiệm.
- Điền đầy đủ ngày, tháng năm và bác sĩ ký tên.
ĐỊNH LƯỢNG HOẠT TÍNH PROTEIN C
I. NGUYÊN LÝ
Protein C (PC) chức năng được đo dựa trên sự kéo dài của xét nghiệm APTT.
II. CHỈ ĐỊNH
Những trường hợp huyết khối nghi ngờ do thiếu hụt PC: huyết khối ở người trẻ tuổi, huyết khối những vị trí bất thường.
III. CHỐNG CHỈ ĐỊNH
Không có chống chỉ định.
IV. CHUẨN BỊ
1. Người thực hiện
- 01 kỹ thuật viên xét nghiệm.
- 01 bác sĩ nhận định kết quả.
2. Phương tiện - hóa chất
- Tủ lạnh.
- Máy ly tâm.
- Bình cách thủy 370C/ máy đông máu bán tự động /tự động.
- Đồng hồ bấm giây.
- Bơm tiêm nhựa lấy máu.
- Bông cồn sát trùng, dây ga-rô.
- Ống nghiệm tan máu kích thước 75x9,5mm.
- Ống nghiệm plastic có chống đông natri citrat 3,2%.
- Pipet 100ml, 200ml.
- Huyết tương chứng.
- NaCl 0,15 M.
Bộ sinh phẩm làm xét nghiệm đo hoạt tính PC: bao gồm hai loại: huyết tương không có PC đã đông khô, chất hoạt hóa PC đã đông khô.
3. Người bệnh
Nhịn ăn sáng (trừ trường hợp cấp cứu).
4. Phiếu xét nghiệm
Chỉ định xét nghiệm được ghi rõ trong bệnh án; Giấy chỉ định xét nghiệm ghi đầy đủ thông tin về người bệnh: họ tên, tuổi, giường bệnh, khoa phòng, chẩn đoán, điều trị.
V. CÁC BƯỚC TIẾN HÀNH
- Ga-rô, sát trùng, lấy khoảng 2ml máu tĩnh mạch.
- Trộn đều máu với chất chống đông citrat natri 3,2% theo tỷ lệ: 1 thể tích chống đông trộn với 9 thể tích máu.
- Ly tâm mạnh để thu huyết tương nghèo tiểu cầu.
Chuẩn bị sinh phẩm, hóa chất: trả lại một lượng nước cất vào các lọ trong bộ sinh phẩm theo chỉ dẫn. Nghiêng nhẹ nhàng, đảm bảo tan hết chất đông khô trong lọ. Để yên ở nhiệt độ phòng khoảng 15-30 phút mới sử dụng làm xét nghiệm.
- Tiến hành kỹ thuật:
+ 100ml huyết tương bệnh.
+ Cho thêm: 100ml huyết tương không có PC.
+ Cho thêm: 100ml chất hoạt hóa PC.
+ Trộn đều và ủ ở 370C trong 3 phút.
+ Cho thêm: 100ml CaCl2 M/40. Đo thời gian đông.
VI. NHẬN ĐỊNH KẾT QUẢ
Nồng độ PC chức năng được tính dựa vào đường chuẩn được thành lập của từng phòng xét nghiệm.
Ghi kết quả: Nồng độ PC chức năng được tính theo phần trăm; Ghi kết quả của mẫu cần kiểm tra và giá trị bình thường vào giấy xét nghiệm.
Điền đầy đủ ngày, tháng năm và bác sĩ ký tên.
I. NGUYÊN LÝ
Protein S (PS) là chất ức chế đông máu sinh lý, phụ thuộc vitamin K, là đồng yếu tố của protein C. Trong huyết tương, PS tồn tại dưới hai dạng: dạng tự do và dạng liên kết với protein. Chỉ ở dạng tự do PS mới có tác dụng ức chế đông máu. Thiếu hụt PS có thể di truyền hoặc mắc phải và là một trong những nguyên nhân gây huyết khối tắc mạch. PS chức năng được định lượng dựa trên sự chế yếu tố Va.
II. CHỈ ĐỊNH
Những trường hợp nghi ngờ thiếu hụt PS bẩm sinh: huyết khối, nhất là huyết khối khi còn trẻ, có tính chất gia đình; Thiếu hụt PS mắc phải: xơ gan, điều trị chống đông máu.
III. CHỐNG CHỈ ĐỊNH
Không có chống chỉ định.
IV. CHUẨN BỊ
1. Người thực hiện
- 01 kỹ thuật viên xét nghiệm.
- 01 bác sĩ nhận định kết quả.
2. Phương tiện - hóa chất
- Tủ lạnh.
- Máy ly tâm.
- Bình cách thủy 370C/ máy đông máu bán tự động /tự động.
- Đồng hồ bấm giây.
- Bơm tiêm nhựa lấy máu.
- Bông cồn sát trùng, dây ga-rô.
- Ống nghiệm tan máu kích thước 75x9,5mm.
- Ống nghiệm plastic có chống đông natri citrat 3,2%.
- Pipet 100ml, 200ml.
- Huyết tương chứng.
- NaCl 0,15 M.
- Sinh phẩm làm xét nghiệm PS, bao gồm:
+ R1: huyết tương không có PS.
+ R2: protein C đã hoạt hóa.
+ R3: chất hoạt hóa protein C.
3. Người bệnh
Nhịn ăn sáng (trừ trường hợp cấp cứu).
4. Phiếu xét nghiệm
Chỉ định xét nghiệm được ghi rõ trong bệnh án; Giấy chỉ định xét nghiệm ghi đầy đủ thông tin về người bệnh: họ tên, tuổi, giường bệnh, khoa phòng, chẩn đoán, điều trị.
V. CÁC BƯỚC TIẾN HÀNH
- Ga-rô, sát trùng, lấy khoảng 2ml máu tĩnh mạch.
- Trộn đều máu với chất chống đông citrat natri 3,2% theo tỷ lệ: 1 thể tích chống đông trộn với 9 thể tích máu.
- Ly tâm mạnh để thu huyết tương nghèo tiểu cầu.
- Chuẩn bị sinh phẩm, hóa chất: trả lại nước cất vào các lọ chứa thrombin, cơ chất màu theo hướng dẫn, để ở nhiệt độ phòng khoảng 30 phút trước khi làm xét nghiệm, đảm bảo toàn bộ chất đông khô được hòa tan hoàn toàn. Các lọ chứa heparin và đệm cần phải lắc đều trước khi tiến hành xét nghiệm.
- Tiến hành kỹ thuật: trong 1 ống nghiệm cho:
+ 100ml huyết tương bệnh (hoặc chứng)
+ Cho thêm:
100ml R1
100ml R2
100ml R3
Trộn và ủ ở bình cách thủy 370C trong 3 phút
+ Cho thêm 100ml CaCl2 M/40
Bấm đồng hồ, ghi thời gian đông.
VI. NHẬN ĐỊNH KẾT QUẢ
Kết quả nồng độ PS được tính dựa vào đường chuẩn được thành lập bởi từng phòng xét nghiệm. Nồng độ PS giảm trong những trường hợp: thiếu hụt PS bẩm sinh, thiếu hụt PS mắc phải (tình trạng nhiễm trùng, xơ gan, điều trị kháng vitamin K...).
Ghi kết quả: nồng độ PS được tính theo phần trăm; Ghi kết quả của mẫu cần kiểm tra và giá trị bình thường vào giấy xét nghiệm.
Điền đầy đủ ngày, tháng năm và bác sĩ ký tên.
PHÁT HIỆN KHÁNG ĐÔNG LUPUS (LA/LAC)
I. NGUYÊN LÝ
Sự có mặt trong máu chất chống đông máu dạng lupus (LA/LAC: Lupus anticoagulant) là nguyên nhân gây nên tình trạng giảm đông trên xét nghiệm nhưng có nguy cơ gây huyết khối trên lâm sàng và là một trong những tiêu chuẩn quan trọng trong chẩn đoán hội chứng antiphospholipid. Có nhiều kỹ thuật phát hiện LA, tuy nhiên đều dựa trên nguyên lý chung là: tiến hành sàng lọc LA bằng kỹ thuật đo thời gian đông với phospholipid pha loãng và sau đó khẳng định sự có mặt của LA bằng kỹ thuật đo thời gian đông với phospholipid nồng độ cao.
II.CHỈ ĐỊNH
Những trường hợp nghi ngờ có chất ức chế đông máu dạng lupus: APTT kéo dài không rõ nguyên nhân, bệnh hệ thống, nghi ngờ hội chứng antiphospholipid: huyết khối động mạch và /hoặc tĩnh mạch, sẩy thai.
III. CHỐNG CHỈ ĐỊNH
Không có chống chỉ định.
IV. CHUẨN BỊ
1. Người thực hiện
- 01 kỹ thuật viên xét nghiệm.
- 01 bác sĩ nhận định, đánh giá xét nghiệm.
2. Phương tiện - hóa chất
- Tủ lạnh.
- Máy ly tâm.
- Bình cách thủy 370C/ máy đông máu bán tự động /tự động.
- Đồng hồ bấm giây.
- Bơm tiêm nhựa lấy máu.
- Bông cồn sát trùng, dây ga-rô.
- Ống nghiệm tan máu kích thước 75x9,5mm.
- Ống nghiệm plastic có chống đông natri citrat 3,2%.
- Pipet 100ml, 1.000ml.
- Đồng hồ bấm giây.
- Nước cất.
- Bộ hóa chất sinh phẩm làm xét nghiệm LA bao gồm:
+ R1: dung dịch đệm.
+ R2: phosphatidylethanolamine hexagonal.
+ R3: huyết tương bình thường đông khô.
+ R4: PTT- LS chứa cephalin và chất hoạt hóa silic.
3. Người bệnh
Không cần chuẩn bị gì đặc biệt.
4. Phiếu xét nghiệm
Chỉ định xét nghiệm được ghi rõ trong bệnh án; Giấy chỉ định xét nghiệm ghi đầy đủ thông tin về người bệnh: họ tên, tuổi, giường bệnh, khoa phòng, chẩn đoán.
V. CÁC BƯỚC TIẾN HÀNH
- Ga-rô, sát trùng, lấy khoảng 2ml máu tĩnh mạch
- Trộn đều máu với chất chống đông citrat natri 3,2% theo tỷ lệ: 1 thể tích chống đông trộn với 9 thể tích máu.
- Ly tâm mạnh 2 lần để thu huyết tương thật sự nghèo tiểu cầu
- Tiến hành kỹ thuật:
+ 50ml huyết tương bệnh vào 2 ống nghiệm; 1 và 2.
+ Cho thêm vào ống 1: 50ml R1; 50ml R3; 100ml R4. Trộn đều và cho thêm 100ml CaCl2 0,025M. Đo thời gian đông.
+ Cho thêm vào ống 2: 50ml R2; 50ml R3; 100ml R4. Trộn đều và cho thêm 100ml CaCl2 0,025M. Đo thời gian đông.
VI. NHẬN ĐỊNH KẾT QUẢ
So sánh thời gian đông giữa ống nghiệm 1 và 2 để đánh giá kết quả:
- Thời gian đông ống 1 dài hơn ống 2 trên 8 giây: LA dương tính.
- Ghi kết quả: LA dương tính hay âm tính vào giấy xét nghiệm.
- Điền đầy đủ ngày, tháng năm và bác sĩ ký tên.
I. NGUYÊN LÝ
Fibrinogen là cơ chất đóng vai trò quan trọng trong quá trình đông máu. Có nhiều phương pháp định lượng fibrinogen, phương pháp được sử dụng khá thông dụng là sử dụng thrombin. Thrombin có tác dụng chuyển fibrinogen thành fibrin, tạo cục đông máu. Sử dụng thrombin nồng độ thích hợp để đo thời gian đông. Qua đó tính được nồng độ fibrin.
II. CHỈ ĐỊNH
Tất cả những trường hợp bất thường đông máu nghi ngờ do giảm số lượng và/ hoặc chất lượng fibrinogen, do ức chế giai đoạn này của quá trình đông máu bởi ngăn cản quá trình trùng hợp tạo fibrin: tăng cao các sản phẩm thoái giáng fibrin... thường gặp trong đông máu rải rác trong lòng mạch, tiêu sợi huyết tiên phát...
III. CHỐNG CHỈ ĐỊNH
Không có chống chỉ định.
IV. CHUẨN BỊ
1. Người thực hiện
01 kỹ thuật viên xét nghiệm.
2. Phương tiện - hóa chất
- Tủ lạnh.
- Máy ly tâm.
- Bình cách thủy 370C/ máy đông máu bán tự động /tự động.
- Đồng hồ bấm giây.
- Bơm tiêm nhựa lấy máu.
- Bông cồn sát trùng, dây ga-rô.
- Ống nghiệm tan máu kích thước 75x9,5mm.
- Ống nghiệm plastic có chống đông natri citrat 3,2%.
- Pipet 100ml, 1.000ml.
- Thrombin pha loãng nồng độ thích hợp theo hướng dẫn.
3. Người bệnh
Không cần chuẩn bị gì đặc biệt.
4. Phiếu xét nghiệm
Chỉ định xét nghiệm được ghi rõ trong bệnh án; Giấy chỉ định xét nghiệm ghi đầy đủ thông tin về người bệnh: họ tên, tuổi, giường bệnh, khoa phòng, chẩn đoán.
V. CÁC BƯỚC TIẾN HÀNH
- Ga-rô, sát trùng, lấy khoảng 2ml máu tĩnh mạch.
- Trộn đều máu với chất chống đông citrat natri 3,2% theo tỷ lệ: 1 thể tích chống đông trộn với 9 thể tích máu.
- Ly tâm mạnh để thu huyết tương nghèo tiểu cầu.
- Thiết lập đường chuẩn bằng pha loãng huyết tương chứng có nồng độ fibrinogen đã biết trước ở các nồng độ khác nhau.
- Phân phối 100ml huyết tương nghèo đã pha loãng vào các ống nghiệm, để vào bình cách thủy 370C.
- Cho thêm 100ml thrombin ở nồng độ thích hợp đã xác định. Khởi động đồng hồ; Ghi thời gian đông.
Đối với mẫu cần kiểm tra:
- Phân phối 100ml huyết tương nghèo tiểu cầu cần kiểm tra vào ống nghiệm, để vào bình cách thủy 370C.
- Cho thêm 100ml thrombin ở nồng độ thích hợp đã xác định. Khởi động đồng hồ. Ghi thời gian đông.
- Từ đường chuẩn, tính ra lượng fibrinogen ở mẫu cần kiểm tra.
- Tiến hành trên máy bán tự động /tự động:
- Xử lý mẫu máu tương tự tiến hành thủ công.
- Chọn chương trình tiến hành đinh lượng fibrinogen (phương pháp gián tiếp hoặc trực tiếp).
- Cho đầy đủ hóa chất vào các khay hóa chất (thrombin, dung dịch pha loãng).
- Cho huyết tương cần kiểm tra, huyết tương chứng vào khay mẫu.
- Tiến hành thao tác theo hướng dẫn của nhà sản xuất.
VI. NHẬN ĐỊNH KẾT QUẢ
- Ghi kết quả nồng độ fibrinogen (g/l hoặc g /dl) vào giấy xét nghiệm.
- Điền đầy đủ ngày, tháng năm và kỹ thuật viên tiến hành xét nghiệm ký tên.
I. NGUYÊN LÝ
Thời gian tiêu euglobulin huyết tương là một trong những xét nghiệm được sử dụng để đánh giá tình trạng tiêu sợi huyết. Dựa vào đặc tính tủa trong môi trường acid của các euglobulin huyết tương, người ta acid hóa huyết tương để thu những chất này và loại bỏ các chất ức chế tiêu sợi huyết. Sau đó làm đông euglobulin huyết tương và theo dõi thời gian tiêu đông; Thời gian tiêu của cục đông trong trường hợp này phản ánh mức độ hoạt động của hệ thống tiêu sợi huyết.
II. CHỈ ĐỊNH
Những trường hợp nghi ngờ đông máu rải rác trong lòng mạch (DIC), tiêu sợi huyết tiên phát, một số trường hợp điều trị thuốc tiêu sợi huyết.
III. CHỐNG CHỈ ĐỊNH
Không có chống chỉ định.
IV. CHUẨN BỊ
1. Người thực hiện
- 01 kỹ thuật viên xét nghiệm.
- 01 bác sĩ đọc kết quả.
2. Phương tiện - hóa chất
- Máy ly tâm.
- Bình cách thủy 370C.
- Đồng hồ bấm giây.
- Pipet 100ml, 3.000ml
- Pipet pasteur.
- Bơm kim tiêm nhựa lấy máu.
- Bông, cồn sát trùng, dây ga-rô.
- Ống nghiệm tan máu kích thước 75x9,5mm.
- Ống nghiệm plastic có chống đông natri citrat 3,2%.
- Nước cất.
- CaCl2 M/40.
- Acid acetic 1,6 % pha loãng thành 1/100 trong nước cất.
- Dung dịch đệm borat pH 7,6.
3. Người bệnh
Không cần chuẩn bị gì đặc biệt.
4. Phiếu xét nghiệm
Chỉ định xét nghiệm được ghi rõ trong bệnh án; Giấy chỉ định xét nghiệm ghi đầy đủ thông tin về người bệnh: họ tên, tuổi, giường bệnh, khoa phòng, chẩn đoán.
V. CÁC BƯỚC TIẾN HÀNH
- Ga-rô, sát trùng, lấy khoảng 2ml máu tĩnh mạch.
- Trộn đều máu với chất chống đông citrat natri 3,2% theo tỷ lệ: 1 thể tích chống đông trộn với 9 thể tích máu.
- Ly tâm mạnh để thu huyết tương nghèo tiểu cầu.
- Trong ống nghiệm kích thức 75x12mm cho 0,3ml huyết tương nghèo tiểu cầu, cho thêm 9,5ml acid acetic đã được pha 1/100 trong nước cất.
- Đảo nhẹ ống trộn đều.
- Để vào tủ lạnh 40C trong 20 phút.
- Lấy ra chia đều sang 2 ống.
- Ly tâm 300 vòng x10 phút.
- Lấy ra gạn bỏ phần nước trong giữ lại tủa, dùng giấy lọc thấm khô thành ống.
- Cho vào mỗi ống 0,25ml CaCl2 M/40 đặt vào bình cách thủy 370C, theo dõi tới lúc đông và bấm đồng hồ theo dõi thời gian.
VI. NHẬN ĐỊNH KẾT QUẢ
- Tan trước 10 phút: tiêu sợi huyết tối cấp, nặng.
- Tan 10-30 phút: tiêu sợi huyết cấp.
- Tan 30-60 phút: tiêu sợi huyết bán cấp.
- Tan từ 60-120 phút: tiêu sợi huyết tiềm tàng.
- Tan sau 120 phút: bình thường.
- Ghi kết quả vào giấy xét nghiệm.
- Điền đầy đủ ngày, tháng năm và bác sĩ ký tên.
ĐÁNH GIÁ TỔNG QUÁT CHỨC NĂNG TIỂU CẦU BẰNG MÁY TỰ ĐỘNG
(PFA: Platelet Function Analyzer)
I. NGUYÊN LÝ
Hai đặc tính quan trọng của tiểu cầu là dính và ngưng tập, nhờ những đặc tính này, tiểu cầu thực hiện vai trò của mình trong cầm máu. PFA là xét nghiệm đánh giá được cả 2 chức năng này của tiểu cầu được thể hiện qua thời gian bít 1 lỗ thủng có kích thước chuẩn trong điều kiện có đầy đủ chất gây dính và ngưng tập tiểu cầu, dưới tác động của dòng chảy tương tự trong cơ thể.
II. CHỈ ĐỊNH
Tất cả những trường hợp nghi ngờ bất thường chức năng tiểu cầu: bẩm sinh, mắc phải, nghi ngờ bệnh Von Willebrand, phẫu thuật tim.
III. CHỐNG CHỈ ĐỊNH
Những trường hợp giảm nặng số lượng tiểu cầu.
IV. CHUẨN BỊ
1. Người thực hiện
- 01 kỹ thuật viên xét nghiệm.
- 01 bác sĩ nhận định kết quả.
2. Phương tiện - hóa chất
- Tủ lạnh bảo quản hóa chất, sinh phẩm.
- Máy phân tích chức năng tiểu cầu PFA- 100.
- Bơm tiêm nhựa lấy máu.
- Bông cồn sát trùng, dây ga-rô.
- Ống nghiệm plastic có chống đông natri citrat 3,2%.
- Pipet 100ml.
- Bộ kit làm xét nghiệm PFA: PFA collagen/Epi Test Cartridge và PFA collagen/ADP Test Cartridge.
3. Người bệnh
Ngừng thuốc ảnh hưởng chức năng tiểu cầu ít nhất 10 ngày trước khi tiến hành xét nghiệm.
4. Phiếu xét nghiệm
Chỉ định xét nghiệm được ghi rõ trong bệnh án; Giấy chỉ định xét nghiệm ghi đầy đủ thông tin về người bệnh: họ tên, tuổi, giường bệnh, khoa phòng, chẩn đoán...
V. CÁC BƯỚC TIẾN HÀNH
- Ga-rô, sát trùng, lấy khoảng 2ml máu tĩnh mạch.
- Trộn đều máu với chất chống đông citrat natri 3,2% theo tỷ lệ: 1 thể tích chống đông trộn với 9 thể tích máu.
- Tiến hành sàng lọc: lắp PFA collagen/Epi Test Cartridge vào máy.
- Tiến hành khẳng định: lắp PFA collagen/ADP Test Cartridge vào máy.
- Hút 800ml máu toàn phần đã chuẩn bị ở trên cho vào vị trí đo của cartridge.
- Vào chương trình chạy Test.
- Khi kết thúc quá trình xét nghiệm: máy sẽ báo và in kết quả ra giấy.
VI. NHẬN ĐỊNH KẾT QUẢ
- Ghi kết quả của bệnh và giá trị bình thường vào giấy xét nghiệm.
- Điền đầy đủ ngày, tháng năm và bác sĩ ký tên.
ĐỊNH LƯỢNG HOẠT TÍNH YẾU TỐ VON WILLEBRAND
I. NGUYÊN LÝ
Von Willebrand là bệnh rối loạn đông máu di truyền thường gặp. Định lượng hoạt tính yếu tố Von Willebrand là một trong những xét nghiệm bắt buộc để chẩn đoán bệnh này và phương pháp miễn dịch latex trên máy đông máu tự động có kênh miễn dịch là phương pháp đang được áp dụng rộng rãi trên thế giới cũng như ở Việt Nam.
II. CHỈ ĐỊNH
Những trường hợp nghi ngờ bệnh Von Willebrand: chảy máu khó cầm có tính chất di truyền cả hai giới, thường chảy máu niêm mạc, bầm tím; Xét nghiệm: APTT kéo dài không phải do có chất ức chế.
III. CHUẨN BỊ
1. Người thực hiện
- 01 kỹ thuật viên xét nghiệm.
- 01 bác sĩ nhận định kết quả.
2. Phương tiện - hóa chất
- Tủ lạnh.
- Máy ly tâm.
- Máy đông máu tự động có kênh miễn dịch.
- Đồng hồ bấm giây.
- Bơm tiêm nhựa lấy máu.
- Bông cồn sát trùng, dây ga-rô.
- Ống nghiệm tan máu kích thước 75x9,5mm.
- Ống nghiệm plastic có chống đông natri citrat 3,2%.
- Pipet 100ml, 1.000ml.
- Bộ kit xét nghiệm bao gồm: latex đã được phủ kháng thể đơn dòng kháng Von Willebrand chức năng; dung dịch đệm.
3. Người bệnh
Không cần chuẩn bị gì đặc biệt.
4. Phiếu xét nghiệm
Chỉ định xét nghiệm được ghi rõ trong bệnh án; Giấy chỉ định xét nghiệm ghi đầy đủ thông tin về người bệnh: họ tên, tuổi, giường bệnh, khoa phòng, chẩn đoán.
IV. CÁC BƯỚC TIẾN HÀNH
- Ga-rô, sát trùng, lấy khoảng 2ml máu tĩnh mạch.
- Trộn đều máu với chất chống đông citrat natri 3,2% theo tỷ lệ: 1 thể tích chống đông trộn với 9 thể tích máu.
- Ly tâm mạnh để thu huyết tương nghèo tiểu cầu.
- Cho huyết tương cần kiểm tra vào khay mẫu.
- Cho hóa chất ở bộ kit xét nghiệm vào đúng vị trí ở khay hóa chất.
- Chọn chương trình làm xét nghiệm định lượng Von Willebrand activity.
V. NHẬN ĐỊNH KẾT QUẢ
- Ghi kết quả nồng độ Von Willebrand activity tính bằng % vào giấy xét nghiệm.
- Điền đầy đủ ngày, tháng năm và bác sĩ tiến hành xét nghiệm ký tên.
ĐỊNH LƯỢNG KHÁNG NGUYÊN YẾU TỐ VON WILLEBRAND
I. NGUYÊN LÝ
Von Willebrand là bệnh rối loạn đông máu di truyền thường gặp. Định lượng kháng nguyên yếu tố Von Willebrand là một trong những xét nghiệm bắt buộc để chẩn đoán bệnh này và phương pháp miễn dịch latex trên máy đông máu tự động có kênh miễn dịch là phương pháp đang được áp dụng rộng rãi trên thế giới cũng như ở Việt Nam.
II. CHỈ ĐỊNH
Những trường hợp nghi ngờ bệnh Von Willebrand: chảy máu khó cầm có tính chất di truyền cả hai giới, thường chảy máu niêm mạc, bầm tím; Xét nghiệm: APTT kéo dài không phải do có chất ức chế.
III. CHỐNG CHỈ ĐỊNH
Không có chống chỉ định.
IV. CHUẨN BỊ
1. Cán bộ thực hiện
- 01 kỹ thuật viên xét nghiệm.
- 01 bác sĩ nhận định kết quả.
2. Phương tiện - hóa chất
- Tủ lạnh.
- Máy ly tâm.
- Máy đông máu tự động có kênh miễn dịch.
- Đồng hồ bấm giây.
- Bơm tiêm nhựa lấy máu.
- Bông cồn sát trùng, dây ga-rô.
- Ống nghiệm tan máu kích thước 75x9,5mm.
- Ống nghiệm plastic có chống đông natri citrat 3,2%.
- Pipet 100ml, 1.000ml.
- Bộ kit xét nghiệm bao gồm: latex đã được phủ kháng thể kháng kháng nguyên yếu tố Von Willebrand; Dung dịch đệm.
3. Người bệnh
Không cần chuẩn bị gì đặc biệt.
4. Phiếu xét nghiệm
Chỉ định xét nghiệm được ghi rõ trong bệnh án; Giấy chỉ định xét nghiệm ghi đầy đủ thông tin về người bệnh: họ tên, tuổi, giường bệnh, khoa phòng, chẩn đoán...
V. CÁC BƯỚC TIẾN HÀNH
- Ga-rô, sát trùng, lấy khoảng 2ml máu tĩnh mạch.
- Trộn đều máu với chất chống đông citrat natri 3,2% theo tỷ lệ: 1 thể tích chống đông trộn với 9 thể tích máu.
- Ly tâm mạnh để thu huyết tương nghèo tiểu cầu.
- Cho huyết tương cần kiểm tra vào khay mẫu.
- Cho hóa chất ở bộ kit xét nghiệm vào đúng vị trí ở khay hóa chất.
- Chọn chương trình làm xét nghiệm định lượng kháng nguyên yếu tố Von Willebrand.
VI. NHẬN ĐỊNH KẾT QUẢ
- Ghi kết quả nồng độ kháng nguyên yếu tố Von Willebrand tính bằng % vào giấy xét nghiệm.
- Điền đầy đủ ngày, tháng năm và bác sĩ tiến hành xét nghiệm ký tên.
I. NGUYÊN LÝ
Quá tình đông cầm máu có sự tham gia của rất nhiều yếu tố: các yếu tố đông máu, tiểu cầu, các thành phần khác như hồng cầu, bạch cầu. TEG là một trong những xét nghiệm thuộc nhóm phản ánh một cách tổng thể quá trình đông máu với sự tham gia của hầu hết các yếu tố trong quá trình đông máu (globale test).
II. CHỈ ĐỊNH
Tất cả những trường hợp nghi ngờ bất thường đông cầm máu: tăng đông, giảm đông, DIC, tiêu sợi huyết...
III. CHỐNG CHỈ ĐỊNH
Không có chống chỉ định.
IV. CHUẨN BỊ
1. Người thực hiện
- 01 kỹ thuật viên xét nghiệm.
- 01 bác sĩ nhận định kết quả.
2. Phương tiện - hóa chất
- Tủ lạnh báo quản hóa chất, sinh phẩm.
- Máy TEG.
- Bơm tiêm nhựa lấy máu.
- Bông cồn sát trùng, dây ga-rô.
- Ống nghiệm tan máu kích thước 75x9,5mm.
- Ống nghiệm plastic có chống đông natri citrat 3,2%.
- Pipet 100ml, 1.000ml.
- Hóa chất, sinh phẩm: kaolin, CaCl2 M/40.
3. Người bệnh
Không cần chuẩn bị gì đặc biệt.
4. Phiếu xét nghiệm
Chỉ định xét nghiệm được ghi rõ trong bệnh án; Giấy chỉ định xét nghiệm ghi đầy đủ thông tin về người bệnh: họ tên, tuổi, giường bệnh, khoa phòng, chẩn đoán.
V. CÁC BƯỚC TIẾN HÀNH
1. Chuẩn bị mẫu
- Ga-rô, sát trùng, lấy khoảng 2ml máu tĩnh mạch.
- Trộn đều máu với chất chống đông citrat natri 3,2% theo tỷ lệ: 1 thể tích chống đông trộn với 9 thể tích máu.
2. Chuẩn bị máy
- Cân chỉnh thăng bằng máy.
- Chạy e test.
3. Tiến hành
- Nhập thông tin người bệnh: họ tên, tuổi, khoa phòng.
- Lắp cup và pin vào đúng vị trí của máy.
- Hút 1.000ml máu toàn phần của mẫu cần kiểm tra cho vào ống chứa sẵn kaolin, trộn đều.
- Cho 20ml CaCl2 M/40 vào cup.
- Cho thêm vào cup 340ml máu đã trộn với kaolin.
- Đẩy cần về vị trí test; Máy sẽ tự động cho kết quả hiện trên màn hình.
VI. NHẬN ĐỊNH KẾT QUẢ
- Ghi kết quả các chỉ số: r, k, góc, MA, CI, Lys 30 vào giấy xét nghiệm.
- Điền đầy đủ ngày, tháng năm và bác sĩ xét nghiệm ký tên.
(FDP: Fibrin and fibrinogen Degradation Product)
I. NGUYÊN LÝ
FDP là sản phẩm thoái giáng của fibrinogen và fibrin dưới tác dụng của plasmin. Tăng FDP là một trong những bằng chứng cho thấy tình trạng tăng tiêu sợi huyết của cơ thể. Có nhiều phương pháp định lượng FDP, trong đó phương pháp miễn dịch gắn latex được áp dụng rộng rãi: khi trộn huyết thanh dịch treo có hạt latex đã gắn kháng thể đặc hiệu chống FDP, nếu có hiện tượng ngưng kết, nghĩa là trong huyết thanh FDP.
II. CHỈ ĐỊNH
Những trường hợp nghi ngờ đông máu rải rác trong lòng mạch (DIC), tiêu sợi huyết tiên phát, nghi ngờ huyết khối...
III. CHỐNG CHỈ ĐỊNH
Không có chống chỉ định.
IV. CHUẨN BỊ
1. Người thực hiện
- 01 kỹ thuật viên xét nghiệm.
- 01 bác sĩ nhận định kết quả xét nghiệm.
2. Phương tiện - hóa chất
- Tủ lạnh.
- Máy ly tâm.
- Đồng hồ bấm giây.
- Bơm tiêm nhựa lấy máu.
- Bông cồn sát trùng, dây ga-rô.
- Ống nghiệm tan máu kích thước 75x9,5mm.
- Pipet 100ml, 1.000ml.
- Bộ kit định lượng FDP, bao gồm: đệm, latex gắn kháng thể kháng FDP, chứng dương, chứng âm.
3. Người bệnh
Không cần chuẩn bị gì đặc biệt.
4. Phiếu xét nghiệm
Chỉ định xét nghiệm được ghi rõ trong bệnh án; Giấy chỉ định xét nghiệm ghi đầy đủ thông tin về người bệnh: họ tên, tuổi, giường bệnh, khoa phòng, chẩn đoán...
V. CÁC BƯỚC TIẾN HÀNH
Ga-rô, sát trùng, lấy khoảng 2- 3ml máu tĩnh mạch, cho vào ống nghiệm có sẵn 10mg chất ức chế acid amino caproic (hoặc chất ức chế Kuniet).
- Để ở bình cách thủy 370C trong 3 giờ.
- Quay ly tâm 3.000 vòng /phút x 10 phút, tách lấy huyết thanh.
- Pha loãng huyết thanh 1/5, 1/20 với đệm glyxin có trong bộ kít.
- Lấy một giọt hỗn dịch ở mỗi độ pha loãng của huyết thanh nhỏ vào phiến kính với một giọt dịch treo latex. Lắc phiến kính nhẹ nhàng cho đến khi nhìn thấy ngưng kết các hạt latex bằng mắt thường (thời gian không quá 2 phút).
VI. NHẬN ĐỊNH KẾT QUẢ
Nếu xuất hiện ngưng kết ở độ pha loãng1/5 thì lượng FDP trong huyết thanh không quá 10mg/ml, nếu ngưng kết ở độ pha loãng 1/20 thì lượng FDP trong huyết thanh không quá 40mg/ml.
Định lượng FDP trên máy đông máu tự động: hiện nay ít máy động máu tự động cài đặt chương trình định lượng FDP.
- Ghi kết quả nồng độ FDP huyết thanh vào giấy xét nghiệm.
- Điền đầy đủ ngày, tháng năm và bác sĩ xét nghiệm ký tên.
I. NGUYÊN LÝ
Heparin trọng lượng phân tử thấp là thuốc chống đông máu được sử dụng khá rộng rãi trong điều trị và dự phòng huyết khối. Đánh giá nồng độ heparin trọng lượng phân tử thấp trong máu bằng cách đo hoạt tính của anti Xa là một phương pháp đang được áp dụng rộng rãi.
II. CHỈ ĐỊNH
Những trường hợp điều trị heparin trọng lượng phân tử thấp, nhất là những người bệnh có nguy cơ tai biến chảy máu cao như người già, béo bệu.
III. CHỐNG CHỈ ĐỊNH
Không có chống chỉ định.
IV. CHUẨN BỊ
1. Người thực hiện
- 01 kỹ thuật viên xét nghiệm.
- 01 bác sĩ xét nghiệm.
2. Phương tiện - hóa chất
- Tủ lạnh.
- Máy ly tâm.
- Bình cách thủy 370C/ máy đông máu bán tự động /tự động.
- Đồng hồ bấm giây.
- Bơm tiêm nhựa lấy máu.
- Bông cồn sát trùng, dây ga-rô.
- Ống nghiệm tan máu kích thước 75x9,5mm.
- Ống nghiệm plastic có chống đông natri citrat 3,2%.
- Pipet 100ml, 1.000ml.
- Bộ kit làm xét nghiệm, bao gồm:
+ R1: huyết tương cơ chất.
+ R2: yếu tố Xa bò.
+ R3: phospholipid, canxi. Tất cả đều được đông khô.
3. Người bệnh
Không cần chuẩn bị gì đặc biệt.
4. Phiếu xét nghiệm
Chỉ định xét nghiệm được ghi rõ trong bệnh án; Giấy chỉ định xét nghiệm ghi đầy đủ thông tin về người bệnh: họ tên, tuổi, giường bệnh, khoa phòng, chẩn đoán.
V. CÁC BƯỚC TIẾN HÀNH
- Ga-rô, sát trùng, lấy khoảng 2ml máu tĩnh mạch.
- Trộn đều máu với chất chống đông citrat natri 3,2% theo tỷ lệ: 1 thể tích chống đông trộn với 9 thể tích máu.
- Ly tâm mạnh để thu huyết tương nghèo tiểu cầu.
- Phân phối 25ml huyết tương nghèo tiểu cầu cần kiểm tra vào ống nghiệm.
- Cho thêm 100ml R1.
- Trộn đều và ủ ở bình cách thủy 370C trong 60 giây.
- Cho thêm 100ml R2.
- Trộn đều và ủ ở bình cách thủy 370C trong 60 giây.
- Cho thêm 100ml R3; Ghi thời gian đông từ khi bắt đầu cho R3.
VI. NHẬN ĐỊNH KẾT QUẢ
- Sử dụng đường thẳng chuẩn để tính kết quả.
- Ghi kết quả đơn vị trong 1ml huyết tương vào giấy xét nghiệm.
- Điền đầy đủ ngày, tháng, năm và bác sĩ xét nghiệm ký tên.
DI TRUYỀN - MIỄN DỊCH HUYẾT HỌC
XÉT NGHIỆM CÔNG THỨC NHIỄM SẮC THỂ TỦY XƯƠNG
I. NGUYÊN LÝ
Bình thường ở tủy xương, các tế bào sinh máu vẫn liên tục tăng sinh và trưởng thành do vậy quá trình phân chia tế bào xảy ra một cách tự nhiên. Dựa vào tính chất này có thể làm tiêu bản tế bào nhiễm sắc thể tủy xương trực tiếp hoặc sau nuôi cấy trong môi trường nhân tạo bằng cách ức chế phân bào ở giai đoạn kỳ giữa và phá vỡ tế bào, sau đó làm tiêu bản và phân tích các bất thường nhiễm sắc thể.
II. CHỈ ĐỊNH
Người bệnh mang bệnh lý huyết học cần khảo sát các rối loạn về nhiễm sắc thể.
III. CHỐNG CHỈ ĐỊNH
Không có chống chỉ định.
IV. CHUẨN BỊ
1. Phương tiện - hóa chất
- Máy ly tâm, hệ thống kính và phần mềm phân tích kết quả.
- Ống falcon 50ml vô trùng.
- Chai nuôi cấy vô trùng.
- Lam kính.
- Ống falcon 15ml.
- Ống tan huyết.
- Pipet pasteur.
- Typ Effpendoff.
- Heparin 5.000UI/ml.
- Môi trường nuôi cấy: 90ml RPMI 1640 + L-Glutamin + 10ml huyết thanh bào thai bê +100ml kháng sinh + 50ml dung dịch NaOH.
- Dung dịch colcemid 0,010/00 (10ml/ml).
- Dung dịch nhược trương: KCl 0,075M (PH=7,4). (8ml/1 mẫu).
- Dung dịch đếm bạch cầu.
- Dung dịch cố định:
+ Dung dịch Cornoy: 3 Metanol: 1 acid acetic
+ Dung dịch Cornoy: 2 Metanol: 1 acid acetic
Dung dịch cố định pha 10ml/ 1 mẫu
- Dung dịch NaHCO3 7,5% (dùng để chỉnh pH)
- Kháng sinh: Streptomicin + Penicilin (100ml/ 100ml môi trường).
2. Bệnh phẩm
Dịch tủy được chống đông bằng heparin 5.000 UI/ml.
V. CÁC BƯỚC TIẾN HÀNH
- Lấy 2ml dịch tủy vào bơm tiêm đã tráng heparin 5.000 UI/ml.
- Cho tủy vào ống nghiệm vô trùng có chứa 3ml môi trường nuôi cấy, trộn đều và đếm tế bào tủy trong hỗn dịch.
- Ly tâm 1.000 vòng /5 phút lấy cặn phía dưới để tách bỏ độc chất và các phần mỡ lơ lửng phía trên.
- Mỗi chai nuôi cấy ghi tên người bệnh, số thứ tự của khoa, ngày cấy, ngày thu hoạch.
- Trong mỗi lọ cấy cho:
+ 10ml môi trường nuôi cấy.
+ Lượng hỗn dịch tủy chứa từ 1-4 x106 tế bào/ml. Lắc nhẹ lọ cấy và để tủ ấm 370C trong 24 giờ.
- Sau 24 giờ cho vào mỗi lọ 50ml dung dịch colcemid (10ml/ml) lại để tủ ấm tiếp 20 phút.
- Sau khi ủ 20 phút chuyển toàn bộ hỗn dịch ở lọ cấy vào ống falcon 15ml, ly tâm ở máy ly tâm roto văng 1000 vòng /phút x 8 phút.
- Sau khi ly tâm hút bỏ phần dịch trong ở trên, để lại cặn tế bào (chỉ hút đến cách mặt trên cặn tế bào khoảng 5mm).
- Cho thêm vào ống ly tâm 9ml dung dịch nhược trương đã để ấm 370C trước, trộn nhẹ một vài lần rồi ủ ở bể ấm 370C trong 18 phút.
- Sau khi ủ 18 phút cho thêm vào mỗi ống 1ml dung dịch Carnoy, trộn nhẹ để 1 phút.
- Lấy ống ra ly tâm lấy cặn như trên. Sau khi hút bỏ dung dịch trong phía trên cho thêm vào mỗi ống 10ml dung dịch Carnoy, trộn đều để ở nhiệt độ phòng trong 10 phút.
- Ly tâm và hút bỏ phần trên rồi thêm 10ml dung dịch Carnoy, trộn đều để ở nhiệt độ phòng trong 10 phút.
- Lặp lại bước rửa trên.
- Các lam kính sạch rửa sạch ngâm qua nước cất, ngâm lại vào cồn 1000, chuyển sang ngâm nước cất để lên giá lam cho khô.
- Đặt giá lam vào ngăn đá tủ lạnh khoảng 10 phút, sau đó lấy ra để nghiêng 20-300 trên giấy thấm.
- Ly tâm hút bỏ dung dịch trong phía trên, tái huyền dịch và lấy hỗn dịch cặn này nhỏ lên lam kính. Chú ý khi nhỏ tiêu bản để đầu pipet cao hơn mặt phiến kính từ 10-20cm.
- Để tiêu bản khô tự nhiên và tiến hành nhuộm Giemsa hoặc các kỹ thuật nhuộm khác.
Lưu ý: Trong trường hợp còn huyền dịch thì lưu vào ống effendoff để kiểm tra hoặc nhỏ lại lam kính khi cần.
VI. NHẬN ĐỊNH KẾT QUẢ
Các biến loạn số lượng và cấu trúc được đánh giá:
- Thừa nhiễm sắc thể (Trisomie): có từ 2 cụm phân bào trở lên thừa cùng 1 nhiễm sắc thể.
- Thiếu nhiễm sắc thể (Monosomie): có từ 3 cụm phân bào trở lên thiếu cùng 1 nhiễm sắc thể.
- Biến loạn cấu trúc: có từ 3 cụm trở lên mang cùng 1 biến loạn.
ĐẾM SỐ LƯỢNG TẾ BÀO GỐC TẠO MÁU TRÊN MÁY CYTOMICS FC-500
I. NGUYÊN LÝ
Tế bào gốc đầu dòng tạo máu có kích thước tương tự lympho, độ phức tạp nhân và bào tương thấp, có biểu hiện CD34+, bắt màu nhạt với CD45. Đồng thời đây cũng là các tế bào có số lượng rất ít trong dịch hút tủy xương. Đếm tế bào gốc tạo máu CD34 được thực hiện trên máy Cytomics FC-500, với chương trình CPX-Stem và sinh phẩm Stem kit của Beckman Coulter, dựa trên nguyên lý đếm sự kiện hiếm theo hướng dẫn của ISHAGE, có sử dụng hạt huỳnh quang tham chiếm.
II. CHỈ ĐỊNH
- Kiểm tra số lượng tế bào gốc trong máu ngoại vi sau dùng thuốc huy động tế bào gốc.
- Kiểm tra số lượng tế bào gốc trong túi tách chiết tế bào gốc từ máu ngoại vi, tủy xương, hoặc máu cuống rốn.
- Kiếm tra số lượng và tỷ lệ tế bào gốc sống trong mẫu lưu trữ sau rã đông.
III. CHỐNG CHỈ ĐỊNH
Không có chống chỉ định.
IV. CHUẨN BỊ
1. Phương tiện - hóa chất
- Máy Flow cytometry Cytomics FC-500 của Beckman Coulter.
- Máy votex.
- Pipetman và typ dùng được cho 20ul, 100ul, 1000ul.
- Typ nhựa 120x70mm tráng silicon.
- Kít Stem kit gồm: 1 lọ CD34-PE/CD45-FITC, 1 lọ Control-PE/CD45-FITC, 1 lọ 7AAD, 1 lọ stem count, 2 lọ dung dịch ly giải hồng cầu đậm đặc 10X.
- Hóa chất: dung dịch PBS (Phosphat Buffer Salin) (tự pha), dung dịch Flow Sheath (mua của hãng).
- Găng tay, giấy thấm...
2. Bệnh phẩm
- Mẫu dùng là máu toàn phần hoặc dịch hút tủy xương được lấy vào ống chứa chất chống đông EDTA. Mẫu cũng có thể là hoặc dịch lấy từ túi tế bào sau gạn tách, chống đông ACD.
- Mẫu dùng cho xét nghiệm phải sớm trong vòng 6 tiếng, bảo quản ở nhiệt độ phòng.
V. CÁC BƯỚC TIẾN HÀNH
1. Chuẩn bị mẫu
- Đếm số lượng bạch cầu có trong mẫu bệnh phẩm.
- Pha loãng bệnh phẩm bằng dung dịch PBS để đạt nồng độ bạch cầu 15 G/l.
A = Số lượng bạch cầu/10 (A: số lần pha loãng bệnh phẩm, dilute factor).
- Pha dung dịch Lysing 1X: tùy theo số lượng mẫu, tính thể tích dung dịch lysing 1X cần thiết, 1 mẫu cần 6ml lysing 1X. Pha lysing 1X bằng cách:
Thể tích lysing 10X + 9 thể tích nước cất
2. Ủ mẫu với kháng thể
Chuẩn bị 3 typ, đánh số từ #1, #2 và Control.
- Lần lượt cho các kháng thể CD34/CD45, CD45/control và 7AAD vào các ống theo bảng sau:
|
| CD34/CD45 | CD45/control | 7AAD |
| # 1 | 20ml |
| 20ml |
| # 2 | 20ml |
| 20ml |
| Control |
| 20ml | 20ml |
- Nhỏ vào mỗi ống 100ml bệnh phẩm đã pha loãng, vortex đều.
- Ủ 20 phút ở nhiệt độ phòng.
- Thêm 2ml dung dịch Lysing 1X vào mỗi ống, ủ 10 phút ở nhiệt độ phòng.
- Lắc đều lọ Stem count (tránh tạo bọt khi lắc).
- Thêm 100ul hạt Stem count vào cả 3 ống ngay trước khi đếm.
- Đem đọc kết quả bằng chương trình đếm tế bào gốc thương mại đi theo máy (Stem Assay panel).
3. Thao tác trên máy Cytomics FC500
- Kiểm tra bình dung dịch chạy máy, dung dịch rửa máy, dung dịch chất nước thải. Bổ sung dung dịch hoặc đổ bỏ nước thải nếu cần thiết.
- Kiểm tra bật nguồn điện qua ắc quy, bật điện bộ nguồn laser, bật máy tính và máy Cytomics FC500.
- Vào chương trình CXP, chọn tên người làm thí nghiệm, nhập mã đăng nhập. Đợi máy ổn định (khoảng 20 phút).
- Hiển thị các cửa số điều khiển.
- Chọn: Panel ® Common ® Stem ® Assay ® kéo chương trình xuống cửa sổ phía dưới.
- Nhập thông tin bệnh phẩm:
+ Carousel: nhập mã số 1 hoặc 2 tùy theo mẫu được để vào khay 1 hay khay 2.
+ Possition: là vị trí đặt các typ #1, #2 và Control trên Carousel.
+ ID1: họ tên người bệnh.
+ ID2: test 1 ứng với #1, test 2 ứng với #2, control ứng với Control.
+ Factor: nhập số hạt ghi trên lọ Stem count XXX cells/uL.
- Nhập bảng Report:
+ ID1: copy từ ID 1 ở trên.
+ Last name: Nhập tên người bệnh.
+ Date: nhập tháng /ngày/năm.
+ Physician: nhập tên bác sĩ chỉ định.
+ Sample: nhập loại bệnh phẩm có thể chọn Whole Blood (máu toàn phần), Apheresis(dịch gạn tách), Cord (máu cuống rốn), Bone Marrow(dịch tủy xương).
+ WBC: nhập số lượng bạch cầu (x109).
+ Dilution factor: nhập tỷ lệ pha loãng đã tính khi pha loãng ban đầu.
+ Save ® đóng lại phần nhập report.
- Phân tích mẫu:
+ Nhấn biểu tượng tam giác (Play) trên bảng điều khiển để phân tích mẫu.
+ Quan sát các đồ thị, các ô hiển thị tốc độ phân tích để kịp thời xử lý khi có diễn biến bất thường.
VI. NHẬN ĐỊNH KẾT QUẢ
- Xuất kết quả
Mở bảng Report ® tìm đến mục report ® nhập ID1 hoặc Last name ® tìm đến người bệnh cần chọn. Slect ® kích đúp vào dòng thông tin ® Print.
- Rửa máy và tắt máy theo quy trình quy định.
- Nếu kết quả mẫu #1 và #2 không lệch nhau quá 15% ® thao tác tốt.
- Nếu kết quả mẫu #1 và #2 lệch quá 15% ® thao tác không tốt, nếu lệch quá phải chạy lại.
- Chú ý quan sát kết quả chạy, nếu đồ thị biểu hiện hạt tham chiếu theo thời gian không ổn định ® rửa máy, tắt máy, kiểm tra đầy đủ dịch, nước thải rồi chạy lại.
ĐỊNH LƯỢNG VIRUT CYTOMEGALO (CMV) BẰNG KỸ THUẬT REAL -TIME PCR
I. NGUYÊN LÝ
Sử dụng kỹ thuật PCR (Polymer Chain Reaction) để nhân bản một đoạn gen đặc trưng của virut CMV (Cytomegalovirus) kết hợp với việc bổ sung taqman probe là một chất phát huỳnh quang vào phản ứng PCR. Dựa vào sự kiểm soát số lượng huỳnh quang tiêu tốn trong phản ứng cùng với các chuẩn AND-CMV đã biết trước nồng độ, phần mềm của hệ thống sẽ tính toán và đếm được số lượng bản sao virut CMV ban đầu có trong mẫu bệnh phẩm.
II. CHỈ ĐỊNH
Xét nghiệm này dùng để phát hiện/định lượng CMV trong các mẫu máu người bị nghi ngờ nhiễm CMV.
Chỉ định để chẩn đoán nguyên nhân gây bệnh (với người bệnh sau ghép cơ quan). Chỉ định để sàng lọc nguy cơ mang mầm bệnh trên người cho cơ quan trong ghép tạng.
III. CHỐNG CHỈ ĐỊNH
Không có chống chỉ định.
IV. CHUẨN BỊ
1. Phương tiện - hóa chất
- Kit tách ADN của hãng Qiagen gồm: buffer AL, Wash I, Wash II, proteinase K, cột lọc.
- Kit định lượng CMV của Nam Khoa gồm: 3 standar 103, 104,105, CMV mix, HBG mix, IC control, chứng trắng.
- Máy ly tâm eppendoft.
- Máy ủ nhiệt.
- Máy vortex.
- Box vô trùng.
- Đầu côn 1ml, 200ml, 20ml vô trùng, free-nuclease.
- Ống eppendoft 1,5ml, 0,2ml vô trùng, free-nuclease.
- Pipetman 1ml, 200ml, 20ml.
2. Bệnh phẩm
2ml máu toàn phần đựng trong ống chống đông EDTA.
V. CÁC BƯỚC TIẾN HÀNH
1. Tách ADN
- Quan sát, đối chiếu cẩn thận tên trên ống máu và giấy xét nghiệm.
- Dùng pipet hút 200ml máu vào một eppendoft vô trùng.
- Bổ sung 20ml proteinase K, trộn nhẹ nhàng bằng hút đẩy.
- Thêm 200ml dung dịch AL, vortex 10 giây.
- Ủ 560C trong 10 phút.
- Thêm 200ml cồn 960, lắc ngược nhẹ nhàng, không được vortex.
- Chuyển hết dịch trong eppendoft sang cột lọc.
- Ly tâm cột ở 10.000 vòng/phút trong 1 phút.
- Đổ bỏ hoàn toàn dịch ly tâm ở typ 2ml dưới cột lọc.
- Thêm 500ml dung dịch rửa AW1 vào cột lọc.
- Ly tâm cột ở 10.000 vòng/phút trong 1 phút.
- Đổ bỏ hoàn toàn dịch ly tâm ở typ 2ml dưới cột lọc.
- Thêm 500ml dung dịch rửa AW2 vào cột lọc.
- Ly tâm cột ở 10.000 vòng/phút trong 1 phút.
- Đổ bỏ hoàn toàn dịch ly tâm ở typ 2ml dưới cột lọc.
- Đăt cột lọc lên trên ống 2ml mới.
- Ly tâm cột lọc ở 14.000 vòng/phút trong 1 phút.
- Đặt cột lên ống eppendoft mới đã ghi tên người bệnh.
- Nhỏ 100ml nước vô trùng vào chính giữa cột lọc.
- Ly tâm cột ở 14.000 vòng/phút trong 1 phút.
- Thu dịch ADN trong ống eppendoft.
- Bảo quản -200 nếu chưa sử dụng ngay.
2. Thực hiện phản ứng Real-time PCR
- Đưa các thành phần của kit định lượng ra nhiệt độ phòng 10 phút để rã đông hoàn toàn.
- Trộn kỹ bằng vortex các ống standar 103,104,105, IC control.
- Trộn nhẹ nhàng bằng lắc ngược các ống CMV-mix, HBG mix.
- Lấy 7 ống eppendoft 0,2ml đánh số thứ tự S1, S2, S3, Nev-HBG, Ne-CMV, BN-HBG, BN- CMV.
- Nhỏ 5ml standar các nồng độ 103, 104, 105 tương ứng vào các ống S1, S2, S3.
- Nhỏ 5ml IC control vào các ống Nev-HBG, Ne-CMV, BN-HBG, BN- CMV.
- Nhỏ 5ml chứng trắng vào các ống Nev-HBG, Ne-CMV.
- Nhỏ 5ml AND của người bệnh cần xét nghiệm vào các ống BN-HBG, BN- CMV.
- Nhỏ 20ml HBG-mix vào các ống Nev-HBG, BN-HBG.
- Nhỏ 20ml CMV-mix vào các ống S1, S2, S3, Ne-CMV, BN- CMV.
- Trộn nhẹ nhàng tất cả các ống trên bằng tay.
- Spin down 10 giây.
- Đặt các ống vào máy Real-time PCR CFX 96 và cài đạt sơ đồ giếng theo đúng thứ tự đặt trên máy.
- Chọn chương trình nhiệt CMV protocol.
- Chọn nơi lưu kết quả trong CMV result.
- Bấm start để máy chạy.
Chương trình chạy sẽ kết thúc sau 1giờ 40 phút.
VI. NHẬN ĐỊNH KẾT QUẢ
Kết quả của phản ứng Real-time PCR sẽ hiển thị lên màn hình khi kết thúc chương trình chạy:
- Nếu mẫu âm tính, thì trả kết quả là âm tính kèm với hình ảnh chạy và ghi chú ở dưới là “Ngưỡng phát hiện 102 copies /ml máu”.
- Nếu mẫu dương tính thì lấy số lượng virut trong ô kết quả ở màn hình máy tính nhân với 50 (độ pha loãng) và trả kết quả bằng hình ảnh chạy kèm theo số lượng virut tính được sau khi đã nhân với độ pha loãng.
PHÁT HIỆN ĐỘT BIẾN INTRON18/BCLI BẰNG KỸ THUẬT PCR - RFLP
I. NGUYÊN LÝ
Sử dụng kỹ thuật PCR để nhân bản đoạn gen vùng intron 18 sau đó kết hợp với kỹ thuật RFLP (Restriction Fragment Length Polymorphism) để phân tích đoạn gen này sau khi cắt với enzym Bcl I. Phát hiện người mang gen đột biến hay không mang đột biến intron18 /Bcl I thông qua việc quan sát sự hoạt động hay không hoạt động của enzym này trên từng mẫu bệnh phẩm.
II. CHỈ ĐỊNH
- Chỉ định để chẩn đoán di truyền cho người bệnh hemophilia A.
- Chỉ định để sàng lọc người mang gen bệnh hemophilia A.
III. CHỐNG CHỈ ĐỊNH
Không có chống chỉ định.
IV. CHUẨN BỊ
1. Phương tiện - hóa chất
- Kit tách ADN của hãng Qiagen gồm: buffer AL, AW1, AW2, proteinase K, cột lọc.
- PCR supermix, cặp mồi 18F và 18R, enzym BclI, buffer 3, dH20, agarose, Ethidium Bromid, đệm TBE 10X của Invitrogen.
- Máy ly tâm eppendoft.
- Bể ổn nhiệt 560C.
- Máy ủ nhiệt.
- Máy vortex.
- Box vô trùng.
- Đầu côn 1ml, 200ml, 20ml vô trùng, free-nuclease.
- Ống eppendoft 1,5ml, 0,2ml vô trùng, free-nuclease.
- Pipetman 1ml, 200ml, 20ml.
2. Bệnh phẩm
2ml máu toàn phần đựng trong ống chống đông EDTA.
V. CÁC BƯỚC TIẾN HÀNH
1. Tách ADN
- Quan sát, đối chiếu cẩn thận tên trên ống máu và giấy xét nghiệm.
- Dùng pipet hút 200ml máu vào một eppendoft vô trùng.
- Bổ sung 20ml proteinase K, trộn nhẹ nhàng bằng hút đẩy.
- Thêm 200ml dung dịch AL, vortex 10 giây.
- Ủ 560C trong 10 phút.
- Thêm 200ml cồn 960, lắc ngược nhẹ nhàng, không được vortex.
- Chuyển hết dịch trong eppendoft sang cột lọc.
- Ly tâm cột ở 10.000 vòng/phút trong 1 phút.
- Đổ bỏ hoàn toàn dịch ly tâm ở typ 2ml dưới cột lọc.
- Thêm 500ml dung dịch rửa AW1 vào cột lọc.
- Ly tâm cột ở 10.000 vòng/phút trong 1 phút.
- Đổ bỏ hoàn toàn dịch ly tâm ở typ 2ml dưới cột lọc.
- Thêm 500ml dung dịch rửa AW2 vào cột lọc.
- Ly tâm cột ở 10.000 vòng/phút trong 1 phút.
- Đổ bỏ hoàn toàn dịch ly tâm ở typ 2ml dưới cột lọc.
- Đặt cột lọc lên trên ống 2ml mới.
- Ly tâm cột lọc ở 14.000 vòng/phút trong 1 phút.
- Đặt cột lên ống eppendoft mới đã ghi tên người bệnh.
- Nhỏ 100ml nước vô trùng vào chính giữa cột lọc.
- Ly tâm cột ở 14.000 vòng/phút trong 1 phút.
- Thu dịch ADN trong ống eppendoft.
- Bảo quản -200 nếu chưa sử dụng ngay.
2. Thực hiện phản ứng PCR - RFLP
2.1. Phản ứng PCR
- Đưa các thành phần của phản ứng PCR gồm PCR supermix và cặp mồi 18F, 18R ra nhiệt độ phòng 10 phút để rã đông hoàn toàn.
- Trộn nhẹ nhàng bằng lắc ngược các ống PCR supermix và cặp mồi 18F, 18R.
- Lấy 3 ống eppendoft 0,2ml ký hiệu Nev (đối chứng âm), Pos (đối chứng dương), BN (người bệnh).
- Lấy lần lượt các thành phần sau vào mỗi ống eppendoft đã ghi ký hiệu:
+ PCR super mix: 22,5ml
+ 18F: 1ml
+ 18R: 1ml
+ dH20: 2,5ml
- Nhỏ 3ml positive control vào ống ký hiệu Pos.
- Nhỏ 3ml negative control vào ống ký hiệu Nev.
- Nhỏ 3ml AND người bệnh cần xét nghiệm vào ống ký hiệu BN.
- Trộn nhẹ nhàng tất cả các ống trên bằng tay.
- Spin down 10 giây.
- Đặt các ống vào máy PCR C1000.
- Chọn chương trình nhiệt Hemo.
- Bấm start để máy chạy.
- Chương trình chạy sẽ kết thúc sau 2 giờ 40 phút.
2.2. Điện di kiểm tra sản phẩm PCR
Sau khi kết thúc chương trình PCR phải điện di sản phẩm PCR trên gel agarose 2% để trước khi cắt với enzym.
2.2.1. Quy trình đổ gel
- Cân 1 gam agarose chi vào bình Pyrex.
- Thêm 100ml đệm TBE 1X vào bình, lắc đều.
- Đun mỗi lần 1 phút trong lò vi sóng đến khi agarose tan hoàn toàn.
- Để ấm đến 600 rồi đổ vào khay đã cắm lược.
- Để RT 30 phút để thạch đông rồi mới rút lược ra.
2.2.2. Điện di
- Lấy 5ml sản phẩm PCR + 1ml loading dye 10X + 4ml dH20.
- Trộn đều và nhỏ vào các giếng theo thứ tự.
- Nhỏ 3ml marker AND 100bp vào giếng kế tiếp.
- Đặt bản gel vào máy điện di.
- Đổ đệm TBE 1X ngập bản gel và chạy ở 100 vòng trong 20 phút.
- Nhuộm bản gel với dung dịch ethidium bromid trong 5 phút.
- Quan sát bản gel dưới đèn UV, nếu thấy các mẫu bệnh phẩm có băng AND 142 bp thì tiếp tục thực hiện phản ứng RFLP, nếu không có thì lặp lại xét nghiệm PCR.
2.3. Phản ứng RFLP
- Lấy lần lượt các thành phần sau vào ống eppendoft 0,2ml đã ghi tên người bệnh:
+ Buffer 3: 3ml
+ SP PCR: 25ml
+ Bcl I: 2ml
- Trộn đều bằng pipet, spin down.
- Ủ 560, 16giờ.
Điện di sản phẩm cắt này trên gel agarose 2%.
VI. NHẬN ĐỊNH KẾT QUẢ
- Nếu mẫu người bệnh là nam giới sau phản ứng PCR-RFLP có 2 băng AND 99 bp và 43 bp thì kết luận âm tính.
- Nếu mẫu người bệnh là nam giới sau phản ứng PCR-RFLP có 1 băng AND 142 bp thì kết luận dương tính.
- Nếu mẫu người bệnh là nữ giới sau phản ứng PCR-RFLP có 2 băng AND 99 bp và 43 bp thì kết luận âm tính đồng hợp tử.
- Nếu mẫu người bệnh là nữ giới sau phản ứng PCR-RFLP có 3 băng AND là 142bp, 99 bp và 43 bp thì kết luận dương tính dị hợp tử.
PHÁT HIỆN ĐẢO ĐOẠN INTRON 22 CỦA GEN YẾU TỐ VIII BỆNH HEMOPHILIA A BẰNG KỸ THUẬT LONGRANGE - PCR
I. NGUYÊN LÝ
Kỹ thuật longrange PCR (LR-PCR) dựa vào việc trộn hai loại enzym AND polymerase chịu nhiệt, thường là Taq polymerase có hoạt lực cao tổng hợp đầu 5’-3’ và một enzym khác hoạt động tổng hợp đầu 3’-5’ (thường là Pwo). Sự kết hợp này cho phép primer có kích thước lớn được duỗi ra hơn là chỉ sử dụng một mình Taq. Do đó nó cho phép khuếch đại một đoạn gen lớn và tạo ra sản phẩm PCR có kích thước lớn hơn nhiều so với sản phẩm PCR thông thường, sản phẩm LR-PCR thường có kích thước từ 10-12kb.
II. CHỈ ĐỊNH
- Người bệnh được chẩn đoán là hemophilia A thể nặng và thể trung bình.
- Người phụ nữ có liên quan (chị, em gái, mẹ, dì) đến những người bệnh trên.
III. CHỐNG CHỈ ĐỊNH
Không có chống chỉ định.
IV. CHUẨN BỊ
1. Người thực hiện
Kỹ thuật viên phòng sinh học phân tử.
2. Phương tiện - hóa chất
2.1. Hóa chất, sinh phẩm
- Primer
| P | 5’ GCCCTGCCTGTCCATTACACTGATGACATTATGCTGAC3’ (38-mer) |
| Q | 5’ GGCCCTACAACCATTCTGCCTTTCACTTTCAGTGCAATA 3’(3- mer) |
| A | 5’ CACAAGGGGGAAGAGTGTGAGGGTGTGGGATAAGAA 3’ (36-mer) |
| B | 5’ CCCCAAACTATAACCAGCACCTTGAACTTCCCCTCTCATA 3’ (40-mer) |
Giữ stock 100pmoles/ml trong -200C
Working primer: 10 pmoles/ml trong 2-80C.
Kit LongRange PCR (Quiagen, Cat No: 206402 gồm 10X Longrange PCR buffer và Enzyme mix (5U/ml)).
- MgCl2 (25mM)
- dNTPs (2.5mM)
- 7-dease-dGTP (Roche; Cat No: 10 988 537 001)
- DNA markers (l DNA marker/ Hind III(Gibco))
- 5X TBE buffer (bổ sung tên Cat No)
- Ethidium bromid (10mg/ml(Sigma))
- Nước cất không DNA hoặc RNA.
- 6X loading dye
- DMSO (Sigma)
- Máy PCR C1000, Bio- Rad
- Hệ thống điện di CC9918
- Hệ thống điện di Maxfill 3001251
- Hệ thống đọc gel HU 25
- Pipetman (p10, p20, p100)
- Máy ly tâm
- Lò vi sóng
- Hốt vô trùng
- Ống chống đông EDTA 2ml
- Typ ependoff 1,5ml; 0,5ml
3. Bệnh phẩm
- Mẫu AND của người bệnh đã được đo OD.
- Mẫu chứng có 4 ống: 2 chứng dương (1 mẫu người bệnh, 1 mẫu người phụ nữ mang gen bệnh), 1 chứng âm, 1 mẫu nước cất.
V. CÁC BƯỚC TIẾN HÀNH
1. Pha 2 master mix PCR trong hốt ở tại phòng tiền PCR theo worksheet
1.1. Master mix1 (MM1)
| dATP (10mM) | 1,25ml |
| dCTP (10mM) | 1,25ml |
| dTTP (10mM) | 1,25ml |
| dGTP (10mM) | 0,625ml |
| 7-dease-dGTP (10mM) | 0,625ml |
| Oligo-P (10pmoles/) | 0,5ml |
| Oligo-Q (10pmoles/) | 0,5ml |
| Oligo-A (10pmoles/) | 0,2ml |
| Oligo-B (10pmoles/) | 0,2ml |
| 10X buffer | 2,0ml |
| DMSO | 0,4ml |
1.2. Master mix 2 (MM2)
| Longrange PCR enzym mix (5UI/ml) | 0,5ml |
| 10X longrange PCR buffer | 0,5ml |
| Nước cất | 4,0ml |
2. Mix mẫu phản ứng
- Cho 8,8ml MM1 vào ống 0,2ml PCR.
- Thêm nước, 10-20ng AND mẫu và chứng (cho đủ tổng số 20ml).
- Mang mẫu và MM2 tới phòng chạy PCR (đặt MM2 trên đá).
- Chạy PCR.
Đặt ống phản ứng vào máy PCR, ấn start đợi khi máy đã chạy xong chu kỳ biến tính lần đầu ở 950C/ 30s. Ấn “Pause”.
+ Thêm 5ml MM2 vào mỗi ống và trộn đều bằng pipet. Ấn “Resum”.
![]() + Điện di kiểm tra sản phẩm (hoặc cất vào tủ lạnh tới khi điện di).
+ Điện di kiểm tra sản phẩm (hoặc cất vào tủ lạnh tới khi điện di).
3. Điện di kiểm tra sản phẩm
- Đổ gel 1,5g agarose trong 300ml 0,5XTBE buffer. Thêm 12ml ethidium bromid (10mg/ml) vào 300ml agarose.
- Thêm 1/6 thể tích của 6X loading dye vào mỗi giếng của khay Terasaki (dùng để trộn mẫu điện di).
- Lấy 10ml sản phẩm cho vào mỗi giếng có sẵn loading dye trộn kỹ, nhỏ vào giếng gel.
- Nhỏ 5ml marker vào giếng đầu tiên của bản gel.
- Chạy điện di 90volt/1 giờ, kiểm tra băng, nếu có chạy tiếp ít nhất 12 giờ (có thể chạy tới 21 giờ). Nếu không thấy có băng dừng chạy làm lại phản ứng PCR.
- Chụp ảnh gel, in ảnh và dán vào worksheet.
VI. NHẬN ĐỊNH KẾT QUẢ
Sản phẩm được đọc trên bản gel có 3 kích thước là 10kb, 11kb, 12kb.
Cụ thể:
- Mẫu không có đảo đoạn sẽ có 02band: 10kb, 12kb.
- Mẫu có đột biến đảo đoạn nếu đồng hợp tử có 02 band: 10, 11 nếu dị hợp tử có 03 band 10,11,12kb.
XÉT NGHIỆM ĐỊNH TYP HLA BẰNG KỸ THUẬT SINH HỌC PHÂN TỬ
I. NGUYÊN LÝ
Kỹ thuật SSP dựa trên ứng dụng kỹ thuật PCR. Với việc tổng hợp nên các đoạn ADN đặc trưng từ 1 đoạn ADN khuôn bằng các cặp mồi đặc hiệu. Thông qua phần mềm phân tích để xác định nhóm HLA cho từng cá thể.
II. CHỈ ĐỊNH
- Người bệnh chờ ghép tủy xương, ghép tạng đồng loại.
- Người hiến tạng, hiến tủy xương.
III. CHỐNG CHỈ ĐỊNH
Không có chống chỉ định.
IV. CHUẨN BỊ
1. Người thực hiện
Bác sĩ, cử nhân, kỹ thuật viên đã được đào tạo thực hiện kỹ thuật.
2. Phương tiện - hóa chất
- Máy ly tâm lạnh cho eppendoff.
- Máy PCR.
- Máy điện di gel agarrose.
- Máy votex.
- Hệ thống soi gel bằng đèn cực tím.
- Hệ thống chụp ảnh gel sau điện di.
- Pipetman các loại: 1000ml, 200ml, 20ml.
- Pipet nhựa dùng 1 lần.
- Ống ependoff 1,5ml.
- Đầu côn có phin lọc loại 1000ml, 200ml, 20ml.
- Đầu côn không có phin lọc loại 200ml.
V. CÁC BƯỚC TIẾN HÀNH
1. Kiểm tra hồ sơ
Đối chiếu mẫu xét nghiệm với giấy chỉ định xét nghiệm.
2. Thực hiện kỹ thuật
- Lấy ống D-mix, phiến xét nghiệm, mẫu ADN ra khỏi tủ bảo quản, để tan đông ở nhiệt độ phòng.
- Lấy ống enzym Taq ra khỏi tủ âm và giữ trên đá cho đến khi sử dụng.
- Dùng pipet chuyển 120ml ADN và 7ml taq vào ống D-mix.
- Dùng máy votex để trộn đều hỗn hợp trên, sau đó ly tâm nhẹ để kéo toàn bộ hóa chất bám trên nắp ống xuống đáy.
- Chia vào từng giếng của phiến 10ml hỗn hợp trên.
- Dùng miếng giấy dán, dán kín toàn bộ phiến.
- Đặt phiến vào máy PCR.
- Chọn chương trình chạy PCR cho xét nghiệm HLA.
- Lấy phiến ra khỏi máy PCR sau khi chương trình chạy kết thúc.
- Điện di toàn bộ sản phẩm sau PCR trên thạch agarrose 2%.
- Điện di 10 phút ở hiệu điện thế 100V.
- Sau khi điện di, nhuộm bản gel với ethidium boromid.
- Rửa lại bản gel và xem kết quả điện di trên máy soi gel.
VI. NHẬN ĐỊNH KẾT QUẢ
- Chụp lại ảnh và phân tích kết quả bằng phần mềm onelambda.
- Đánh dấu vị trí của những băng đặc hiệu.
- Nhập lại những vị trí đó vào phần mềm phân tích kết quả.
- Sau khi phần mềm phân tích kết quả xong, in kết quả đã phân tích.
XÁC ĐỊNH GEN BỆNH MÁU BẰNG KỸ THUẬT RT - PCR
I. NGUYÊN LÝ
Dựa trên nguyên tắc nhân bản đoạn gen bằng các cặp mồi đặc hiệu.
II. CHỈ ĐỊNH
Áp dụng cho người bệnh có nghi ngờ bị bệnh máu hoặc những người bệnh có điều trị hóa chất.
III. CHỐNG CHỈ ĐỊNH
Không có chống chỉ định.
IV. CHUẨN BỊ
1. Người thực hiện
Bác sĩ, cử nhân, kỹ thuật viên xét nghiệm đã được đào tạo để thực hiện kỹ thuật.
2. Phương tiện - hóa chất
- Máy ly tâm lạnh cho eppendoff.
- Máy votex.
- Máy PCR.
- Máy điện di gel agarrose.
- Hệ thống soi gel bằng đèn cực tím.
- Hệ thống chụp ảnh gel sau điện di.
- Pipetman các loại: 1000ml, 200ml, 20ml.
- Ống ependoff 0,2ml.
- Đầu côn có phin lọc loại 1000ml, 200ml, 20ml.
- Đầu côn không có phin lọc loại 200ml.
V. CÁC BƯỚC TIẾN HÀNH
- Các thành phần của phản ứng RT-PCR được lấy ra trước 5 phút để tan đông hoàn toàn.
- ARN được tách từ tủy bằng kit của Qiagen.
- Lấy các thành phần cho phản ứng theo bảng sau:
| Tên hóa chất | Số lượng (ml) |
| Reaction mix | 25 |
| Taq platilum | 1 |
| Mồi xuôi | 1 |
| Mồi ngược | 1 |
| Nước | 19 |
| ARN | 3 |
- Sau khi lấy đầy đủ các thành phần như trên vào ống eppendoff 0,2ml, trộn đều hỗn hợp trên bằng máy votex.
- Đưa ống ependoff vào máy ly tâm để spin down.
- Đặt ống eppendoff vào máy PCR.
- Chạy PCR theo chương trình đã cài sẵn trên máy PCR.
- Sau khi PCR lấy ống eppendoff ra và chuẩn bị cho phản ứng PCR.
PCR
Lấy thành phần của phản ứng PCR ra trước 5 phút và để tan đông hoàn toàn. Lấy các thành phần theo bảng sau:
| Tên hóa chất | Số lượng (ml) |
| Super mix | 40 |
| Mồi xuôi | 1 |
| Mồi ngược | 1 |
| Nước | 5 |
| Sản phẩm RT-PCR | 3 |
- Sau khi trộn toàn bộ các thành phần trên bằng máy votex, đem ống eppendoff ly tâm để spin down.
- Đặt ống eppendoff vào máy PCR.
- Chạy PCR theo chương trình đã cài sẵn trên máy.
- Sau khi PCR lấy ống eppendoff đem điện di bằng thạch agarrose.
- Sau khi điện di kiểm tra kết quả bằng máy soi gel.
- Chụp ảnh và phân tích kết quả.
VI. NHẬN ĐỊNH KẾT QUẢ
- Kết quả là dương tính nếu sau khi điện di sản phẩm PCR có xuất hiện băng đặc hiệu.
- Kết quả là âm tính nếu sau khi điện di sản phẩm PCR không xuất hiện băng đặc hiệu.
KHÁNG THỂ KHÁNG NHÂN ANA (ANTINUCLEAR ANTIBODIES) BẰNG KỸ THUẬT ELISA
I. NGUYÊN LÝ
Các kháng nguyên tinh sạch được gắn sẵn vào giếng bao gồm: ds DNA, histones, SS-A/Ro, SS-B/La, Sm, SmRNP, Scl-70, Jo-1, centromere, và các kháng nguyên tách từ nhân HEp-2. Do đó các kháng thể của các kháng nguyên này nếu hiện diện trong huyết thanh sẽ gắn đặc hiệu vào các kháng thể trên giếng. Thực hiện bước rửa để loại bỏ các kháng thể không gắn đặc hiệu. Sau khi nhỏ dung dịch cộng hợp có chứa kháng thể kháng globulin miễn dịch người gắn với enzym horseradish peroxidase vào giếng, kháng thể này sẽ gắn với phức hợp trong giếng hình thành nên phức hợp sandwich: cộng hợp - kháng thể - kháng nguyên. Sau khi rửa, các cộng hợp không gắn với phức hợp sẽ bị loại bỏ, chỉ còn lại phức hợp sandwich trong giếng. Do vậy, khi nhỏ dung dịch cơ chất TMB substrate, enzym sẽ xúc tác tạo phản ứng tạo màu xanh da trời. Cuối cùng, dung dịch sẽ chuyển sang màu vàng khi nhỏ thêm dung dịch Stop solution. Kết quả được định lượng bằng máy đọc OD ở bước sóng 450nm.
II. CHUẨN BỊ
1. Phương tiện - hóa chất
1.1. Thành phần kít
- Quy trình sử dụng kít của BIORAD: REF 96AN-576AN-4250000, Autoimmune EIA ANA screening test.
- Thành phần kít bao gồm:
+ MPLT (ANA screening test microplate): plate 96 giếng, các kháng nhân của nhân tế bào được gắn sẵn vào các giếng và các giếng được bảo quản trong túi dán kín.
+ WSH-CONC (DNA wash concentrate 16.7X): thành phần dung dịch bao gồm đệm phosphate và Tween 20. Dung dịch sau khi pha loãng sẽ có pH 7.3.
+ SAMP-DIL (Sample diluent): thành phần dung dịch bao gồm đệm phosphat, sodium acid, pH 7.3.
+ CONJ (Conjugate): dung dịch đệm chứa goat anti-human IgG horseradish peroxidase.
+ CONTROL + (ANA screening test positive control): chứng dương chứa kháng thể ANA trong huyết thanh người.
+ C/O-CONTROL (ANA screening test cutoff control): chứng chuẩn chứa kháng thể ANA trong huyết thanh người.
+ CONTROL - (ANA screening test negative control): chứng âm chứa kháng thể ANA trong huyết thanh người.
+ SUBS (Substrate): Tetramethylbenzidin (TMB) được pha loãng trong đệm hydrogen peroxide.
+ STOP (Stop solution): chứa 1,5 % sulfuric acid và 1.5% hydrochloric acid.
1.2. Chuẩn bị hóa chất và vật liệu
Trước khi tiến hành thí nghiệm các hóa chất cần dùng được mang ra nhiệt độ phòng để ổn định nhiệt độ.
- Pha dung dịch rửa:
+ Dung dịch rửa (DNA Wash solution) được pha loãng với tỷ lệ 6ml dung dịch rửa + 100 ml nước cất.
+ Dung dịch sau khi pha loãng có thể bảo quản 14 ngày tại nhiệt độ 2-80C
- Chuẩn bị mẫu:
Ly tâm mẫu tách huyết thanh, đánh số thứ tự các mẫu.
- Pha loãng đối chứng và mẫu:
Chứng dương, chứng âm, chứng chuẩn và mẫu xét nghiệm được pha loãng với dung dịch pha loãng (sample Diluent) theo tỷ lệ 1:40.
10ul mẫu: 400ul dung dịch pha loãng.
- Chuẩn bị giếng:
+ Chuẩn bị số lượng giếng phù hợp với số lượng các mẫu xét nghiệm.
+ Gắn các giếng vào giá, đánh dấu theo thứ tự các mẫu.
- Chuẩn bị vật liệu:
+ Pipet và typ 10ul, 100ul, 1000ul.
+ Máy đọc OD.
+ Nắp đậy màu đen.
+ Giấy thấm.
III. CÁC BƯỚC TIẾN HÀNH
1. Pha loãng mẫu và chuẩn bị giếng
- Chuẩn bị các ống mới để pha loãng.
+ Pha loãng chứng âm, chứng dương, chứng chuẩn:
10ul chứng: 400ul sample Diluent, trộn kỹ.
+ Pha loãng mẫu
10ul mẫu: 400ul sample Diluent, trộn kỹ.
- Chuẩn bị và gắn giếng phản ứng vào khung theo số lượng vừa đủ.
2. Nhỏ mẫu
- Nhỏ 100ul chứng các loại và mẫu đã pha loãng vào các giếng tương ứng, ủ 30 phút, nhiệt độ phòng.
- Rửa giếng.
+ Thủ công: nhỏ 300ul dung dịch rửa vào mỗi giếng, chờ 30 giây, đổ bỏ dịch, vẩy khô và đập giếng trên giấy thấm để loại bỏ hết dịch. Thực hiện bước rửa 3 lần.
+ Máy: rửa theo chương trình tự động.
3. Nhỏ Conjugate
- Nhỏ 100ul Conjugate vào tất cả các giếng, ủ 30 phút, nhiệt độ phòng.
- Rửa giếng.
+ Thủ công: nhỏ 300ul dung dịch rửa vào mỗi giếng, chờ 30 giây, đổ bỏ dịch, vẩy khô và đập giếng trên giấy thấm để loại bỏ hết dịch. Thực hiện bước rửa 3 lần.
+ Máy: rửa theo chương trình tự động.
4. Nhỏ Substrate
Nhỏ 100ul TMB substrate solution vào tất cả các giếng, ủ 30 phút, nhiệt độ phòng, không ánh sáng.
Chú ý: không được để quá thời gian ủ.
5. Nhỏ Stop solution
Nhỏ 100 ul Stop solution vào mỗi giếng.
IV. NHẬN ĐỊNH KẾT QUẢ
1. Đọc kết quả
- Đọc OD ở bước sóng 450nm trong vòng 30 phút sau khi nhỏ Stop solution.
- Đầu tiên đọc giếng blanking control (chỉ có Dilutent sample) rồi đến các giếng chuẩn và giếng chứa mẫu.
- Yêu cầu:
+ Giếng chứng dương và chứng chuẩn phải có màu vàng.
+ Giếng chứng âm và giếng blank có màu hơi vàng hoặc không có màu.
2. Phân tích kết quả
Kết quả đo mật độ quang được nhập vào phần mềm phân tích kết quả và tính theo công thức sau:
ANA của mẫu = (OD mẫu / OD chứng chuẩn)
| ANA | Kết quả |
| < 1.0 | Âm tính |
| ≥ 1.0 | Dương tính |
V. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Làm không đúng, không đủ các bước của quy trình ® làm lại.
- Để thời gian ủ các bước quá lâu hoặc không đủ thời gian ® làm lại.
- Rửa giếng không kỹ ® làm lại.
KHÁNG THỂ KHÁNG dsDNA (Anti double stranded DNA) BẰNG PHƯƠNG PHÁP ELISA
I. NGUYÊN LÝ
dsDNA tinh sạch được gắn sẵn vào giếng. Do đó các kháng thể của dsDNA nếu hiện diện trong huyết thanh sẽ gắn đặc hiệu vào các dsDNA trên giếng. Thực hiện bước rửa để loại bỏ các kháng thể không gắn đặc hiệu. Sau khi nhỏ dung dịch cộng hợp có chứa kháng thể kháng globulin miễn dịch người gắn với enzym horseradish peroxidase vào giếng, kháng thể này sẽ gắn với phức hợp trong giếng hình thành nên phức hợp sandwich: cộng hợp - kháng dsDNA - dsDNA. Sau khi rửa, các cộng hợp không gắn với phức hợp sẽ bị loại bỏ, chỉ còn lại phức hợp sandwich trong giếng. Do vậy, khi nhỏ dung dịch cơ chất TMB substrate, enzym sẽ xúc tác tạo phản ứng tạo màu xanh da trời. Cuối cùng, dung dịch sẽ chuyển sang màu vàng khi nhỏ thêm dung dịch Stop solution. Kết quả được định lượng bằng máy đọc OD ở bước sóng 450nm.
II. CHỈ ĐỊNH
- Các trường hợp nghi ngờ lupus ban đỏ.
- Nghi có bệnh tự miễn.
- Có kết quả ANA dương tính.
III. CHỐNG CHỈ ĐỊNH
Không có chống chỉ định.
IV. CHUẨN BỊ
1. Phương tiện - hóa chất
1.1. Thành phần kít
- Quy trình sử dụng kít của BIORAD: REF 96DS-576DS, Autoimmune EIA Anti-dsDNA test.
- Thành phần kít bao gồm:
+ MPLT (anti-dsDNA microplate): kháng nhân dsDNA được gắn sẵn vào các giếng và các giếng được bảo quản trong túi dán kín.
+ WSH-CONC (DNA wash concentrate 16.7X): thành phần dung dịch bao gồm đệm phosphat và Tween 20. Dung dịch sau khi pha loãng sẽ có pH 7.3.
+ SAMP-DIL (DNA sample diluent): thành phần dung dịch bao gồm đệm phosphat, sodium azid, pH 7.3.
+ CONJ (Conjugate): dung dịch đệm chứa Goat anti-human IgG horseradish peroxidase.
+ CONTROL + (Anti-dsDNA positive control): chứng dương chứa kháng thể kháng dsDNA trong huyết thanh người.
+ CAL (Anti-dsDNA calibrator): chứng chuẩn chứa kháng thể kháng dsDNA trong huyết thanh người.
+ CONTROL (Anti-dsDNA negative control): chứng âm chứa kháng thể kháng dsDNA trong huyết thanh người.
+ SUBS (Substrate): Tetramethylbenzidin (TMB) được pha loãng trong đệm hydrogen peroxid.
+ STOP (Stop solution): chứa 1,5 % sulfuric acid và 1,5% hydrochloric acid.
1.2. Chuẩn bị hóa chất và vật liệu
Trước khi tiến hành thí nghiệm các hóa chất cần dùng được mang ra nhiệt độ phòng để ổn định nhiệt độ.
- Pha dung dịch rửa:
+ Dung dịch rửa (DNA Wash solution) được pha loãng với tỷ lệ:
+ 6ml dung dịch rửa + 100ml nước cất.
+ Dung dịch sau khi pha loãng có thể bảo quản 14 ngày tại nhiệt độ 2-80C.
- Chuẩn bị mẫu:
Ly tâm mẫu tách huyết thanh, đánh số thứ tự các mẫu.
- Pha loãng đối chứng và mẫu:
Chứng dương, chứng âm, chứng chuẩn và mẫu xét nghiệm được pha loãng với dung dịch pha loãng DNA (sample Diluent) theo tỷ lệ 1: 100.
10ul mẫu: 1.000ul dung dịch pha loãng.
- Chuẩn bị giếng:
+ Chuẩn bị số lượng giếng phù hợp với số lượng các mẫu xét nghiệm.
+ Gắn các giếng vào giá, đánh dấu theo thứ tự các mẫu.
- Chuẩn bị vật liệu:
+ Pipet và typ 10ul, 100ul, 1.000ul
+ Máy đọc OD
+ Nắp đậy màu đen.
+ Giấy them.
V. CÁC BƯỚC TIẾN HÀNH
1. Pha loãng mẫu và chuẩn bị giếng
- Chuẩn bị các ống mới để pha loãng.
+ Pha loãng chứng âm, chứng dương, chứng chuẩn:
10ul chứng: 1000ul sample Diluent, trộn kỹ.
+ Pha loãng mẫu
10ul mẫu: 1000ul sample Diluent, trộn kỹ.
- Chuẩn bị và gắn giếng phản ứng vào khung theo số lượng vừa đủ.
2. Nhỏ mẫu
- Nhỏ 100ul chứng các loại và mẫu đã pha loãng vào các giếng tương ứng
- Ủ 30 phút, nhiệt độ phòng.
- Rửa giếng
+ Thủ công: nhỏ 300ul dung dịch rửa vào mỗi giếng, chờ 30 giây, đổ bỏ dịch, vẩy khô và đập giếng trên giấy thấm để loại bỏ hết dịch. Thực hiện bước rửa 3 lần.
+ Máy: rửa theo chương trình tự động.
3. Nhỏ Conjugate
- Nhỏ 100ul Conjugate vào tất cả các giếng.
- Ủ 30 phút, nhiệt độ phòng.
- Rửa going.
+ Thủ công: nhỏ 300ul dung dịch rửa vào mỗi giếng, chờ 30 giây, đổ bỏ dịch, vẩy khô và đập giếng trên giấy thấm để loại bỏ hết dịch. Thực hiện bước rửa 3 lần.
+ Máy: rửa theo chương trình tự động.
4. Nhỏ Substrate
- Nhỏ 100ul TMB substrate solution vào tất cả các going.
- Ủ 30 phút, nhiệt độ phòng, không ánh sáng.
Chú ý: Không được để quá thời gian ủ.
5. Nhỏ Stop solution
Nhỏ 100ul Stop solution vào mỗi giếng.
VI. NHẬN ĐỊNH KẾT QUẢ
1. Đọc kết quả
- Đọc OD ở bước sóng 450nm trong vòng 30 phút sau khi nhỏ Stop solution.
- Đầu tiên đọc giếng blanking control (chỉ có Diluent sample) rồi đến các giếng chuẩn và giếng chứa mẫu.
- Yêu cầu
+ Giếng chứng dương và chứng chuẩn phải có màu vàng.
+ Giếng chứng âm và giếng blank có màu hơi vàng hoặc không có màu.
2. Phân tích kết quả
Kết quả đo mật độ quang được nhập vào phần mềm phân tích kết quả và tính theo đơn vị International Units (IUs).
IU của mẫu = (OD mẫu / OD chứng chuẩn) x IU
| Ius | Kết quả |
| < 25 | Âm tính |
| 25 - 30 | Nghi ngờ dương tính |
| 30 - 60 | Dương tính thấp |
| 60 - 200 | Dương tính |
| > 200 | Dương tính mạnh |
VI. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Làm không đúng, không đủ các bước của quy trình ® làm lại.
- Để thời gian ủ các bước quá lâu hoặc không đủ thời gian ® làm lại.
- Rửa giếng không kỹ ® làm lại.
XÉT NGHIỆM HLA - B27 BẰNG KỸ THUẬT FLOWCYTOMETRY
I. NGUYÊN LÝ
Dùng phức hợp hai kháng thể đơn dòng: anti CD3-PE và anti HLA-B27 FITC để phát hiện sự có mặt của kháng nguyên HLA-B27 trên bề mặt bạch cầu lympho người.
II. CHỈ ĐỊNH
- Người bệnh có triệu chứng đau sưng khớp, đặc biệt các khớp gốc chi, cột sống, thắt lưng và bác sĩ nghĩ đến khả năng viêm cột sống dính khớp.
- Các người bệnh có viêm màn bồ đào không do nhiễm khuẩn.
III. CHỐNG CHỈ ĐỊNH
Không có chống chỉ định.
IV. CHUẨN BỊ
1. Phương tiện - hóa chất
- Các pipetman dùng được cho định mức 20uL, 100uL và 1000uL.
- Typ nhựa 120x70mm dùng cho máy flow cytometry.
- Máy Flowcytometry (Cytomics FC-500).
- Hóa chất:
- Các kháng thể đơn dòng anti HLA-B27-FITC, anti CD3-PE.
- Dung dịch ly giải hồng cầu (Optimize C).
- Các dung dịch cho máy Flow cytometry: dung dịch chạy máy flow (ISO FlowSheat), dung dịch rửa máy flow (IsoClenz).
- Găng tay.
2. Bệnh phẩm
- Mẫu dùng: 2ml máu toàn phần lấy vào ống chứa chất chống đông EDTA.
- Mẫu dùng cho xét nghiệm có thể bảo quản 7 ngày ở nhiệt độ 20C đến 80C.
V. CÁC BƯỚC TIẾN HÀNH
- Vortex đều ống máu mẫu.
- Ủ mẫu với kháng thể.
+ Ghi tên người bệnh lên typ flow 12x70mm.
+ Cho vào ống 20uL anti CD3-PE và 20uL anti HLA-B27-FITC.
+ Lấy 100uL máu đã vortex nhỏ vào typ, votex đều, ủ 30 phút ở nhiệt độ phòng.
+ Thêm 1ml dung dịch lysing, votex đều, ủ 10 phút ở nhiệt độ phòng.
- Đọc kết quả
+ Bật máy Flow cytometry, vào chương trình phân tích HLA-B27 (theo quy trình hướng dẫn riêng trên từng máy).
+ Vortex lại trước khi đem mẫu đọc kết quả bằng chương trình phân tích HLA-B27 trên máy flow cytometry.
+ Khoanh vùng lympho dựa trên thông số SS và FS trên.
+ Nếu phát hiện có CD3+ chứng tỏ kháng thể hoạt động tốt.
VI. NHẬN ĐỊNH KẾT QUẢ
Xác định trên quần thể CD3+: nếu HLA-B27 dương tính ® kết luận người bệnh dương tính với kháng nguyên HLA-B27, nếu HLA-B27 âm tính ® kết luận người bệnh âm tính với kháng nguyên HLA-B27.
Rửa và tắt máy flow cytometry theo quy trình quy định riêng cho từng máy.
PHÂN TÍCH MYELOPEROXIDASE (MPO) NỘI BÀO
I. NGUYÊN LÝ
Myeloperoxidase (MPO) là một kháng nguyên đóng vai trò dấu ấn cho AML. Có thể phát hiện chính xác MPO bằng flow cytometry. Kết hợp sử dụng phân loại miễn dịch kháng nguyên nội và ngoại bào phải dùng chất xử lý màng tế bào. Sự xuất hiện MPO đặc hiệu cho AML. Tuy nhiên, không phải tất cả các trường hợp AML, bao gồm FAB M0 AML, đều là cMPO+, trong khi hoạt tính miễn dịch của MPO có thể thấy ở một số trường hợp ALLs.
II. CHỈ ĐỊNH
Lơ xê mi cấp nghi dòng tủy.
III. CHỐNG CHỈ ĐỊNH
Không có chống chỉ định.
IV. CHUẨN BỊ
1. Phương tiện - hóa chất
- MPO - FITC Monoclonal Antibody (Myeloperoxidase)
+ IO Test - Immunotech (ASR).
+ Bảo quản 2 - 80C. Không để đóng đá.
+ Tránh ánh sáng.
+ Ổn định đến ngày hết hạn.
- CD45 - ECD Monoclonal Antibody
+ IO Test - Immunotech (ASR).
+ Bảo quản 2-80C, không để đóng đá.
+ Tránh ánh sáng.
+ Ổn định đến ngày hết hạn.
- CD34 - PE Monoclonal Antibody
+ IO Test - Immunotech (ASR)
+ Bảo quản 2-80C, không để đóng đá.
+ Tránh ánh sáng.
+ Ổn định đến ngày hết hạn...
- IntraPrepPrep Permeabilization Reagent Kit
+ Immunotech.
+ Bảo quản nhiệt độ phòng, tránh ánh sáng.
+ Ổn định đến ngày hết hạn.
+ Gồm có các hóa chất sau:
· Reagent 1: Fixation
Cảnh báo: chứa 5,5% formaldehyd. Formaldehyd là chất độc, gây dị ứng và có thể là tác nhân gây ung thư. Tránh dây vào mắt, da và quần áo.
· Reagent 2: Permeabilization
Cảnh báo: chứa 0,1% sodium acid. Sodium acid là chất độc hại khi hít phải, khi tiếp xúc da và khi nuốt phải. Tránh tiếp xúc với mắt, da và quần áo.
- IsoFlow Sheath Fluid(Coulter)
+ Bảo quản nhiệt độ phòng.
+ Không dùng khi quá hạn sử dụng.
- Máy ly tâm
- Máy lắc (Vortex)
- Các ống nhựa dùng 1 lần 12x75mm
- Pipet và pipet typ
2. Bệnh phẩm
Huyền dịch tế bào máu, tủy xương, hoặc tổ chức khác được xử lý theo Quy trình chuẩn bị mẫu và phân tích Leukemia/Lymphoma.
V. CÁC BƯỚC TIẾN HÀNH
- Quy trình nhuộm phối hợp các kháng nguyên nội và ngoại bào gồm MPO, CD34 và CD45 được dùng cho phân tích MPO.
- Mỗi người bệnh (hoặc chứng) dùng 1 ống.
- Thêm 10uL CD 34 PE monoclonal antibody (chỉ khi người bệnh có CD34+) và 10 uL CD45 ECD vào ống.
- Pipet 50uL mẫu người bệnh đã xử lý vào ống tương ứng.
- Vortex từng ống.
- Ủ 15 phút ở nhiệt độ phòng (18-250) trong tối.
- Thêm 100uL IntraPrep Reagent 1 vào mỗi ống.
- Vortex từng ống.
- Ủ 15 phút ở nhiệt độ phòng (18-250) trong tối.
- Thêm 4mL IsoFlow vào từng ống.
- Ly tâm trong 5 phút ở 3.000 vòng /phút.
- Hút bỏ dịch nổi.
- Thêm 100uL IntraPrep Reagent 2 vào mỗi ống each tube.
- Trộn nhẹ 1-2 giây (không vortex).
- Ủ 5 phút ở nhiệt độ phòng.
- Trộn nhẹ 1-2 giây (không vortex).
- Thêm 20uL MPO-FITC Monoclonal Antibody vào từng ống.
- Vortex từng ống.
- Ủ 5 phút ở nhiệt độ phòng (18-250) trong tối.
- Thêm 4mL IsoFlow vào mỗi ống.
- Ly tâm 5 phút ở 3.000 vòng /phút.
- Hút bỏ dịch nổi.
- Tái huyền dịch tế bào trong 500ul IsoFlow.
- Phân tích mẫu đã chuẩn bị bằng máy flow cytometer trong vòng 2 hours. Nếu chưa phân tích được ngay, bảo quản mẫu ở 2-80C và phân tích trong vòng 24 giờ.
- Trên máy Cytomics FC500, phân tích bằng chương trình CXP và MPO/34/45 Protocol.
VI. NHẬN ĐỊNH KẾT QUẢ
MPO có ở các tế bào trưởng thành dòng tủy, là thành phần chính của bạch cầu hạt trung tính, nhưng không có ở các tế bào trưởng thành dòng lympho. Do vậy bạch cầu hạt được dùng làm nội chứng dương cho MPO còn lympho trưởng thành được dùng làm nội chứng âm.
Đính tất cả các đồ hình do máy in ra vào tờ tóm tắt kết quả, và chuyển cho bác sĩ phân tích, kèm theo các lam dàn hoặc lam cytospin để phân tích. Bác sĩ sẽ xem lại tất cả các đồ hình, diễn giải và ghi DƯƠNG, ÂM hoặc KHÔNG RÕ RÀNG vào cột kết quả của tờ tóm tắt. Bác sĩ cũng có thể chọn cách đọc kết quả YẾU hoặc MẠNH kèm theo để phản ánh mức độ mật độ huỳnh quang bác sĩ cũng sẽ phỏng đoán đưa ra một lời lý giải hoặc đưa ra các gợi ý cần thiết vào tờ báo cáo.
I. NGUYÊN LÝ
Trên bề mặt hồng cầu có các dấu ấn CD55, CD59. Bình thường 100% hồng cầu có đầy đủ CD55, CD59. Các CD này có tác dụng ngăn cản bổ thể tấn công gây tan hồng cồng. Khi thiếu hụt hoặc mất CD55-CD59, hồng cầu trở nên mẫn cảm với bổ thể và dễ dàng bị phá hủy khi gặp điều kiện thuận lợi. Phân tích CD55-CD59 hồng cầu là tiêu chuẩn vàng để chẩn đoán Đái huyết sắc tố kịch phát ban đêm. Dùng kháng thể đơn dòng kháng CD55-FITC và kháng thể đơn dòng kháng CD59-PE có thể phát hiện được mức độ có mặt, thiếu hụt hoặc mất CD55, CD59 trên bề mặt hồng cầu.
II. CHỈ ĐỊNH
- Người bệnh có giảm đa dòng tế bào máu, có biểu hiện tắc mạch, biểu hiện tan máu nội mạch.
- Có biểu hiện suy tủy xương.
- Có tan máu nội mạch chưa rõ nguyên nhân.
III. CHỐNG CHỈ ĐỊNH
Không có chống chỉ định.
IV. CHUẨN BỊ
1. Phương tiện - hóa chất
- Pipet và typ 10ul, 20ul, 100ul và 100ul.
- Typ thủy tinh 120x70mm.
- Ống nhựa 120x70mm dùng cho máy flow cytometry.
- Máy Flowcytometry.
- Hóa chất: dung dịch PBS, dung dịch chạy và rửa máy flow.
- Kháng thể đơn dòng anti CD55-FITC, anti CD59-PE.
2. Bệnh phẩm
- Mẫu dùng là máu toàn phần, được lấy vào ống chứa chất chống đông EDTA 2,5ml.
- Mẫu dùng cho xét nghiệm có thể bảo quản 7 ngày ở nhiệt độ 20C đến 80C.
V. CÁC BƯỚC TIẾN HÀNH
- Chuẩn bị mẫu:
+ Pha loãng mẫu theo tỷ lệ 1/100 bằng dung dịch PBS.
+ Hút 1ml PBS vào typ thủy tinh.
+ Vortex ống máu, lấy 10ul máu hòa loãng vào 1ml PBS.
- Ủ mẫu với kháng thể:
+ Ghi tên người bệnh lên ống nhựa 120x70mm.
+ Cho vào ống 20ul anti CD55-FITC và 20ul anti CD59-PE.
+ Thêm vào ống trên 100ul máu đã pha loãng, votex đều.
+ Ủ 30 phút ở nhiệt độ phòng.
+ Thêm 1ml PBS, votex đều.
+ Chuyển sang phân tích trên máy flow cytometry dùng chương trình phân tích CD55, CD59.
- Thao tác với máy Flowcytometry:
+ Bật máy tính, chọn chương trình CXP... ® chọn tên người làm thí nghiệm (ví dụ: Hòa) ® Nhập Pass phía dưới: password, đợi máy ổn định khoảng 20 phút.
+ Chọn: Panel ® tìm đến PNH hong cau ® kéo chương trình xuống cửa sổ phía dưới.
+ Nhập thông tin:
· Carousel: 1 hoặc 2 tùy theo để mẫu vào khay nạp mẫu 1 hay 2.
· Possition: là vị trí đặt typ trên Carousel.
· ID1: PNH HC.
· ID2: họ tên người bệnh.
+ Bấm nút Play để chạy.
VI. NHẬN ĐỊNH KẾT QUẢ
- Dựa trên 3 vùng tế bào để phân tích:
+ Nếu >95% tế bào hồng cầu nằm ở vùng III à không thiếu hụt CD55, CD59.
+ Nếu có >5% tế bào hồng cầu nằm ở vùng II hoặc vùng I ® có thiếu hụt CD55 hoặc CD59 hoặc cả 2. Lúc này cần ghi cụ thể tỷ lệ % hồng cầu loại I, loại II và loại III.
- Rửa và tắt máy theo quy trình riêng
+ Đặt theo thứ tự các vị trí từ 1 đến 4 trên carousel các ống: 1 ống Bleach + 3 ống nước cất.
+ Vào phần Common ® Clean ® Kéo chương trình Clean xuống ® Nhập số của carousel à Play.
+ Khi máy rửa xong, nhấc 4 ống ra, đặt 2 ống đen vào vị trí 1, 2. Bơm nước đầy vào phần dưới của 2 ống, đậy nắp lại.
+ Trên màn hình, bấm vào biểu tượng “zzz” sau đó bấm tiếp vào biểu tượng hình 2 ống đen. Khi ở phía dưới màn hình hiện “Press idol mode...” thì tắt máy.
+ Tắt hết chương trình ® FC OFF ® Tắt máy tính.
KHÁNG THỂ KHÁNG CARDIOLIPIN (ANTI-CARDIOLIPIN) BẰNG KỸ THUẬT ELISA
I. NGUYÊN LÝ
Kháng nguyên được gắn sẵn trong giếng sẽ kết hợp với kháng thể đặc hiệu IgG/IgM (nếu có) trong huyết thanh người bệnh tạo nên phức hợp kháng nguyên -kháng thể khi ủ. Sau khi rửa sạch, phức hợp này sẽ được gắn tiếp với kháng thể kháng globulin miễn dịch người (anti IgG/IgM) đã kết hợp sẵn enzym peroxidase. Sau khi rửa, lượng enzym gắn với phức hợp này được giữ lại trong giếng. Khi cho cơ chất TMB/H2O2, enzym sẽ xúc tác phản ứng tạo màu xanh lá cây, sau khi cho acid, màu xanh sẽ chuyển sang màu vàng. Đo OD ở bước sóng 450/620nm để đọc kết quả.
II. CHỈ ĐỊNH
- Nghi ngờ hội chứng anti - phospholipid.
- Bệnh hệ thống.
- Có biểu hiện tắc mạch.
- Hay tái phát sẩy thai, thai chết lưu.
- Xét nghiệm APTT kéo dài.
III. CHỐNG CHỈ ĐỊNH
Không có chống chỉ định.
IV. CHUẨN BỊ
1. Phương tiện - hóa chất
- Trang thiết bị: máy rửa ELISA, máy đọc phiến ELISA, máy ly tâm.
- Hóa chất: kít ELISA anti-cardiolipin, nước cất.
- Vật tư tiêu hao: giấy thấm, găng tay, mũ, khẩu trang.
2. Bệnh phẩm
- Lấy 2ml máu không chống đông ghi rõ thông tin người bệnh: tên, tuổi, số giường, khoa phòng, khớp với thông tin trên phiếu chỉ định.
- Ly tâm ống máu 3.000 vòng/2 phút để huyết thanh người bệnh tách hoàn toàn, huyết thanh không được để vỡ hồng cầu.
V. CÁC BƯỚC TIẾN HÀNH
- Để hóa chất ra nhiệt độ phòng 30 phút trước khi làm xét nghiệm.
- Pha dung dịch rửa với nước cất tỉ lệ 1:50.
- Pha loãng dung dịch Sample Buffer 5x với nước cất tỉ lệ 1:5.
- Pha loãng HTBN với buffer đã pha loãng trên theo tỷ lệ 1:101.
- Tính toán số giếng:
12 giếng chứng (6 chứng IgM, 6 chứng IgG) + số BN x 2 (1 IgM, 1 IgG)
|
| 1(IgG) | 2(IgM) | 3(IgG) | 4(IgM) | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| A | CalA | CalA | Mẫu3 | Mẫu3 |
|
|
|
|
|
|
|
|
| B | CalB | CalB | Mẫu4 | Mẫu4 |
|
|
|
|
|
|
|
|
| C | CalC | CalC | Mẫu5 | Mẫu5 |
|
|
|
|
|
|
|
|
| D | CalD | CalD | ... | ... |
|
|
|
|
|
|
|
|
| E | CalE | CalE |
|
|
|
|
|
|
|
|
|
|
| F | CalF | CalF |
|
|
|
|
|
|
|
|
|
|
| G | Mẫu1 | Mẫu1 |
|
|
|
|
|
|
|
|
|
|
| H | Mẫu2 | Mẫu2 |
|
|
|
|
|
|
|
|
|
|
- Nhỏ 100ml Calibrators A®F và 100ml huyết thanh người bệnh theo bảng trên.
- Ủ tối ở RT 30 phút.
- Rửa 300ml Wash buffer 1x mỗi giếng, rửa 3 lần, (vẩy sạch lại trên giấy thấm).
- Nhỏ 100ml Conjugates IgG/IgM, ủ tối ở RT 30 phút.
- Rửa 300ml Wash buffer 1x mỗi giếng, rửa 3 lần, (vẩy sạch lại trên giấy thấm).
- Nhỏ 100ml Substrate, ủ tối ở RT 30 phút.
- Nhỏ 100ml Stop. Để 5phút đem đọc kết quả.
- Đo OD ở bước sóng đôi 540/620nm trong vòng 30 phút tới khi nhỏ Stop.
Nhập số liệu để tính toán ra nồng độ anti Cardiolipin (IgG/IgM) dựa trên đường chuẩn thiết lập bởi OD và nồng độ chuẩn của 6 CAL A®F (IgG/IgM).
VI. NHẬN ĐỊNH KẾT QUẢ
|
| Bình thường | Nghi ngờ | Dương tính |
| IgG | < 12 GPL/ml | 12-18 GPL/ml | >18 GPL/ml |
| IgM | < 12 MPL/ml | 12-18 MPL/ml | >18 MPL/ml |
ĐIỆN DI MIỄN DỊCH TRÊN MÁY CAPILLARY2
I. NGUYÊN LÝ
Trong môi trường pH kiềm, các phân tử protein tích điện âm sẽ di chuyển về cực dương dưới tác dụng của dòng điện một chiều. Các protein đơn dòng trong huyết thanh (KN) sẽ kết hợp với các kháng thể kháng globulin đơn dòng, tạo nên hình ảnh mất đỉnh đơn dòng so với hình ảnh tham chiếu. Dựa vào sự mất đỉnh này sẽ xác định được globulin đơn dòng đó thuộc typ Ig nào.
II. CHỈ ĐỊNH
- Đau tủy xương.
- Tăng gama - globulin.
- Lơ xê mi kinh dòng lympho, u lympho.
- Bệnh hệ thống.
III. CHỐNG CHỈ ĐỊNH
Không có chống chỉ định.
IV. CHUẨN BỊ
1. Phương tiện - hóa chất
- Trang thiết bị: máy điện di mao quản Capillary2, máy ly tâm, pipet, que thủy tinh.
- Hóa chất: dung dịch đệm, seggment hóa chất (chứa KT kháng globulin đơn dòng), nước cất.
- Vật tư tiêu hao: giấy thấm, găng tay, mũ, khẩu trang.
2. Bệnh phẩm
- Lấy 3ml máu không chống đông ghi rõ thông tin người bệnh: tên, tuổi, số giường, khoa phòng, khớp với thông tin trên phiếu chỉ định.
- Ly tâm ống máu 3000 vòng/2 phút để HTBN tách hoàn toàn.
V. CÁC BƯỚC TIẾN HÀNH
1. Khởi động máy
- Bật máy tính và máy Sebia, chọn chương trình PHORESIS.
- Nhập Password: SEBIA rồi CAPILLARY STATUS WINDOW, chờ máy khởi động khoảng 20 phút Ready.
- Chọn chương trình: vào cửa sổ SELECT PROGRAM (góc trên phải) chọn IMMUNOTYPING 6®OK.
- Khi Status hiện Ready, thay hóa chất: vào “Replace containers”.
+ Đổ bình nước thải.
+ Thay bình Wash solution, bình dung dịch đệm (Buffer), nhập các thông tin yêu cầu®OK.
2. Chạy điện di
- Để bệnh phẩm ở vị trí số 1 trên Rack kèm theo seggment hóa chất bên cạnh, từ từ đẩy Rack vào bên trong.
- Máy chạy 15 phút sau cho ra kết quả.
- Nhập thông tin người bệnh: họ tên, tuổi, chẩn đoán, số giường, khoa phòng.
- Kích đúp vào dòng thông tin người bệnh để xem lại kết quả, bấm vào mục SEE IT để xem toàn bộ kết quả của 1 người bệnh, rồi chọn lệnh in.
3. Rửa máy
- Thay lại bình Buffer bằng bình nước cất để rửa máy: dùng Rack 100.
- Rửa cuối ngày: rửa kim hút bệnh phẩm: để ống Bleach ở vị trí 1 của rack 100 + 1 seggment trắng, đẩy rack vào, khi hiện cửa sổ lệnh thì chọn “Launch the probe cleaning (chlorinated sodium hypochlorite solution or CDT wash solution)” ® OK. Đợi 15 phút.
- Rửa cuối tuần: rửa các ống mao quản: để 2 ống enzym ở vị trí 1 và 8 của Rack 100 + 1 seggment trắng, từ từ đẩy Rack vào, rồi chọn “Launch the CAPICLEAN cleaning”. Đợi khoảng 40 phút.
4. Tắt máy
- Vào Replace containers thay bằng 3 bình nước cất.
- Trên màn hình chọn: Capillarys ® Special cycles ® Shutdown with distilled water into the 3 containers to rinse the system. Khi hiện câu lệnh: “This special shutdown procedure requires the replacement of the reagents with H2O. Do you want to continue?” ® OK.
- Sau khoảng 20 phút, màn hình hiện “Ready for shutdown” thì tắt máy diện di và máy tính.
VI. NHẬN ĐỊNH KẾT QUẢ
- Đỉnh gama globulin đơn dòng: đỉnh nhọn, chân hẹp.
- Dựa vào hình ảnh đỉnh đơn dòng mất đi ở những ô kết quả nào thì đọc kết quả Ig ở ô đó. Ví dụ, mất đỉnh ở ô IgG và Kappa thì kết luận đỉnh gama globulin đơn dòng là IgG-K.
VII. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Hành chính: nhầm bệnh phẩm, vỡ hồng cầu.
- Hóa chất: seggment hóa chất bị khô, có bọt khí, hóa chất hết hạn.
- Người làm xét nghiệm: sai sót trong quá trình chạy điện di, nhập thông tin nhầm.
PHÂN LOẠI MIỄN DỊCH BẰNG KỸ THUẬT FLOW CYTOMETRY TRÊN MÁY CYTOMIC FC500
I. NGUYÊN LÝ
Trên bề mặt tế bào có các dấu ấn đặc trưng cho từng dòng tế bào, từng giai đoạn phát triển của tế bào. Để phát hiện các dấu ấn đặc trưng này người ta dùng kháng thể đơn dòng gắn huỳnh quang kháng đặc hiệu với các dấu ấn cần phát hiện.
Kỹ thuật flow cytometry dựa trên nguyên lý phân tích đồng thời nhiều tín hiệu huỳnh và quang học của từng tế bào đơn lẻ. Dựa trên kháng thể đơn dòng gắn huỳnh quang và kỹ thuật flow cytometry, chúng ta có thể phát hiện sự có mặt hoặc mất đi các dấu ấn đặc trưng trên quần thể các tế bào ung thư. Căn cứ vào các dấu ấn đặc trưng đó người ta có thể xếp thể tế bào ung thư máu, góp phần chẩn đoán và tiên lượng bệnh tốt hơn.
II. CHỈ ĐỊNH
Các người bệnh lơ xê mi kinh, lơ xê mi cấp
III. CHỐNG CHỈ ĐỊNH
Không có chống chỉ định.
IV. CHUẨN BỊ
- Máy flow cytometry, đã cài đặt chương trình xếp loại miễn dịch.
- Pipet các loại 1ml, 10-50ul, 50-200ul.
- Các ống nghiệm kích thước 12x70mm dùng cho máy flow cytometry.
- Dung dịch chạy máy (Flow sheat).
- Dung dịch rửa máy (ISO Clenz).
- Dung dịch ly giải hồng cầu (Optimice C).
- Các kháng thể kháng CD5, CD3, CD13, CD14, CD33, CD34, HLA-DR gắn chất màu huỳnh quang PE.
- CD45 gắn chất màu huỳnh quang ECD.
- CD19, CD7, CD10, CD71, MPO, CD8, CD15, CD20 gắn chất màu huỳnh quang FITC.
V. CÁC BƯỚC TIẾN HÀNH
1. Chuẩn bị máy flow cytometry
- Kiểm tra bình chứa dung dịch chạy máy, dung dịch rửa máy, nếu cần bổ sung thêm các dịch vào bình chứa.
- Kiểm tra bình chứa nước thải, nếu đầy đổ bỏ nước thải, vặn chặt các nắp bình chứa.
- Bật máy flow cytometry.
- Chạy chuẩn hóa máy bằng ống Flow Check, nếu máy ổn định sẽ tiếp tục làm.
2. Chuẩn bị panel kháng thể
- Lấy 7 ống flow cytometry 12x70mm, đánh dấu từ 1-7.
- Cho vào ống 20ul dung dịch kháng thể các loại (mỗi ống 3 kháng thể) theo sơ đồ sau:
| Ống # | PE | FITC | ECD |
| 1 | CD3 | CD19 | CD45 |
| 2 | CD5 | CD7 | CD45 |
| 3 | CD34 | CD10 | CD45 |
| 4 | CD13 | CD15 | CD45 |
| 5 | CD33 | CD20 | CD45 |
| 6 | CD14 | CD71 | CD45 |
| 7 | HLA-DR | CD8 | CD45 |
3. Chuẩn bị mẫu
- Mẫu dịch hút tủy xương /máu chống đông EDTA, phải được bảo quản 4-80C và phân tích trong vòng 24 giờ.
- Rửa tế bào:
+ Lấy 1ml mẫu vào ống Falcon 15ml (nhớ ghi tên người bệnh lên ống Falcon).
+ Thêm 9ml PBS, trộn đều.
+ Ly tâm rửa 1.500 vòng /phút trong 5 phút ở nhiệt độ phòng.
+ Hút bỏ dịch nổi, tái huyền dịch cặn tế bào trong 10ml dung dịch PBS.
+ Lặp lại quy trình rửa tế bào 03 lần.
- Ly giải hồng cầu:
+ Sau lần ly tâm rửa lần 3, thêm vào cặn tế bào 5ml dung dịch ly giải hồng cầu.
+ Trộn đều huyền dịch tế bào, để 10 phút ở nhiệt độ phòng.
- Rửa sau ly giải hồng cầu.
+ Sau 10 phút ủ, lặp lại bước rửa tế bào như trên.
+ Sau rửa, tái huyền dịch tế bào trong 1ml dung dịch PBS.
+ Đếm số lượng bạch cầu trong huyền dịch, nếu cần, pha loãng huyền dịch bằng dung dịch PBS để đạt nồng độ tế bào khoảng 5-10 G/L.
4. Ủ mẫu
- Lấy 7 ống kháng thể đã chuẩn bị ở bước trên (dùng cho 1 mẫu phân tích).
- Ghi tên người bệnh lên các ống này.
- Thêm vào mỗi ống 100ul huyền dịch tế bào (5-10G/L).
- Votex các ống trên.
- Ủ 30 phút ở nhiệt độ phòng, tránh ánh sáng.
5. Rửa sau ủ kháng thể
- Thêm vào mỗi ống 3ml dung PBS, votex đều, ly tâm rửa 1500 vòng /phút trong 5 phút ở nhiệt độ phòng.
- Loại bỏ dịch nổi, tái huyền dịch cặn tế bào trong 3 ml dung dịch PBS, lặp lại bước rửa ly tâm trên 3 lần.
- Tái huyền dịch cặn tế bào trong 1ml PBS.
6. Phân tích trên máy flow cytometry
- Vào chương trình Phân loại miễn dịch đã lập sẵn trong máy với 3 thông số màu Log-PE, Log-FITC, Log-ECD.
- Lấy chương trình phân tích panel 7 ống như đã chuẩn bị.
- Nhập ID người bệnh, tên người bệnh, nhập tên CD cho mỗi ống.
- Chạy chương trình phân tích mẫu.
VI. NHẬN ĐỊNH KẾT QUẢ
- Dựa trên chương trình đã lập, xác định quần thể blast, xác định tính chất dương tính với từng CD. Xác định dòng tế bào ung thư.
LẤY MÁU TOÀN PHẦN TỪ NGƯỜI HIẾN MÁU
I. NGUYÊN LÝ
Lấy máu tĩnh mạch từ người trưởng thành, tình nguyện, đủ tiêu chuẩn sức khỏe để sử dụng trong điều trị.
II. CHỈ ĐỊNH
1. Đối với cơ sở y tế
1.1. Được thực hiện ở các trung tâm, các khoa truyền máu hoặc khoa xét nghiệm được giao nhiệm vụ lấy và cung cấp máu cho điều trị ở các bệnh viện.
1.2. Nhân viên y tế được đào tạo và thành thạo kỹ thuật.
1.3. Có đủ các nguyên vật liệu lấy và bảo quản máu.
2. Đối với người hiến máu
2.1. Được tư vấn, giải thích về nhu cầu, mục đích và các điều kiện sức khỏe để hiến máu.
2.2. Tình nguyện đăng ký hiến máu.
2.3. Đã được khám tuyển sức khỏe và đủ tiêu chuẩn hiến máu theo quy định hiện hành.
III. CHỐNG CHỈ ĐỊNH
1. Đối với cơ sở y tế
Không đạt các yêu cầu ở mục 2.1.
2. Đối với người hiến máu
Không đạt các yêu cầu ở mục 2.1.
IV. CHUẨN BỊ
1. Người thực hiện
- Bác sĩ hoặc điều dưỡng dưới sự chỉ đạo của bác sĩ làm nhiệm vụ tư vấn sức khỏe và khám tuyển.
- Điều dưỡng làm nhiệm vụ tiếp nhận đăng ký hiến máu, lấy máu xét nghiệm, lấy máu vào túi đựng máu.
- Kỹ thuật viên xét nghiệm hoặc điều dưỡng thực hiện xét nghiệm trước hiến máu.
2. Phương tiện - hóa chất
- Bộ dụng cụ đo huyết áp.
- Bộ dụng cụ lấy máu:
+ Bông, gạc và dung dịch sát khuẩn (cồn ethanol 700, cồn iốt 2% hoặc các dung dịch tương đương).
+ Kéo tù đầu, kẹp không mấu.
+ Bơm tiêm lấy máu xét nghiệm 3ml, kim lấy máu cỡ 20 - 22G.
+ Dây ga-rô, băng dính vải.
+ Ống nghiệm đựng mẫu máu các loại.
- Bộ dụng cụ xét nghiệm:
+ Dung dịch sulphat đồng tỷ trọng 1.052 để sàng lọc người thiếu máu.
+ Sinh phẩm xét nghiệm nhanh sàng lọc người có virut viêm gan B.
- Bộ túi lấy máu toàn phần:
Bộ túi dẻo lấy máu toàn phần có sẵn dung dịch chống đông, có gắn kim lấy máu cỡ 16G.
- Thùng vận chuyển /bảo quản lạnh.
3. Người hiến máu
Người hiến máu đủ tiêu chuẩn sức khỏe hiến máu theo quy định.
4. Hồ sơ
- Mẫu đăng ký hiến máu, bảng hỏi về tình trạng sức khỏe người hiến máu.
- Mẫu khám lâm sàng, xét nghiệm.
- Mẫu nhãn túi máu, nhãn ống nghiệm.
V. CÁC BƯỚC TIẾN HÀNH
1. Tiếp nhận đăng ký hiến máu.
2. Kiểm tra hồ sơ lưu về tiền sử sức khỏe và hiến máu (đối với người hiến máu nhắc lại).
3. Tư vấn, khám lâm sàng và ghi hồ sơ về tình trạng lâm sàng, cân nặng, mạch, huyết áp và các yêu cầu khác theo tiêu chuẩn. Người đăng ký hiến máu đáp ứng các tiêu chuẩn lâm sàng được hướng dẫn tiếp bước sau.
4. Lấy mẫu máu tĩnh mạch của người đăng ký hiến máu vào ống nghiệm có chống đông:
- Sát trùng da bằng cồn ethanol 700.
- Dùng bơm kim tiêm lấy 2-3ml máu tĩnh mạch, trộn đều với chất chống đông.
- Nhỏ 1 giọt máu vào cốc đựng dung dịch sulphat đồng. Theo dõi sự chìm, nổi của giọt máu. Kết luận huyết sắc tố đạt bằng và lớn hơn 120g/l khi giọt máu chìm; Khi giọt máu nổi cho biết huyết sắc tố dưới 120g/l.
- Ly tâm 1.000-3.000 vòng /phút.
- Nhúng que thử nhanh viêm gan B vào phần huyết tương trong. Đọc kết quả theo hướng dẫn của nhà sản xuất.
- Người đăng ký hiến máu có huyết sắc tố bằng hoặc lớn hơn 120g/l và xét nghiệm nhanh viêm gan B cho kết quả âm tính.
5. Lấy máu
Chuẩn bị túi lấy máu và ống nghiệm đựng mẫu máu.
- Kiểm tra túi lấy máu: về thể tích máu cần lấy, hạn sử dụng túi máu, màu sắc túi và dung dịch chống đông, biểu hiện rách, thủng, sự nguyên vẹn của túi, các ống dây, nắp đậy kim lấy máu.
- Tính thể tích máu lấy theo cân nặng theo công thức 1ml máu toàn phần tương đương 1,052 g (không tính túi máu và lượng dung dịch chống đông).
250ml máu toàn phần tương đương với 265g.
350ml máu toàn phần tương đương với 370g.
450ml máu toàn phần tương đương với 475g.
- Chuẩn bị 1 ống nghiêm có chống đông khô và 1 ống nghiệm không chống đông.
- Dán nhãn mã hóa định danh túi máu và hai ống nghiệm.
6. Tiếp nhận người hiến máu có hồ sơ khám tuyển chọn đạt tiêu chuẩn lâm sàng và xét nghiệm. Đối chiếu thông tin hành chính trong hồ sơ với người hiến máu. Dán nhãn hồ sơ hiến máu với mã hóa tương tự nhãn mã hóa túi máu và ống nghiệm.
7. Chọn và sát trùng da nơi lấy máu:
- Bộc lộ vùng khuỷu tay cách nếp khủy tay 5-7cm.
- Lựa chọn vị trí để chọc tĩnh mạch.
- Sát trùng da bằng cồn iốt 2% từ vị trí dự kiến chọc kim theo đường tròn đồng tâm từ trong ra ngoài đường kính khoảng 4cm. Để yên 10 giây.
- Sát trùng tiếp bằng cồn ethanol 700 theo cách tương tự như trên. Để khô trong 20-30 giây.
8. Tạo một vòng thắt lỏng trên dây lấy máu cách khoảng 10cm từ kim lấy máu.
9. Dùng kẹp không mấu kẹp dây lấy máu.
10. Đặt túi máu lên cân hoặc máy lắc túi máu thấp hơn tay và thân người hiến máu.
11. Ga-rô phần cánh tay cách nếp khuỷu 3-5cm.
12. Tháo nắp đậy kim, chọc tĩnh mạch. Khi đầu kim nằm trong tĩnh mạch, tháo kẹp để máu chảy vào túi máu. Cố định dây và kim lấy máu bằng băng dính.
13. Lắc trộn đều máu với chất chống đông.
14. Theo dõi thể tích máu thu được theo dự kiến.
15. Khi đủ thể tích máu, thắt dây, dùng kẹp vuốt ngược dây máu về phía tay người hiến máu khoảng 2cm.
16. Cắt dây ở khoảng giữa nút thắt dây và vị trí kẹp.
17. Mở kẹp lấy mẫu máu vào 2 ống nghiệm đã chuẩn bị, mỗi ống khoảng 4ml máu.
18. Rút kim khỏi tĩnh mạch. Dùng bông khô ép cầm máu ở vị trí rút kim.
19. Hoàn thiện hồ sơ ghi chép. Hoàn thiện đơn vị máu. Thay băng liền gạc dính vô trùng vết chọc tĩnh mạch.
VI. THEO DÕI
Trong suốt quá trình lấy máu, luôn chú ý theo dõi:
- Tình trạng dòng chảy vào túi máu và thể tích túi máu.
- Trao đổi với người hiến máu nhằm phát hiện sớm các bất thường xảy ra ở người hiến máu, giám sát tình trạng sức khỏe người hiến máu.
VII. XỬ TRÍ TAI BIẾN
1. Ở người hiến máu có thể xuất hiện một hoặc nhiều dấu hiệu như hoa mắt, chóng mặt, cảm thấy yếu mệt, lo lắng, thở nhanh, da xanh tái, vã mồ hôi lạnh, buồn nôn, nôn, thoáng ngất, ngất, đái ỉa không tự chủ, khám lâm sàng có huyết áp hạ, mạch chậm (dấu hiệu giúp phân biệt với sốc giảm thể tích máu): đây là các biểu hiện, mức độ tai biến có nguồn gốc tâm lý - thần kinh khi lấy máu, thậm chí mới chỉ nhìn thấy máu của người khác. Có thể ra ở một vài người riêng lẻ hoặc xảy ra hàng loạt trên nhiều người hiến máu.
Xử trí: tùy theo triệu chứng, mức độ tai biến, có thể áp dụng một hoặc nhiều biện pháp sau:
- Tháo ga rô, rút kim.
- Chuyển người hiến máu tới vị trí riêng biệt để tiện chăm sóc, thông báo cho bác sĩ, nếu tình trạng bất thường không giảm bớt hoặc xấu đi.
- Chườm lạnh vùng trán, gáy.
- Hạ thấp đầu, nâng cao chân.
- Hướng dẫn người hiến máu thở chậm.
- Để nghiêng đầu nếu nôn tránh hít phải chất nôn.
- Cho uống nhiều nước ấm, có đường.
2. Khi có co cứng, co giật cơ ở người có biểu hiện thở nhanh, tetani do tăng thông khí trao đổi, trò chuyện tránh để người hiến máu quá chú ý vào việc lấy máu, hướng dẫn người hiến máu thở chậm.
3. Tụ máu trong và sau khi chọc tĩnh mạch.
- Bỏ ga-rô, rút kim.
- Băng ép với lớp bông gạc dày ở nơi tụ máu.
- Nâng cao tay.
- Chườm lạnh, nếu cần.
4. Chọc vào động mạch: khi có dấu hiệu như máu màu sắc đỏ tươi, dòng chảy mạnh và thay đổi cường độ theo tần số mạch, có tụ máu, cần.
- Rút ngay kim lấy máu.
- Ấn mạnh liên tục khoảng 10 phút bằng tay vào vị trí chọc kim. Sau đó băng ép với lớp bông gạc dày ở nơi tụ máu.
- Kiểm tra mạch quay cổ tay, nếu mạch yếu hoặc không bắt được, cần gọi bác sĩ đánh giá tình trạng và xử trí tiếp.
5. Co giật, động kinh
- Tránh để thương tích người hiến máu và phòng tránh cho bản thân nhân viên y tế.
- Duy trì đường thở thông thoáng, tránh cắn lưỡi bằng dụng cụ.
- Cần bóp tim ngoài lồng ngực, hô hấp nhân tạo nếu ngừng tim, ngừng hô hấp.
- Thở oxy qua bóp bóng.
- Chuyển đến cơ sở y tế chuyên khoa gần nhất.
VIII. LƯU Ý CHĂM SÓC NGƯỜI HIẾN MÁU
1. Người hiến máu nên ăn nhẹ trước hiến máu.
2. Băng ép hoặc yêu cầu người hiến máu ấn nhẹ ngón tay qua bông gạc vào vị trí rút kim chọc tĩnh mạch trong tối thiểu 10-15 phút.
3. Với sự giám sát của nhân viên y tế:
- Yêu cầu người hiến máu nằm thêm trên giường lấy máu tối thiểu khoảng 4-5 phút.
- Cho phép người hiến máu ngồi thẳng người và đi lại.
4. Dặn người hiến máu
- Ăn bồi dưỡng nhẹ và uống nhiều nước ngay sau hiến máu. Tăng lượng nước uống trong vài ngày sau đó.
- Không uống rượu, hút thuốc cho đến khi đã ăn uống sau hiến máu.
- Ngồi hoặc nằm khi cảm thấy chóng mặt.
- Thông báo cho nhân viên y tế khi cảm thấy điều bất thường kéo dài.
- Chỉ tiếp tục các công việc thường ngày nếu cảm thấy khỏe mạnh.
- Tháo băng tại vị trí chọc tĩnh mạch sau khoảng 4 giờ sau hiến máu.
5. Nhân viên y tế cần được đào tạo và thành thạo việc.
- Thay băng dính vô khuẩn vị trí chọc kim khi chắc chắn đã cầm chảy máu.
- Cư xử chu đáo, cảm ơn và khuyến khích người hiến máu quay lại hiến máu lần sau.
- Phát hiện các dấu hiệu không mong muốn như da xanh tái, tri giác kém linh hoạt, lo lắng, thở nhanh...
- Tư vấn, giải thích, trả lời thắc mắc của người hiến máu, đánh giá tình trạng sức khỏe an toàn cho phép người hiến máu ra về,...
- Ghi hồ sơ các phản ứng xảy ra ở người hiến máu và các xử trí nếu có.
XÉT NGHIỆM SÀNG LỌC ĐƠN VỊ MÁU VÀ THÀNH PHẦN MÁU AN TOÀN
I. NGUYÊN LÝ
Mỗi đơn vị máu hiến từ người hiến máu đủ tiêu chuẩn đều cần phải được xét nghiệm sàng lọc một số bệnh lây truyền qua đường máu và thực hiện một số xét nghiệm huyết thanh học.
Các xét nghiệm phải thực hiện trên các thiết bị và sinh phẩm đã được cấp phép lưu hành của Bộ Y tế có độ nhạy, độ đặc hiệu cao phù hợp với mục đích duy trì chất lượng sản phẩm máu đảm bảo an toàn cho người bệnh được truyền máu, chế phẩm máu.
Mỗi xét nghiệm đều phải thực hiện theo hướng dẫn sử dụng của nhà sản xuất. Quy trình này quy định các công việc cần làm và thái độ xử trí đối với các tình huống xảy ra trong quá trình thực hiện xét nghiệm.
II. CHỈ ĐỊNH
Tất cả các đơn vị máu toàn phần, các thành phẩm máu gạn tách từ người hiến máu đều phải được xét nghiệm:
- Định nhóm kháng nguyên hồng cầu hệ ABO bằng kỹ thuật huyết thanh mẫu và hồng cầu mẫu với độ nhạy và độ đặc hiệu tương đương hoặc cao hơn kỹ thuật trên ống nghiệm.
- Định kháng nguyên Rh (D) bằng huyết thanh mẫu anti -D với độ nhạy và độ đặc hiệu tương đương hoặc cao hơn kỹ thuật trên ống nghiệm.
- Xét nghiệm sàng lọc HIV bằng kỹ thật tìm kháng thể anti -HIV 1 và 2 với độ nhạy và độ đặc hiệu tương đương hoặc cao hơn kỹ thuật ELISA.
- Xét nghiệm sàng lọc viêm gan B bằng kỹ thuật tìm kháng nguyên HBsAg với độ nhạy và độ đặc hiệu tương đương hoặc cao hơn kỹ thuật ELISA.
- Xét nghiệm sàng lọc viêm gan C bằng kỹ thuật tìm kháng thể anti - HCV với độ nhạy và độ đặc hiệu tương đương hoặc cao hơn kỹ thuật ELISA.
- Xét nghiệm sàng lọc giang mai bằng kỹ thuật tìm kháng thể giang mai với độ nhạy và độ đặc hiệu tương đương hoặc cao hơn kỹ thuật VDRL.
- Xét nghiệm sàng lọc sốt rét bằng kỹ thuật có độ nhạy tương đương kỹ thuật tìm ký sinh trùng sốt rét trên tiêu bản giọt đặc đọc bằng kính hiển vi quang học hoặc bằng kỹ thuật nhạy hơn.
III. CHỐNG CHỈ ĐỊNH
- Không có chống chỉ định thực hiện các xét nghiệm trên đối với bất kỳ các đơn vị máu toàn phần, chế phẩm máu gạn tách.
- Không được sử dụng kết quả xét nghiệm sàng lọc của các mẫu máu lấy từ người hiến máu ở thời điểm khác với thời điểm lấy máu.
IV. CHUẨN BỊ
1. Người thực hiện
- Bao gồm bác sĩ, kỹ thuật viên đại học, cao đẳng, trung cấp và tương đương.
- Được đào tạo, có hiểu biết đầy đủ về lý thuyết, có kỹ năng thực hiện thành thạo, biết nhận định kết quả.
2. Mẫu xét nghiệm
- Mẫu máu chống đông và không chống đông.
- Các mẫu máu được lấy từ cùng người hiến máu và cùng thời điểm lấy đơn vị máu, chế phẩm máu gạn tách.
- Các mẫu máu được bảo quản ở 20-240C dưới 6 giờ và bảo quản ở 2-60C trong vòng 24 giờ trước khi thực hiện xét nghiệm.
- Mẫu huyết thanh tách từ mẫu máu không chống đông.
- Mẫu hồng cầu tách từ mẫu máu chống đông.
- Các mẫu chứng âm, dương, kiểm tra chất lượng.
3. Phương tiện - hóa chất
- Cần có đủ theo yêu cầu của nhà sản xuất sinh phẩm tương ứng cho mỗi loại xét nghiệm.
- Cần được xác nhận chất lượng trước khi sử dụng.
- Các thiết bị, dụng cụ được hiệu chuẩn định kỳ.
- Được kiểm tra chất lượng trong mỗi lô thực hiện xét nghiệm.
4. Hồ sơ
- Hồ sơ cần thể hiện được các công việc đã thực hiện.
- Hồ sơ được bảo mật và tránh được khả năng bị thay đổi trái phép.
- Có thể truy nguyên được nguồn gốc đơn vị máu.
- Cho phép so sánh các kết quả hiện tại với các kết quả xét nghiệm đơn vị máu trong những lần hiến trước từ cùng người hiến máu.
V. CÁC BƯỚC TIẾN HÀNH
1. Định nhóm kháng nguyên hồng cầu hệ ABO bằng huyết thanh mẫu và hồng cầu mẫu trên ống nghiệm.
Ghi kết quả hiện tưỢng ngưng kết và kết luận nhóm máu khi có sự phù hợp kết quả của cả hai phương pháp.
2. Định kháng nguyên Rh (D) bằng huyết thanh mẫu anti -D trên ống nghiệm. Ghi kết quả kháng nguyên D dương tính khi có ngưng kết.
3. Xét nghiệm sàng lọc HIV bằng kỹ thật tìm kháng thể anti -HIV 1 và 2 với độ nhạy và độ đặc hiệu tương đương hoặc cao hơn kỹ thuật ELISA.
Ghi kết quả xét nghiệm sàng lọc HIV âm tính khi mật độ quang (OD) của mẫu cần xét nghiệm thấp hơn ngưỡng do nhà sản xuất sinh phẩm khuyến nghị và các mẫu chúng, mẫu kiểm tra chất lượng đều cho kết quả đạt yêu cầu.
4. Xét nghiệm sàng lọc viêm gan B bằng kỹ thuật tìm kháng nguyên HBsAg với độ nhạy và độ đặc hiệu tương đương hoặc cao hơn kỹ thuật ELISA.
Ghi kết quả xét nghiệm sàng lọc viêm gan B âm tính khi OD của mẫu cần xét nghiệm thấp hơn ngưỡng C.
5. Xét nghiệm sàng lọc viêm gan C bằng kỹ thuật tìm kháng thể anti -HCV với độ nhạy và độ đặc hiệu tương đương hoặc cao hơn kỹ thuật ELISA.
Ghi kết quả xét nghiệm sàng lọc viêm gan C âm tính khi OD của mẫu cần xét nghiệm thấp hơn ngưỡng do nhà sản xuất sinh phẩm khuyến nghị và các mẫu chúng, mẫu kiểm tra chất lượng đều cho kết quả đạt yêu cầu.
6. Xét nghiệm sàng lọc giang mai bằng kỹ thuật tìm kháng thể giang mai với độ nhạy và độ đặc hiệu tương đương hoặc cao hơn kỹ thuật VDRL.
Ghi kết quả xét nghiệm sàng lọc giang mai âm tính khi không có ngưng kết hoặc OD của mẫu cần xét nghiệm thấp hơn ngưỡng do nhà sản xuất sinh phẩm khuyến nghị và các mẫu chúng, mẫu kiểm tra chất lượng đều cho kết quả đạt yêu cầu.
7. Xét nghiệm sàng lọc sốt rét bằng kỹ thuật có độ nhạy tương đương hoặc cao hơn kỹ thuật tìm ký sinh trùng sốt rét trên tiêu bản giọt đặc đọc bằng kính hiển vi quang học.
Ghi kết quả xét nghiệm sàng lọc sốt rét âm tính khi không phát hiện được ký sinh trùng trên kính hiển vi quang học hoặc OD của mẫu cần xét nghiệm thấp hơn ngưỡng do nhà sản xuất sinh phẩm khuyến nghị và các mẫu chúng, mẫu kiểm tra chất lượng đều cho kết quả đạt yêu cầu.
VI. NHỮNG SAI SÓT VÀ XỬ TRÍ
1. Định nhóm hồng cầu ABO
Khi không có sự phù hợp kết quả của hai phương pháp huyết thanh mẫu và hồng cầu mẫu, cần phải thực hiện các kiểm tra bổ sung như sau:
- Kiểm tra mẫu tự thân giữa huyết thanh cần định nhóm và hồng cầu tự thân: nếu có ngưng kết, cần kiểm tra mức độ ngưng kết ở nhiệt độ lạnh (khoảng 40C) và nhiệt độ ấm 370C. Sự ngưng kết ở các điều kiện nhiệt độ trên cho thấy sự có mặt tự kháng thể trong mẫu định nhóm.
+ Cần thực hiện kỹ thuật rửa hồng cầu nhiều lần trong điều kiện nhiệt độ ấm 370C cho đến khi hết hiện tượng tự ngưng kết, sau đó thực hiện định nhóm bằng huyết thanh mẫu.
+ Cần ủ hấp phụ tự kháng thể trong huyết thanh cần định nhóm với hồng cầu O cho đến khi không còn gây ngưng kết hồng cầu O, sau đó thực hiện định nhóm với hồng cầu mẫu.
- Kiểm tra với mẫu chứng giữa huyết thanh cần định nhóm và hồng cầu chứng nhóm O: nếu có ngưng kết, cần kiểm tra mức độ ngưng kết ở nhiệt độ lạnh (khoảng 40C) và nhiệt độ ấm 370C.
+ Nếu đồng thời xảy ra ngưng kết với hồng cầu tự thân: xử lý như trường hợp trên.
+ Nếu huyết thanh cần định nhóm không xảy ra ngưng kết với hồng cầu tự thân và chỉ ngưng kết với hồng cầu nhóm O và các hồng cầu khác: Thực hiện kỹ thuật hấp phụ với hồng cầu nhóm O theo điều kiện nhiệt độ cho ngưng kết mạnh nhất cho đến khi không còn gây ngưng với hồng cầu O, sau đó thực hiện định nhóm với hồng cầu mẫu.
- Nếu huyết thanh cần định nhóm không có ngưng kết bất thường với hồng cầu tự thân và hồng cầu O, nhưng vẫn không có sự phù hợp kết quả định nhóm bằng huyết thanh mẫu và hồng cầu mẫu: cần kiểm tra các phản ứng không ngưng kết bằng kỹ thuật antiglobulin gián tiếp để tăng độ nhạy của các phản ứng ngưng kết.
- Phải cách ly các đơn vị máu, chế phẩm máu chưa có kết quả định nhóm máu.
2. Định nhóm kháng nguyên Rh (D)
Khi không có ngưng kết giữa kháng huyết thanh anti -D và hồng cầu cần định nhóm:
- Cần ủ hồng cầu cần định nhóm với huyết thanh mẫu anti -D ở 370C trong 60 phút, sau đó rửa hồng cầu và tiếp tục thực hiện kỹ thuật antiglobulin gián tiếp để kiểm tra sự gắn kháng thể trên bề mặt hồng cầu.
- Chỉ kết luận nhóm máu Rh (D) âm tính khi không có ngưng kết với kỹ thuật antiglobulin gián tiếp.
3. Xét nghiệm sàng lọc HIV, viêm gan B và viêm gan C
- Khi một trong các mẫu chứng, mẫu kiểm tra chất lượng cho kết quả không đạt yêu cầu. Cần phải thực hiện xét nghiệm lại tất cả các mẫu máu thực hiện cùng phiến xét nghiệm.
- Khi mẫu xét nghiệm có OD bằng hoặc cao hơn ngưỡng do nhà sản xuất sinh phẩm khuyến nghị, cần thực hiện lần lượt các bước sau:
+ Lấy thêm mẫu từ chính túi máu, chế phẩm máu cần xét nghiệm.
+ Định nhóm máu hệ ABO của mẫu xét nghiệm lấy lần đầu và mẫu lấy từ đơn vị máu hoặc chế phẩm máu; So sánh kết quả định nhóm, nếu kết quả không giống nhau, cần kiểm tra lại tất cả các đơn vị máu được tiếp nhận có liên quan.
+ Nếu kết quả định nhóm của các mẫu giống nhau, thực hiện xét nghiệm với cả mẫu xét nghiệm lấy lần đầu và mẫu lấy từ túi máu hoặc chế phẩm máu bằng kỹ thuật xét nghiệm, sinh phẩm có độ nhạy và độ đặc hiệu bằng hoặc cao hơn lần xét nghiệm đầu tiên.
- Kết quả xét nghiệm và xử trí với đơn vị máu, chế phẩm máu có liên quan:
+ Nếu mẫu xét nghiệm lấy từ đơn vị máu, chế phẩm máu có OD bằng hoặc cao hơn ngưỡng do nhà sản xuất sinh phẩm khuyến nghị thì kết luận xét nghiệm dương tính và hủy đơn vị máu, chế phẩm máu.
+ Nếu mẫu xét nghiệm lấy từ đơn vị máu, chế phẩm máu có OD thấp hơn so với ngưỡng, nhưng bằng hoặc cao hơn mức 80% so với ngưỡng do nhà sản xuất sinh phẩm khuyến nghị thì kết luận xét nghiệm nghi ngờ và hủy đơn vị máu, chế phẩm máu.
+ Nếu mẫu xét nghiệm lấy từ đơn vị máu, chế phẩm máu có OD thấp hơn mức 80% so với ngưỡng do nhà sản xuất sinh phẩm khuyến nghị thì kết luận xét nghiệm âm tính và cho phép sử dụng đơn vị máu, chế phẩm máu.
4. Xét nghiệm sàng lọc giang mai
- Khi một trong các mẫu chứng, mẫu kiểm tra chất lượng cho kết quả không đạt yêu cầu. Cần phải thực hiện xét nghiệm lại tất cả các mẫu máu thực hiện cùng phiến xét nghiệm.
- Khi mẫu xét nghiệm có ngưng kết, hoặc có OD bằng hoặc cao hơn ngưỡng do nhà sản xuất sinh phẩm khuyến nghị, cần thực hiện lần lượt các bước sau:
+ Lấy thêm mẫu từ chính túi máu, chế phẩm máu cần xét nghiệm; Định nhóm máu hệ ABO của mẫu xét nghiệm lấy lần đầu và mẫu lấy từ đơn vị máu hoặc chế phẩm máu; So sánh kết quả định nhóm, nếu kết quả không giống nhau, cần kiểm tra lại tất cả các đơn vị máu được tiếp nhận có liên quan.
+ Nếu kết quả định nhóm của các mẫu giống nhau, thực hiện xét nghiệm với cả mẫu xét nghiệm lấy lần đầu và mẫu lấy từ túi máu hoặc chế phẩm máu bằng kỹ thuật xét nghiệm, sinh phẩm có độ nhạy và độ đặc hiệu bằng hoặc cao hơn lần xét nghiệm đầu tiên.
- Kết quả xét nghiệm và xử trí với đơn vị máu, chế phẩm máu có liên quan:
+ Nếu mẫu xét nghiệm lấy từ đơn vị máu, chế phẩm máu có ngưng kết hoặc OD bằng hoặc cao hơn ngưỡng do nhà sản xuất sinh phẩm khuyến nghị thì kết luận xét nghiệm dương tính và hủy đơn vị máu, chế phẩm máu.
+ Nếu mẫu xét nghiệm lấy từ đơn vị máu, chế phẩm máu không có ngưng kết hoặc có OD thấp hơn so với ngưỡng do nhà sản xuất sinh phẩm khuyến nghị thì kết luận xét nghiệm âm tính và cho phép sử dụng đơn vị máu, chế phẩm máu.
ĐIỀU CHẾ KHỐI TIỂU CẦU BẰNG PHƯƠNG PHÁP TÁCH LỚP TIỂU CẦU, BẠCH CẦU
I. NGUYÊN LÝ
Tách tiểu cầu dựa trên sự khác biệt về tỷ trọng giữa các thành phần tế bào máu.
II. CHỈ ĐỊNH
- Giảm số lượng, chất lượng tiểu cầu gây xuất huyết nguy hiểm
- Dự phòng xuất huyết khi giảm nặng số lượng, chất lượng tiểu cầu
- Dự phòng các tai biến do giảm số lượng, chất lượng tiểu cầu khi thực hiện các thủ thuật xâm nhập, Điều trị hóa chất, ức chế sinh máu,…
III. CHỐNG CHỈ ĐỊNH
- Tăng số lượng tiểu cầu
- Các tình trạng bệnh lý có tăng đông, tắc mạch hoặc có các nguy cơ này.
IV. CHUẨN BỊ
1. Người thực hiện
Kỹ thuật viên ngân hàng máu đã được đào tạo và có khả năng thực hiện kỹ thuật.
2. Phương tiện - hóa chất
- Đơn vị máu toàn phần
+ Lấy máu vào bộ túi 4, trong đó có một túi nhỏ thể tích không quá 80ml.
+ Thể tích máu toàn phần lấy phù hợp với dung dịch chống đông.
+ Thời gian lấy mỗi đơn vị máu không quá 10 phút.
+ Nhiệt độ bảo quản máu toàn phần trước khi điều chế tiểu cầu trong khoảng 20-240C, thời gian không quá 24 giờ.
- Cơ sở nhà cửa, thiết bị, dụng cụ
+ Phòng điều chế khử khuẩn, có điều hòa không khí duy trì nhiệt độ 20-240C.
+ Máy ly tâm lạnh dùng cho túi máu loại rotor văng.
+ Cân thăng bằng và vật liệu cân bằng (mảnh cao su, túi rỗng).
+ Máy hàn dây.
+ Bàn ép.
+ Kẹp bản rộng ngoại khoa.
+ Kẹp gài nhựa.
- Hồ sơ
+ Mẫu hồ sơ quản lý.
+ Nhãn túi.
V. CÁC BƯỚC TIẾN HÀNH
1. Đặt các túi máu toàn phần vào các ống ly tâm. Cân bằng các ống ly tâm từng đôi một và đặt vào máy ly tâm ở các vị trí đối xứng.
2. Ly tâm túi máu toàn phần sao cho lắng chặt hồng cầu, bạch cầu, tiểu cầu và huyết tương trong không có tế bào. Thông số ly tâm khuyến nghị: tốc độ không thấp hơn 3.000 vòng /phút trong thời gian không ít hơn 5 phút và nhiệt độ từ 20-240C.
Yêu cầu cần đạt: phải tạo được lớp tiểu cầu-bạch cầu màu trắng ngà nằm giữa hồng cầu và huyết tương; huyết tương phải trong, không có lẫn hồng cầu.
3. Đặt túi máu toàn phần đã ly tâm lên bàn ép. Bẻ van và ép lớp huyết tương trong sang túi chuyển thứ nhất. Dùng khóa kẹp nhựa khóa dây khi mặt phân cách hồng cầu huyết tương cách đỉnh trên của túi khoảng 2cm.
4. Mở khóa thông túi máu toàn phần với túi chuyển có thể tích không quá 80ml. Dùng kẹp bản rộng kẹp ngay dưới lớp bạch cầu, tiểu cầu màu trắng ngà, nhắc túi máu khỏi bàn ép, để nghiêng túi máu lựa cho toàn bộ bạch cầu, tiểu cầu và một ít mặt trên khối hồng cầu chảy sang túi chuyển thứ hai. Dùng lớp huyết tương còn sót lại để tráng và ép hết phần dịch phía trên kẹp vào túi chuyển.
5. Dùng khóa kẹp nhựa khóa dây túi chuyển thứ hai.
6. Chuyển dung dịch bảo quản hồng cầu vào phần khối hồng cầu.
7. Hoàn thiện túi khối hồng cầu và túi huyết tương: ghi nhãn, hồ sơ, hàn dây và cắt rời túi khối hồng cầu, huyết tương.
8. Đặt các túi chuyển thứ hai vào các ống ly tâm. Cân bằng các ống ly tâm từng đôi một và đặt vào máy ly tâm ở các vị trí đối xứng.
9. Ly tâm túi chuyển thứ hai sao cho chỉ lắng hồng cầu và bạch cầu, nhưng chưa lắng tiểu cầu.
Thông số ly tâm khuyến nghị: tốc độ không cao hơn 1.500 vòng /phút trong thời gian không quá 2 phút.
10. Đặt túi chuyển thứ hai đã ly tâm lên bàn ép. Bẻ van và ép phần huyết tương và toàn bộ tiểu cầu sang túi chuyển thứ ba. Ngừng ép khi mặt phân cách hồng cầu dâng lên gần sát đỉnh túi. Dùng khóa kẹp nhựa khóa dây túi chuyển thứ ba.
11. Hoàn thiện túi chuyển thứ ba có chứa khối tiểu cầu: hàn dây và cắt rời túi khối tiểu cầu và túi chứa cặn hồng cầu, bạch cầu.
12. Lấy mẫu đếm tế bào, cân và tính thể tích khối tiểu cầu, ghi nhãn, hồ sơ chế phẩm máu.
13. Khối tiểu cầu bảo quản ở 20-240C trong 05 ngày.
VI. NHỮNG SAI SÓT VÀ XỬ TRÍ
- Túi máu bảo quản ở nhiệt độ 40C không được dùng để điều chế khối tiểu cầu.
- Tình trạng ly tâm:
+ Cần đặt túi máu, các túi rỗng kèm theo vào ống ly tâm sao cho thành túi dẻo luôn áp sát thành ống ly tâm để tránh nứt vỡ túi. Phải sử dụng các vật liệu mềm, dễ uốn để đệm các túi máu, chế phẩm quá nhỏ so với đường kính ống ly tâm.
+ Cần theo dõi tình trạng cân bằng khi ly tâm, đặc biệt giai đoạn tăng tốc từ lúc khởi động đến khi đạt được 1.000 vòng /phút. Nếu xuất hiện tình trạng rung, lắc cần dừng ly tâm và cân bằng lại các ống ly tâm và bảo dưỡng, bôi mỡ bảo ôn các khớp nối của ống ly tâm và bàn gá ống ly tâm.
- Tách huyết tương và các chế phẩm máu: cần duy trì lực ép ổn định tránh làm sục các thành phần đã lắng. Vào cuối giai đoạn tách, cần làm giảm tốc độ tách bằng cách làm hẹp ống dây dẫn giữa các túi chế phẩm.
- Khi xảy ra vẩn, sục các thành phần đã lắng, cần trộn đều và ly tâm lại.
I. NGUYÊN LÝ
Trong huyết tương tươi đông lạnh khi làm tan đông ở nhiệt độ lạnh dưới âm 100C có một lượng nhỏ vẩn tủa hình thành. Trong thành phần của tủa này giàu một số yếu tố đông máu như fibrinogen, Von Willebrand, yếu tố VIII.
II. CHỈ ĐỊNH
Dùng Điều trị cho người bệnh:
- Hemophilia A và các trường hợp thiếu hụt yếu tố VIII mắc phải khác.
- Bệnh Von Willebrand.
- Thiếu fibrinogen bẩm sinh và mắc phải.
- Các bệnh lý nội khoa, ngoại khoa, sản khoa khác có thiếu hụt yếu tố đông máu.
III. CHỐNG CHỈ ĐỊNH
- Các bệnh lý có tình trạng tăng đông.
- Các bệnh lý có tắc mạch.
IV. CHUẨN BỊ
1. Người thực hiện
- Kỹ thuật viên ngân hàng máu.
- Được đào tạo, có hiểu biết đầy đủ về lý thuyết, có kỹ năng thực hiện thành thạo.
2. Phương tiện - hóa chất
- Nguyên liệu:
+ Huyết tương tương đông lạnh được điều chế và đông lạnh trong vòng 24 giờ sau khi lấy máu.
+ Đựng trong túi dẻo có nối với 1 túi chuyển rỗng.
+ Nước muối sinh lý 0,9%.
+ Các vật liệu.
- Thiết bị, dụng cụ.
+ Phòng điều chế khử khuẩn.
+ Máy ly tâm lạnh có thể ly tâm được túi huyết tương.
+ Cân thăng bằng ly tâm và các vật liệu thăng bằng (mảnh cao su, túi dẻo rỗng).
+ Quầy đông lạnh tối thiểu đạt nhiệt độ -250C.
+ Máy hàn dây.
+ Máy nối dây vô trùng.
+ Hốt vô trùng.
+ Vật liệu khử trùng: bông, cồn iốt 2%, cồn ethanol 700.
+ Bàn ép huyết tương.
+ Khóa kẹp nhựa, kéo.
+ Hồ sơ
- Nhãn chế phẩm, hồ sơ quản lý.
V. CÁC BƯỚC TIẾN HÀNH
1. Điều chế tủa lạnh
- Huyết tương đông lạnh đã bảo quản ở quầy đông lạnh -250C tối thiểu 24 giờ. Lấy huyết tương tươi đông lạnh khỏi quầy đông lạnh và đặt vào tủ lạnh hoặc nhà lạnh có nhiệt độ 2-60C trong khoảng 12-18 giờ cho đến khi huyết tương tan gần hoàn toàn (lượng đá chưa tan còn trong túi huyết tương không quá 10% tổng thể tích).
- Đặt các túi huyết tương đã làm tan đông vào các ống ly tâm. Cân bằng các ống ly tâm từng đôi một và đặt vào máy ly tâm ở các vị trí đối xứng.
- Ly tâm túi huyết tương tan đông làm lắng các tủa lạnh.
Thông số ly tâm khuyến nghị: tốc độ không thấp hơn 3.000 vòng /phút trong thời gian không ít hơn 10 phút và nhiệt độ thấp hơn 100C.
- Sau khi ly tâm, đặt các túi huyết tương đã tan đông và ly tâm lên bàn ép. Tách huyết tương từ túi huyết tương đã ly tâm chảy sang túi rỗng đính kèm. Túi huyết tương ban đầu chỉ còn tủa ở đáy túi.
- Hàn dây và tách túi tủa và túi huyết tương.
2. Pool tủa lạnh
- Túi tủa lạnh được làm tan trong bình cách thủy 370C trong 15 phút.
- Trong điều kiện vô trùng (làm việc trong hốt vô trùng, sử dụng máy nối vô trùng), thực hiện bổ sung nước muối đẳng trương vào túi tủa lạnh. Mỗi túi tủa lạnh bổ sung khoảng 5-10ml nước muối đẳng trương vô trùng 0,9%. Trộn đều. Dồn 6 -10 túi dung dịch tủa hòa tan vào một túi duy nhất.
- Hoàn thiện túi chứa sản phẩm cuối cùng: Lấy mẫu đếm tế bào, hàn dây, cân và tính thể tích chế phẩm, ghi nhãn, hồ sơ chế phẩm máu.
- Tủa lạnh được đông lạnh ở nhiệt độ không cao hơn - 250C và bảo quản ở nhiệt độ không thấp hơn - 180C.
3. Phá đông và sử dụng
Phá đông ở nhiệt độ + 370C trong thời gian dưới 30 phút. Sử dụng ngay sau khi phá đông và không chậm hơn 6 giờ kể từ thời điểm phá đông. Tủa lạnh đã phá đông không làm đông lạnh lại và bảo quản tiếp.
VI. NHỮNG SAI SÓT VÀ XỬ TRÍ
1. Huyết tương tách từ máu toàn phần bảo quản trên 24 giờ không sử dụng để điều chế tủa lạnh.
2. Huyết tương tươi đông lạnh cần làm đông càng nhanh càng tốt và nhiệt độ đông lạnh không cao hơn - 250C.
Ly tâm tách tủa lạnh:
- Cần đặt túi máu, các túi rỗng kèm theo vào ống ly tâm sao cho thành túi dẻo luôn áp sát thành ống ly tâm để tránh nứt vỡ túi. Phải sử dụng các vật liệu mềm, dễ uốn để đệm các túi máu, chế phẩm quá nhỏ so với đường kính ống ly tâm.
- Cần theo dõi tình trạng cân bằng khi ly tâm, đặc biệt giai đoạn tăng tốc từ lúc khởi động đến khi đạt được 1.000 vòng /phút. Nếu xuất hiện tình trạng rung, lắc cần dừng ly tâm và cân bằng lại các ống ly tâm và bảo dưỡng, bôi mỡ bảo ôn các khớp nối của ống ly tâm và bàn gá ống ly tâm.
XÉT NGHIỆM HÒA HỢP MIỄN DỊCH TRUYỀN MÁU VÀ CẤP PHÁT MÁU AN TOÀN
I. NGUYÊN LÝ
Việc truyền máu và các chế phẩm máu phải đảm bảo sự hòa hợp giữa các thành phần truyền vào hệ thống miễn dịch, đặc biệt là hệ thống miễn dịch hồng cầu của người bệnh.
Ngoài việc đảm bảo hòa hợp hệ nhóm máu ABO, cần áp dụng kỹ thuật phát hiện các tình trạng không hòa hợp ngoài hệ ABO, cũng như kiểm soát tình trạng an toàn thể hiện qua dấu hiệu bề ngoài của đơn vị máu, quản lý và đối chiếu hồ sơ, sản phẩm.
II. CHỈ ĐỊNH
Được áp dụng cho tất cả các trường hợp cần truyền máu và chế phẩm máu.
III. CHỐNG CHỈ ĐỊNH
Không có chống chỉ định.
IV. CHUẨN BỊ
1. Người thực hiện
- Kỹ thuật viên ngân hàng máu.
- Được đào tạo, có hiểu biết đầy đủ về lý thuyết, có kỹ năng thực hiện thành thạo.
2. Phương tiện - hóa chất
- Máy ly tâm ống nghiệm.
- Kính hiển vi.
- Pipet nhỏ giọt.
- Bình cách thủy 370C.
- Ống nghiệm thủy tinh.
- Đơn vị máu và chế phẩm máu.
- Huyết thanh mẫu anti -A, anti-B và anti -AB.
- Hồng cầu mẫu nhóm A, B và O nồng độ 3-5%.
- Nước muối sinh lý 0,9%.
- Mẫu máu xét nghiệm:
+ 4-5ml máu không chống đông và 2ml máu chống đông được lấy từ người bệnh cần truyền máu.
+ Ly tâm máu không chống đông tách huyết thanh.
+ Rửa và pha hồng cầu người bệnh nồng độ 3-5% trong nước muối sinh lý 0,9%.
- Hồ sơ:
Nhãn tên người bệnh, hồ sơ quản lý.
V. CÁC BƯỚC TIẾN HÀNH
1. Định nhóm hệ ABO mẫu máu người bệnh theo phương pháp huyết thanh mẫu
1.1. Chuẩn bị 03 ống nghiệm ghi tên người bệnh hoặc mã số người bệnh và loại huyết thanh mẫu lần lượt là anti-A, anti-B và anti-AB.
1.2. Nhỏ lần lượt 01 giọt huyết thanh mẫu anti-A, anti-B và anti -AB vào ống nghiệm có ghi nhãn tương ứng.
1.3. Nhỏ lần lượt 01 giọt hồng cầu người bệnh đã pha loãng 3 - 5% vào mỗi ống nghiệm.
1.4. Lắc đều, ly tâm ở 1.000 vòng /phút trong 30 giây.
1.5. Nghiêng nhẹ từng ống nghiệm, đọc phản ứng bằng mắt thường và nhỏ lam kính đọc trên kính hiển vi quang học.
1.6. Ghi hiện tượng ngưng kết và tan máu vào hồ sơ.
2. Định nhóm hệ ABO mẫu máu người bệnh theo phương pháp hồng cầu mẫu
2.1. Chuẩn bị 02 ống nghiệm khác ghi tên người bệnh hoặc mã số người bệnh và loại hồng cầu mẫu lần lượt là A và B.
2.2. Nhỏ lần lượt 02 giọt huyết thanh người bệnh vào mỗi ống nghiệm chuẩn bị ở mục 2.1.
2.3. Nhỏ lần lượt 01 giọt hồng cầu mẫu nhóm A và B pha loãng 3 - 5% vào ống nghiệm có ghi nhãn tương ứng.
2.4. Lắc đều, ly tâm ở 1.000 vòng /phút trong 30 giây.
2.5. Nghiêng nhẹ từng ống nghiệm, đọc phản ứng bằng mắt thường và nhỏ lam kính đọc trên kính hiển vi quang học.
2.6. Ghi hiện tượng ngưng kết và tan máu vào hồ sơ.
3. Kết luận nhóm máu của người bệnh
Căn cứ vào hiện tượng ngưng kết, tan máu ở bước 1.6 và 2.6, xác định nhóm máu của người bệnh.
4. Một kỹ thuật viên khác lặp lại độc lập các bước kỹ thuật định nhóm máu từ 1 - 3 và xác định lại nhóm máu ABO của người bệnh.
5. So sánh kết quả định nhóm ABO của hai lần định nhóm
Kết quả của hai lần định nhóm phải giống nhau, trước khi kết luận cuối cùng về nhóm máu ABO của người bệnh.
Trường hợp người bệnh đã từng được truyền máu trước đây, hoặc đã được định nhóm từ trước: cần so sánh kết quả định nhóm của lần này với lần trước. Cần kiểm tra lại khi có sự khác nhau giữa các lần xét nghiệm (nhầm mẫu máu, nhầm hồ sơ...).
6. Định nhóm máu đơn vị máu, chế phẩm máu
6.1. Lấy mẫu máu của đơn vị máu, chế phẩm máu từ các đoạn dây dính kèm túi máu.
6.2. Định nhóm đơn vị máu toàn phần và khối bạch cầu: Thực hiện các bước tương tự từ 1 - 3. Kết quả định nhóm phải giống với nhóm máu được ghi trên nhãn đơn vị máu và hồ sơ quản lý đơn vị máu toàn phần.
6.3. Định nhóm khối hồng cầu: Thực hiện các bước tương tự từ 6.1 - 6.4. Kết quả định nhóm phải giống với nhóm máu được ghi trên nhãn đơn vị máu và hồ sơ quản lý đơn vị máu toàn phần.
6.4. Định nhóm các loại huyết tương, khối tiểu cầu, tủa lạnh: Thực hiện các bước tương tự từ 2.1 - 2.6. Kết quả định nhóm phải giống với nhóm máu được ghi trên nhãn đơn vị máu và hồ sơ quản lý đơn vị máu toàn phần.
6.5. Trong trường hợp xét nghiệm ở các bước 6.1 - 6.4 cho kết quả khác với nhóm máu ghi trên nhãn và hồ sơ, cần tìm hiểu nguyên nhân trước khi tiếp tục các bước sau.
7. Định nhóm máu Rh(D) mẫu máu người bệnh
Việc định nhóm Rh(D) mẫu máu người bệnh chỉ thực hiện khi chỉ định truyền máu toàn phần, khối hồng cầu, khối bạch cầu, khối tiểu cầu.
7.1. Chuẩn bị 01 ống nghiệm ghi tên người bệnh hoặc mã số người bệnh và tên loại huyết thanh mẫu là anti -D.
7.2. Nhỏ 01 giọt huyết thanh mẫu anti -D vào ống nghiệm.
7.3. Nhỏ 01 giọt hồng cầu người bệnh pha loãng 3 - 5%.
7.4. Lắc đều và ly tâm ở 1.000 vòng /phút trong 30 giây.
7.5. Nghiêng nhẹ ống nghiệm, đọc phản ứng bằng mắt thường và nhỏ lam kính đọc trên kính hiển vi quang học.
7.6. Ghi hiện tượng ngưng kết vào hồ sơ.
8. Thực hiện xét nghiệm hòa hợp trong môi trường muối ở nhiệt độ phòng
8.1. Thực hiện xét nghiệm hòa hợp khi truyền máu toàn phần, khối bạch cầu.
8.1.1. Chuẩn bị 02 ống nghiệm ghi tên người bệnh hoặc mã số người bệnh và tên ống 1 và 2.
8.1.2. Nhỏ 02 giọt huyết thanh người bệnh vào ống 1.
8.1.3. Nhỏ 01 giọt hồng cầu của đơn vị máu đã pha loãng 3-5% vào ống 1.
8.1.4. Nhỏ 02 giọt huyết tương của đơn vị máu vào ống 2.
8.1.5. Nhỏ 01 giọt hồng cầu của người bệnh đã pha loãng 3-5% vào ống 2.
8.1.6. Lắc đều các ống nghiệm và ly tâm ở 1.000 vòng /phút trong 30 giây.
8.1.7. Nghiêng nhẹ ống nghiệm, đọc phản ứng bằng mắt thường và nhỏ lam kính đọc trên kính hiển vi quang học.
8.1.8. Ghi hiện tượng ngưng kết xảy ra ở các ống vào hồ sơ.
8.2. Thực hiện xét nghiệm hòa hợp khi truyền khối hồng cầu. Chỉ thực hiện xét nghiệm hòa hợp như với ống 1 của mục 7.1.
8.3. Thực hiện xét nghiệm hòa hợp khi truyền các loại huyết tương, khối tiểu cầu
Chỉ thực hiện xét nghiệm hòa hợp như với ống 2 của mục 7.1.
8.4. Không cần thực hiện xét nghiệm hòa hợp trong môi trường muối khi truyền tủa lạnh.
9. Thực hiện xét nghiệm hòa hợp ở nhiệt độ 370C có sử dụng huyết thanh antiglobulin
Chỉ thực hiện xét nghiệm này khi truyền máu toàn phần, khối hồng cầu, khối bạch cầu.
9.1. Sử dụng ống 1 của xét nghiệm hòa hợp đã thực hiện ở bước 8.
9.2. Ủ ống 1 ở bình cách thủy 370C trong 30 phút.
9.3. Ống 1 sau khi ủ được rửa 03 lần với nước muối sinh lý 0,9%.
9.4. Nhỏ 01 giọt kháng huyết thanh antiglobulin người.
9.5. Lắc đều các ống nghiệm và ly tâm ở 1.000 vòng /phút trong 30 giây.
9.6. Nghiêng nhẹ ống nghiệm, đọc phản ứng bằng mắt thường và nhỏ lam kính đọc trên kính hiển vi quang học.
9.7. Ghi hiện tượng ngưng kết xảy ra ở các ống vào hồ sơ.
10. Nhận định chung về các xét nghiệm đã thực hiện
10.1. Với xét nghiệm định nhóm máu:
Cho phép phát đơn vị máu, chế phẩm máu khi:
- Có cùng nhóm máu hệ ABO với người hiến máu.
- Có cùng nhóm Rh(D) với người hiến máu.
10.2. Với xét nghiệm hòa hợp trong môi trường muối và sử dụng antiglobulin:
Cho phép phát đơn vị máu, chế phẩm máu khi các xét nghiệm hòa hợp có kết quả âm tính.
11. Kiểm tra, đối chiếu trước khi phát máu
11.1. Kiểm tra phát hiện và không sử dụng đơn vị máu, thành phần máu có các dấu hiệu sau đây:
- Tan máu.
- Có cục đông, vẩn, vật lạ.
- Túi máu bị rách, thủng.
- Hiện tượng đổi màu,...
11.2. Hoàn thiện hồ sơ phát máu
- Phiếu truyền máu do cơ sở xét nghiệm hòa hợp miễn dịch lập và gửi cơ sở điều trị theo quy định tại Phụ lục 5 ban hành kèm theo quy chế này.
- Hồ sơ ghi kết quả định nhóm máu, phản ứng hòa hợp, sàng lọc và định danh kháng thể bất thường lưu tại cơ sở xét nghiệm hòa hợp miễn dịch.
11.3. Kiểm tra, đối chiếu các thông tin trên phiếu dự trù máu, nhãn túi máu, hồ sơ xét nghiệm định nhóm máu, hòa hợp miễn dịch, phiếu truyền máu về:
- Người bệnh nhận máu: Họ tên, mã số người bệnh (nếu có), năm sinh, nhóm máu ABO, Rh(D), số giường bệnh, tên khoa phòng, chẩn đoán, chỉ định loại chế phẩm và thể tích truyền.
- Đơn vị máu, chế phẩm máu: mã số, nhóm máu ABO, Rh(D), tên loại chế phẩm, thể tích, hạn sử dụng.
- Kết quả xét nghiệm hòa hợp giữa mẫu máu người bệnh nhận máu và mẫu của đơn vị máu, thành phần máu.
VI. NHỮNG SAI SÓT VÀ XỬ TRÍ
1. Định nhóm máu hệ ABO
Khi không có sự phù hợp kết quả của hai phương pháp huyết thanh mẫu và hồng cầu mẫu, cần phải thực hiện các kiểm tra bổ sung như sau:
- Kiểm tra mẫu tự thân giữa huyết thanh cần định nhóm và hồng cầu tự thân. Nếu có ngưng kết, cần kiểm tra mức độ ngưng kết ở nhiệt độ lạnh (khoảng 40C) và nhiệt độ ấm 370C. Sự ngưng kết ở các điều kiện nhiệt độ trên cho thấy sự có mặt tự kháng thể trong mẫu định nhóm.
+ Cần thực hiện kỹ thuật rửa hồng cầu nhiều lần trong điều kiện nhiệt độ ấm 370C cho đến khi hết hiện tượng tự ngưng kết, sau đó thực hiện định nhóm bằng huyết thanh mẫu.
+ Cần ủ hấp phụ tự kháng thể trong huyết thanh cần định nhóm với hồng cầu O cho đến khi không còn gây ngưng kết hồng cầu O, sau đó thực hiện định nhóm với hồng cầu mẫu.
- Kiểm tra với mẫu chứng giữa huyết thanh cần định nhóm và hồng cầu chứng nhóm O. Nếu có ngưng kết, cần kiểm tra mức độ ngưng kết ở nhiệt độ lạnh (khoảng 40C) và nhiệt độ ấm 370C.
+ Nếu đồng thời xảy ra ngưng kết với hồng cầu tự thân: xử lý như trường hợp trên.
+ Nếu huyết thanh cần định nhóm không xảy ra ngưng kết với hồng cầu tự thân và chỉ ngưng kết với hồng cầu nhóm O và các hồng cầu khác: Thực hiện kỹ thuật hấp phụ với hồng cầu nhóm O theo điều kiện nhiệt độ cho ngưng kết mạnh nhất cho đến khi không còn gây ngưng với hồng cầu O, sau đó thực hiện định nhóm với hồng cầu mẫu.
- Nếu huyết thanh cần định nhóm không có ngưng kết bất thường với hồng cầu tự thân và hồng cầu O, nhưng vẫn không có sự phù hợp kết quả định nhóm bằng huyết thanh mẫu và hồng cầu mẫu. Cần kiểm tra các phản ứng không ngưng kết bằng kỹ thuật antiglobulin gián tiếp để tăng độ nhạy của các phản ứng ngưng kết.
2. Định nhóm máu Rh(D)
Khi không có hiện tượng ngưng kết giữa kháng huyết thanh anti -D và hồng cầu cần định nhóm:
- Cần ủ hồng cầu cần định nhóm với huyết thanh mẫu anti -D ở 370C trong 60 phút, sau đó rửa hồng cầu và tiếp tục thực hiện kỹ thuật antiglobulin gián tiếp để kiểm tra sự gắn kháng thể trên bề mặt hồng cầu.
- Chỉ kết luận nhóm máu Rh(D) âm tính khi không có ngưng kết với kỹ thuật antiglobulin gián tiếp.
- Chọn lựa máu và chế phẩm hòa hợp về kháng nguyên Rh(D) theo quy định tại điều 34, 35 của Quy chế truyền máu ban hành theo Quyết định 06/2007/QĐ -BYT ngày 19/01/2007 của Bộ trưởng Y tế.
3. Xét nghiệm hòa hợp
Khi có một hoặc nhiều xét nghiệm hòa hợp có kết quả dương tính cần thông báo với bác sĩ điều trị, bác sĩ chuyên khoa huyết học để xem xét và thực hiện các biện pháp khác theo quy định tại điều 33, 34, 35 của văn bản đã trích dẫn.
ĐỊNH NHÓM MÁU HỆ ABO (KỸ THUẬT ỐNG NGHIỆM)
I. NGUYÊN LÝ
Hệ nhóm máu ABO là hệ nhóm máu quan trọng nhất trong thực hành truyền máu và đã được phát hiện năm 1901 bởi nhà bác học Karl Landsteiner.
Các nhóm máu của hệ ABO được xác định dựa vào sự có mặt hoặc không có mặt của kháng nguyên A và kháng nguyên B trên bề mặt hồng cầu và sự có mặt hoặc không có mặt của kháng thể A, kháng thể B trong huyết thanh.
Định nhóm máu hệ ABO là xác định tên của các nhóm máu của hệ ABO là: Nhóm máu A, nhóm máu B, nhóm máu AB, nhóm máu O. Phải xác định nhóm máu hệ ABO bằng hai phương pháp huyết thanh mẫu và hồng cầu mẫu.
Nguyên lý của kỹ thuật định nhóm máu hệ ABO được dựa trên nguyên lý của phản ứng ngưng kết.
II. CHỈ ĐỊNH
Nhóm máu hê ABO được xác định trong những trường hợp sau:
- Định nhóm máu cho bênh nhân khi vào viện, khi người bệnh cần truyền máu và định nhóm máu cho người bệnh tại giường bệnh ngay trước khi truyền máu.
- Định nhóm máu cho người hiến máu trước khi được tiếp nhận máu, định nhóm máu cho các đơn vị máu và chế phẩm khi phát máu và định nhóm máu cho đơn vị máu, chế phẩm tại giường bệnh ngay trước khi truyền máu.
- Định nhóm máu cho người khỏe mạnh.
- Định nhóm máu trong các nghiên cứu về hằng số và nghiên cứu về nhân chủng học.
III. CHỐNG CHỈ ĐỊNH
Không có chống chỉ định.
IV. CHUẨN BỊ
1. Người thực hiện
Bác sĩ, cử nhân kỹ thuật, kỹ thuật viên, điều dưỡng trung học.
2. Phương tiện - hóa chất
- Trang thiết bị.
Máy ly tâm loại thông thường; Kính hiển vi; Bình cách thủy; Tủ lạnh.
- Dụng cụ:
Ống nghiệm thủy tinh: 12x75mm; Giá cắm ống nghiệm; Khay men hình chữ nhật: 25x30cm; Cốc thủy tinh có mỏ loại 500ml; Bút maker; Pipet nhựa.
- Thuốc thử và hóa chất:
Huyết thanh mẫu: Anti A, Anti B, Anti AB; Hồng cầu mẫu A, B; Nước muối sinh lý 0,9%; Nước cất.
- Mẫu bệnh phẩm:
Gồm 2 ống máu của người bệnh:
+ Ống máu chống đông bằng EDTA: 2ml.
+ Ống máu không chống đông: 5ml.
+ Vật tư tiêu hao:
Sổ ghi kết quả; Phiếu xét nghiệm định nhóm máu; Mũ giấy; Khẩu trang; Găng tay; Quần áo công tác.
3. Thời gian làm xét nghiệm
30 phút.
V. CÁC BƯỚC TIẾN HÀNH
1. Chuẩn bị dụng cụ, hóa chất, sinh phẩm trước khi tiến hành xét nghiệm.
2. Nhận bệnh phẩm và phiếu yêu cầu định nhóm máu của người bệnh. Kiểm tra và đối chiếu các thông tin của người bệnh trên ống máu và phiếu xét nghiệm.
3. Chuẩn bị hồng cầu người bệnh 5% trong môi trường nước muối sinh lý 0,9% (1 giọt hồng cầu khối của người bệnh + 19 giọt NaCl 0,9%) và ly tâm ống máu không chống đông để tách huyết thanh.
4. Chuẩn bị 2 bộ, mỗi bộ 6 ống nghiệm sạch, khô. Trên mỗi ống nghiệm được đánh số hoặc ghi nhãn thứ tự anti -A; anti B; anti AB; Hồng cầu mẫu A; Hồng cầu mẫu B; Hồng cầu mẫu O, đồng thời ghi đầy đủ thông tin của người bệnh cần định nhóm lên ống nghiệm.
5. Định nhóm máu hệ ABO lần 1 bằng 2 phương pháp: huyết thanh mẫu và hồng cầu mẫu.
6. Định nhóm máu hệ ABO lần 2 bằng 2 phương pháp: huyết thanh mẫu và hồng cầu mẫu.
VI. NHẬN ĐỊNH KẾT QUẢ
1. Đối chiếu kết quả giữa hai lần định nhóm
Nếu kết quả phù hợp: đóng dấu nhóm máu A, hoặc B, hoặc AB, hoặc O vào phiếu xét nghiệm.
- Nếu kết quả không phù hợp: kiểm tra lại toàn bộ các bước trên và lặp lại xét nghiệm.
2. Ghi ngày tháng làm xét nghiệm, bác sĩ hoặc cử nhân hoặc kỹ thuật viên hoặc điều dưỡng trung học làm trực tiếp ký nháy vào phiếu xét nghiệm.
3. Ghi kết quả vào sổ lưu kết quả định nhóm máu.
4. Trưởng khoa xét nghiệm ký giấy xét nghiệm để trả kết quả cho người bệnh.
I. NGUYÊN LÝ
Hệ nhóm máu Rh là hệ nhóm máu quan trọng thứ hai trong thực hành truyền máu và đã được phát hiện năm 1940 bởi nhà bác học Kahl Landsteiner và Wiener.
Kháng nguyên nhóm máu hệ Rh rất phong phú với khoảng 50 kháng nguyên khác nhau, tuy nhiên có 5 kháng nguyên chính là D, C, c, E, e. Kháng nguyên D là quan trọng nhất. Người mang kháng nguyên D trên bề mặt hồng cầu được gọi là người có nhóm máu Rh (D) dương, người không mang kháng nguyên D trên bề mặt hồng cầu được gọi là người có nhóm máu Rh (D) âm.
Nhóm máu hệ Rh (D) được xác định đưa vào sự có mặt hoặc không có mặt kháng nguyên D trên bề mặt hồng cầu.
Nguyên lý của kỹ thuật định nhóm máu hệ Rh (D) được dựa trên nguyên lý của phản ứng ngưng kết.
II. CHỈ ĐỊNH
Nhóm máu hê ABO được xác định trong những trường hợp sau:
- Định nhóm máu hệ Rh(D) cho người bệnh.
- Định nhóm máu hệ Rh(D) cho người hiến máu.
- Định nhóm máu hệ Rh (D) cho các nghiên cứu về hằng số và nhân chủng học.
- Định nhóm máu hệ Rh (D) để xây dựng panel hồng cầu và xây dựng ngân hàng người hiến máu có nhóm máu hiếm.
III. CHỐNG CHỈ ĐỊNH
Không có chống chỉ định.
IV. CHUẨN BỊ
1. Người thực hiện
Bác sĩ, cử nhân, kỹ thuật viên, điều dưỡng trung học.
2. Phương tiện - hóa chất
- Trang thiết bị: máy ly tâm loại thông thường; Kính hiển vi; Bình cách thủy; Tủ lạnh.
- Dụng cụ: ống nghiệm thủy tinh: 12x75mm; Giá cắm ống nghiệm; Khay men hình chữ nhật: 25x30cm; Cốc thủy tinh có mỏ loại 500ml; Bút maker; Pipet nhựa.
- Thuốc thử và hóa chất: huyết thanh mẫu: Anti - A, Anti - B, Anti AB; Hồng cầu mẫu A, B; Nước muối sinh lý 0,9%; Nước cất.
- Mẫu bệnh phẩm: gồm 2 ống máu của người bệnh:
+ Ống máu chống đông bằng EDTA: 2ml.
+ Ống máu không chống đông: 5ml.
- Vật tư tiêu hao
Sổ ghi kết quả; Phiếu xét nghiệm định nhóm máu; Mũ giấy; Khẩu trang; Găng tay; Quần áo công tác.
3. Thời gian làm xét nghiệm
30 phút.
V. CÁC BƯỚC TIẾN HÀNH
1. Chuẩn bị dụng cụ, hóa chất, sinh phẩm trước khi tiến hành xét nghiệm.
2. Nhận bệnh phẩm và phiếu yêu cầu định nhóm máu Rh (D) của người bệnh, kiểm tra và đối chiếu các thông tin của người bệnh trên ống máu và phiếu xét nghiệm.
3. Chuẩn bị hồng cầu người bệnh 5% trong môi trường nước muối sinh lý 0,9% (1giọt hồng cầu khối của người bệnh + 19 giọt NaCl 0,9%).
4. Chuẩn bị 1 ống nghiệm sạch, khô ghi nhãn anti -D va ghi đầy đủ thông tin của người bệnh lên ống nghiệm.
5. Tiến hành định nhóm máu Rh (D): Nhỏ 1 giọt thuốc thử anti -D vào ống nghiệm đã chuẩn bị ở trên; Thêm 1 giọt hồng cầu 5% của người bệnh vào ống nghiệm trên; Trộn đều, ly tâm 1.000 vòng /phút x 20 giây.
6. Đọc kết quả và ghi lại mức độ ngưng kết.
VI. NHẬN ĐỊNH KẾT QUẢ
- Nếu phản ứng ngưng kết, kết luận có kháng nguyên D trên bề mặt hồng cầu, đóng dấu kết quả: nhóm máu Rh (D) dương.
- Nếu phản ứng không ngưng kết, kết luận không có kháng nguyên D trên bề mặt hồng cầu, đóng dấu kết quả: nhóm máu Rh (D) âm.
- Ghi ngày tháng làm xét nghiệm, bác sĩ hoặc kỹ thuật viên hoặc điều dưỡng làm trực tiếp ký nháy vào phiếu xét nghiệm.
- Ghi kết quả vào sổ lưu kết quả định nhóm máu.
- Trưởng khoa xét nghiệm ký giấy xét nghiệm để trả kết quả cho người bệnh.
- 1Quyết định 1918/QĐ-BYT năm 2012 về Quy trình kỹ thuật khám, chữa bệnh chuyên khoa lao thuộc chuyên ngành lao và bệnh phổi do Bộ trưởng Bộ Y tế ban hành
- 2Quyết định 1919/QĐ-BYT năm 2012 về Quy trình kỹ thuật khám, chữa bệnh chuyên ngành phong - da liễu do Bộ trưởng Bộ Y tế ban hành
- 3Quyết định 3906/QĐ-BYT năm 2012 về Quy trình kỹ thuật khám, chữa bệnh chuyên ngành Nhãn khoa do Bộ trưởng Bộ Y tế ban hành
- 4Quyết định 638/QĐ-BYT năm 2013 hướng dẫn Quy trình kỹ thuật khám, chữa bệnh chuyên ngành Bỏng do Bộ trưởng Bộ Y tế ban hành
- 5Quyết định 1313/QĐ-BYT năm 2013 hướng dẫn quy trình khám bệnh tại Khoa Khám bệnh của bệnh viện do Bộ trưởng Bộ Y tế ban hành
- 6Quyết định 1377/QĐ-BYT năm 2013 hướng dẫn Quy trình kỹ thuật khám, chữa bệnh chuyên ngành Phụ sản do Bộ trưởng Bộ Y tế ban hành
- 7Quyết định 2874/QĐ-BYT năm 2013 Quy trình kỹ thuật lọc màng bụng do Bộ Y tế ban hành
- 8Quyết định 3207/QĐ-BYT năm 2013 hướng dẫn Quy trình kỹ thuật khám, chữa bệnh chuyên ngành Răng Hàm Mặt do Bộ trưởng Bộ Y tế ban hành
- 9Thông tư 26/2013/TT- BYT hướng dẫn hoạt động truyền máu do Bộ trưởng Bộ Y tế ban hành
- 10Quyết định 2017/QĐ-BYT năm 2014 ban hành tài liệu “Hướng dẫn quy trình kỹ thuật chuyên ngành Huyết học - Truyền máu - Miễn dịch di truyền - Sinh học phân tử” do Bộ trưởng Bộ Y tế ban hành
- 11Dự thảo Đề cương Luật về máu và tế bào gốc
- 12Quyết định 3336/QĐ-BYT năm 2017 tài liệu Hướng dẫn quy trình kỹ thuật Huyết học - Truyền máu - Miễn dịch - Di truyền - Sinh học phân tử do Bộ trưởng Bộ Y tế ban hành
- 1Quyết định 1918/QĐ-BYT năm 2012 về Quy trình kỹ thuật khám, chữa bệnh chuyên khoa lao thuộc chuyên ngành lao và bệnh phổi do Bộ trưởng Bộ Y tế ban hành
- 2Quyết định 1919/QĐ-BYT năm 2012 về Quy trình kỹ thuật khám, chữa bệnh chuyên ngành phong - da liễu do Bộ trưởng Bộ Y tế ban hành
- 3Nghị định 63/2012/NĐ-CP quy định chức năng, nhiệm vụ, quyền hạn và cơ cấu tổ chức của Bộ Y tế
- 4Quyết định 3906/QĐ-BYT năm 2012 về Quy trình kỹ thuật khám, chữa bệnh chuyên ngành Nhãn khoa do Bộ trưởng Bộ Y tế ban hành
- 5Quyết định 638/QĐ-BYT năm 2013 hướng dẫn Quy trình kỹ thuật khám, chữa bệnh chuyên ngành Bỏng do Bộ trưởng Bộ Y tế ban hành
- 6Quyết định 1313/QĐ-BYT năm 2013 hướng dẫn quy trình khám bệnh tại Khoa Khám bệnh của bệnh viện do Bộ trưởng Bộ Y tế ban hành
- 7Quyết định 1377/QĐ-BYT năm 2013 hướng dẫn Quy trình kỹ thuật khám, chữa bệnh chuyên ngành Phụ sản do Bộ trưởng Bộ Y tế ban hành
- 8Quyết định 2874/QĐ-BYT năm 2013 Quy trình kỹ thuật lọc màng bụng do Bộ Y tế ban hành
- 9Quyết định 3207/QĐ-BYT năm 2013 hướng dẫn Quy trình kỹ thuật khám, chữa bệnh chuyên ngành Răng Hàm Mặt do Bộ trưởng Bộ Y tế ban hành
- 10Thông tư 26/2013/TT- BYT hướng dẫn hoạt động truyền máu do Bộ trưởng Bộ Y tế ban hành
- 11Quyết định 2017/QĐ-BYT năm 2014 ban hành tài liệu “Hướng dẫn quy trình kỹ thuật chuyên ngành Huyết học - Truyền máu - Miễn dịch di truyền - Sinh học phân tử” do Bộ trưởng Bộ Y tế ban hành
- 12Dự thảo Đề cương Luật về máu và tế bào gốc
- 13Quyết định 3336/QĐ-BYT năm 2017 tài liệu Hướng dẫn quy trình kỹ thuật Huyết học - Truyền máu - Miễn dịch - Di truyền - Sinh học phân tử do Bộ trưởng Bộ Y tế ban hành
Quyết định 4401/QĐ-BYT năm 2012 về Quy trình kỹ thuật khám, chữa bệnh chuyên ngành Huyết học - Truyền máu - Miễn dịch - Di truyền do Bộ trưởng Bộ Y tế ban hành
- Số hiệu: 4401/QĐ-BYT
- Loại văn bản: Quyết định
- Ngày ban hành: 09/11/2012
- Nơi ban hành: Bộ Y tế
- Người ký: Nguyễn Thị Xuyên
- Ngày công báo: Đang cập nhật
- Số công báo: Dữ liệu đang cập nhật
- Ngày hiệu lực: 09/11/2012
- Tình trạng hiệu lực: Kiểm tra

