Để sử dụng toàn bộ tiện ích nâng cao của Hệ Thống Pháp Luật vui lòng lựa chọn và đăng ký gói cước.
| BỘ Y TẾ | CỘNG HÒA XÃ HỘI CHỦ NGHĨA VIỆT NAM |
| Số: 1053/QĐ-BYT | Hà Nội, ngày 02 tháng 4 năm 2010 |
VỀ VIỆC BAN HÀNH HƯỚNG DẪN XÉT NGHIỆM PHÁT HIỆN NHIỄM HIV CHO TRẺ DƯỚI 18 THÁNG TUỔI
BỘ TRƯỞNG BỘ Y TẾ
Căn cứ Nghị định số 188/2007/NĐ-CP ngày 27/12/2007 của Chính phủ quy định chức năng, nhiệm vụ, quyền hạn và cơ cấu tổ chức của Bộ Y tế;
Theo đề nghị của Cục trưởng Cục Phòng, chống HIV/AIDS,
QUYẾT ĐỊNH
Điều 1. Ban hành kèm theo Quyết định này Hướng dẫn xét nghiệm phát hiện nhiễm HIV cho trẻ em dưới 18 tháng tuổi.
Điều 3. Các ông, bà: Chánh Văn phòng Bộ, Chánh Thanh tra Bộ, Vụ trưởng các Vụ, Cục trưởng các Cục thuộc Bộ Y tế, Giám đốc các Bệnh viện, Viện trưởng các Viện trực thuộc Bộ Y tế; Giám đốc Sở Y tế các tỉnh/thành phố trực thuộc Trung ương, Thủ trưởng các đơn vị liên quan chịu trách nhiệm thi hành Quyết định này.
|
Nơi nhận: | KT. BỘ TRƯỞNG |
XÉT NGHIỆM PHÁT HIỆN NHIỄM HIV CHO TRẺ DƯỚI 18 THÁNG TUỔI
(Ban hành kèm theo Quyết định số 1053 /QĐ-BYT ngày 02 tháng 4 năm 2010 của Bộ trưởng Bộ Y tế)
Hướng dẫn này quy định về việc thực hiện xét nghiệm phát hiện nhiễm HIV cho trẻ dưới 18 tháng tuổi bằng kỹ thuật khuyếch đại gen – PCR (Polymerase Chain Reaction) để phát hiện ADN (Acid Deoxyribonucleic) hoặc ARN (Acid Ribonucleic) của HIV.
Hướng dẫn này áp dụng đối với các cơ sở y tế thực hiện xét nghiệm phát hiện nhiễm HIV cho trẻ dưới 18 tháng tuổi.
Cơ sở thực hiện xét nghiệm phát hiện nhiễm HIV cho trẻ dưới 18 tháng tuổi phải được Bộ Y tế cho phép.
Xét nghiệm phát hiện nhiễm HIV được thực hiện khi trẻ đủ 4 tuần tuổi trở lên.
THỰC HIỆN XÉT NGHIỆM PHÁT HIỆN NHIỄM HIV CHO TRẺ DƯỚI 18 THÁNG TUỔI
I. ĐỐI TƯỢNG ĐƯỢC CHỈ ĐỊNH XÉT NGHIỆM
Thực hiện theo Hướng dẫn chẩn đoán điều trị HIV/AIDS ban hành kèm theo Quyết định số 3003/QĐ-BYT ngày 19/8/2009 của Bộ trưởng Bộ Y tế:
Trẻ phơi nhiễm HIV dưới 18 tháng tuổi (trẻ sinh ra từ người mẹ nhiễm HIV hoặc người mẹ có xét nghiệm sàng lọc HIV dương tính) nhưng chưa có xét nghiệm khẳng định tình trạng nhiễm.
Trẻ dưới 18 tháng tuổi được chẩn đoán nghi ngờ nhiễm HIV hoặc được chẩn đoán lâm sàng bệnh HIV/AIDS nặng và có xét nghiệm kháng thể kháng HIV dương tính.
Bước 1. Tư vấn trước xét nghiệm, chỉ định xét nghiệm và điền các thông tin cần thiết
a) Tư vấn: Thực hiện tư vấn trước và sau khi xét nghiệm HIV theo các quy định hiện hành. Cần tư vấn cho bố, mẹ hoặc người bảo trợ hợp pháp của trẻ về:
Các nguy cơ nhiễm HIV từ mẹ sang con và tiến triển của bệnh;
Lợi ích của xét nghiệm phát hiện sớm nhiễm HIV và cách thức tiến hành xét nghiệm;
Số lần xét nghiệm, thời điểm cần làm xét nghiệm và thời gian trả lời kết quả xét nghiệm;
Việc bú mẹ và nguy cơ lây nhiễm HIV, hướng dẫn lựa chọn cách nuôi dưỡng và chăm sóc trẻ.
b) Chỉ định xét nghiệm:
Đối với trẻ phơi nhiễm HIV dưới 9 tháng tuổi, xét nghiệm PCR được thực hiện khi trẻ đủ 4 tuần tuổi trở lên.
Đối với trẻ phơi nhiễm HIV từ 9 tháng đến 18 tháng tuổi và tất cả mọi trẻ được nghi ngờ nhiễm HIV dưới 18 tháng tuổi, cần làm xét nghiệm phát hiện kháng thể kháng HIV:
- Nếu xét nghiệm kháng thể kháng HIV dương tính: chỉ định xét nghiệm PCR.
- Nếu xét nghiệm kháng thể kháng HIV âm tính và trẻ đã thôi bú mẹ hoàn toàn 6 tuần trước khi làm xét nghiệm là trẻ không nhiễm HIV.
- Nếu xét nghiệm kháng thể kháng HIV âm tính nhưng trẻ đang bú mẹ, hoặc thôi bú mẹ chưa đủ 6 tuần là trẻ còn nguy cơ, cần làm lại xét nghiệm kháng thể kháng HIV sau khi trẻ thôi bú mẹ đủ 6 tuần.
Lưu ý: Đối với trẻ nghi ngờ nhiễm HIV, nên làm xét nghiệm phát hiện kháng thể kháng HIV cho mẹ nếu có thể. Trong trường hợp xét nghiệm của mẹ dương tính xử trí như trẻ phơi nhiễm HIV.
c) Điền các thông tin cần thiết:
Điền đủ thông tin vào “Phiếu xét nghiệm phát hiện nhiễm HIV cho trẻ dưới 18 tháng” và “Phiếu gửi mẫu xét nghiệm phát hiện nhiễm HIV cho trẻ dưới 18 tháng tuổi” theo quy định (xem Phụ lục 2 và 3 của quyết định này).
Điền đủ thông tin vào sổ đăng ký quản lý trẻ phơi nhiễm tại cơ sở chỉ định xét nghiệm, được quy định tại Phụ lục 2.5 Quyết định 4361/QĐ-BYT ngày 07/11/2007 của Bộ trưởng Bộ Y tế về việc ban hành “Quy trình chăm sóc và điều trị dự phòng lây truyền HIV từ mẹ sang con”.
Bước 2. Lấy mẫu máu
Lấy mẫu máu xét nghiệm bằng bộ dụng cụ lấy giọt máu khô (DBS – Dry Blood Spot) hoặc bộ dụng cụ lấy máu toàn phần có chống đông bằng EDTA (Acid Ethylene Diamine Tetra Acetic).
a) Chuẩn bị dụng cụ:
Bộ dụng cụ lấy giọt máu khô (DBS): Bao gồm tấm DBS; găng tay (không có bột); dụng cụ chích máu; bông, gạc tiệt trùng; cồn 70%; túi giấy nến; 3-5 gói chống ẩm; túi nhựa có khóa; thẻ chỉ thị độ ẩm; giá xét nghiệm; phong bì sẫm màu (không dùng phong bì có mầu sáng).
Bộ dụng cụ lấy máu toàn phần: Bao gồm bơm kim tiêm vô trùng hoặc bộ lấy máu áp suất âm; ống xét nghiệm có chứa chất chống đông EDTA; găng tay (không có bột); bông, gạc tiệt trùng; cồn 70%; giá đựng các ống mẫu máu; túi giữ lạnh; thùng vận chuyển chuyên dụng.
b) Chuẩn bị lấy mẫu:
Điền thông tin vào tấmDBS;
Rửa tay và đi găng;
Động viên an ủi bệnh nhân;
Xác định vị trí lấy máu: gót chân hoặc ngón chân cái (nếu lấy giọt máu khô).
c) Tiến hành lấy mẫu :
Sử dụng bộ dụng cụ lấy giọt máu khô (DBS):
- Xoa làm ấm vùng lấy máu và sát khuẩn bằng cồn 70% sau đó để khô ít nhất 30 giây;
- Chích máu và bỏ giọt máu đầu tiên;
- Khi máu tạo thành giọt, thấm trực tiếp từng giọt vào trung tâm từng vòng tròn của tấm BDS; Lưu ý mỗi tấm DBS cần tối thiểu 3 vòng tròn đạt tiêu chuẩn;
- Đặt tấm DBS lên giá xét nghiệm, để khô tự nhiên ở nhiệt độ phòng trong thời gian tối thiểu 4 giờ;
- Sau đó, đặt mỗi tấm DBS vào một túi giấy nến và đặt túi giấy nến cùng các gói chống ẩm, tấm thẻ chỉ thị độ ẩm vào túi nilon có khóa (túi bảo quản bệnh phẩm);
Sử dụng bộ dụng cụ lấy máu toàn phần:
- Sát khuẩn vị trí lấy máu bằng cồn 70% và để khô ít nhất 30 giây;
- Lấy máu tĩnh mạch: 2ml (đối với phương pháp phát hiện ADN), hoặc 4 ml (đối với phương pháp phát hiện ARN). Cần chọn ống chứa chất chống đông có tỉ lệ EDTA thích hợp;
- Đảo ngược ống máu nhẹ nhàng 5-6 lần để trộn đều chất chống đông.
Để đảm bảo vô trùng và tránh lây nhiễm chéo nên lấy mẫu máu bằng bộ dụng cụ có áp suất âm (đã có sẵn EDTA chống đông).
Bước 3. Đóng gói và vận chuyển mẫu
Đối với mẫu giọt máu khô: Cho toàn bộ túi bảo quản bệnh phẩm và phiếu xét nghiệm, phiếu gửi mẫu xét nghiệm phát hiện nhiễm HIV cho trẻ dưới 18 tháng vào phong bì sẫm màu (một phòng bì có thể đựng một hoặc nhiều túi bảo quản bệnh phẩm) và chuyển đến phòng xét nghiệm bằng đường bưu điện càng sớm càng tốt; không cần giữ lạnh khi vận chuyển.
Đối với mẫu máu toàn phần: Xếp các ống đựng mẫu máu thẳng đứng trên giá xét nghiệm. Đặt giá xét nghiệm cùng các vật liệu thấm hút ẩm, túi giữ lạnh, phiếu xét nghiệm, phiếu gửi mẫu xét nghiệm vào thùng chuyên dụng và chuyển đến phòng xét nghiệm trong vòng 4-6giờ (đối với xét nghiệm ARN) hoặc 24 giờ (đối với xét nghiệm ADN).
Trong quá trình vận chuyển mẫu máu, cần thực hiện đúng các quy định về an toàn dự phòng phổ cập.
Bước 4. Tiếp nhận mẫu
Cần kiểm tra mẫu bệnh phẩm và phiếu yêu cầu xét nghiệm;
Kí nhận phiếu gửi mẫu xét nghiệm;
Điền đủ thông tin vào sổ xét nghiệm;
Thông báo lịch trả kết quả cho cơ sở gửi mẫu.
Bước 5. Tiến hành xét nghiệm
Thực hiện xét nghiệm phát hiện HIV bằng kỹ thuật PCR theo hướng dẫn của nhà sản suất Test kit.
Sau khi làm xét nghiệm: cần bảo quản bệnh phẩm trong tủ âm 200C (-200C) hoặc âm 700C (-700 C) ít nhất 2 năm (không bảo quản bằng ngăn đá tủ lạnh thông thường).
Bước 6. Trả lời kết quả
a) Thời gian trả lời kết quả:
Kết quả xét nghiệm PCR cần được trả lời cho cơ sở yêu cầu xét nghiệm trong vòng 02 tuần kể từ ngày nhận mẫu.
Trong trường hợp không trả được kết quả trong vòng 02 tuần, phòng xét nghiệm cần thông báo cho cơ sở yêu cầu xét nghiệm về lý do và thời hạn sẽ trả kết quả.
b) Cách ghi kết quả:
Nếu kết quả xét nghiệm PCR âm tính, ghi bằng chữ “Âm tính” vào phần “Trả lời kết quả xét nghiệm”.
Nếu kết quả xét nghiệm PCR dương tính, ghi bằng chữ “Dương tính” vào phần “Trả lời kết quả xét nghiệm”.
III. XỬ TRÍ KHI CÓ KẾT QUẢ XÉT NGHIỆM
Khi có kết quả xét nghiệm, cơ sở chỉ định xét nghiệm PCR cần xử trí thích hợp, theo Phụ lục 8 ban hành kèm theo quyết định này.
1. Nếu trẻ có kết quả xét nghiệm PCR lần 1 dương tính
a) Tư vấn: Tư vấn cho bố, mẹ, người bảo hộ hợp pháp của trẻ về kết quả xét nghiệm PCR hiện tại và sự cần thiết làm lại xét nghiệm để khẳng định tình trạng nhiễm HIV của trẻ; tư vấn dinh dưỡng, nguy cơ lây truyền HIV qua sữa mẹ và tư vấn về chăm sóc điều trị HIV/AIDS.
b) Thực hiện điều trị theo Hướng dẫn chẩn đoán và điều trị HIV/AIDS ban hành kèm theo Quyết định số 3003/QĐ-BYT ngày 19/8/2009 của Bộ trưởng Bộ Y tế.
c) Chỉ định xét nghiệm PCR lần 2: Ngay sau khi có kết quả xét nghiệm PCR lần 1 (để khẳng định tình trạng nhiễm HIV của trẻ).
2. Nếu trẻ có kết quả xét nghiệm PCR lần 1 âm tính a) Tư vấn:
Đối với trẻ đã ngưng bú mẹ 6 tuần trước khi làm xét nghiệm PCR: Trẻ có khả năng không nhiễm HIV, nhưng vẫn cần tiếp tục theo dõi.
Đối với trẻ đang bú mẹ hoặc thôi bú mẹ chưa đủ 6 tuần: Trẻ có thể không nhiễm, nhưng vẫn có nguy cơ nhiễm HIV qua sữa mẹ. Cần làm lại xét nghiệm (PCR lần 1) sau khi trẻ thôi bú đủ 6 tuần.
b) Theo dõi trẻ tại phòng khám ngoại trú và thực hiện xét nghiệm phát hiện kháng thể kháng HIV khi trẻ đủ 18 tháng tuổi để khẳng định tình trạng nhiễm.
3. Nếu trẻ có kết quả xét nghiệm PCR khẳng định (lần 2) dương tính
Tư vấn và thực hiện việc thông báo kết quả xét nghiệm HIV của trẻ theo các quy định tại Thông tư số 01/2010/TT-BYT ngày 06/01/2010 của Bộ Y tế về việc Quy định trách nhiệm, trình tự thông báo kết quả xét nghiệm HIV dương tính.
Tư vấn tình trạng nhiễm HIV và điều trị bằng ARV theo Hướng dẫn chẩn đoán điều trị HIV/AIDS ban hành kèm theo Quyết định số 3003/QĐ-BYT ngày 19/8/2009 của Bộ trưởng Bộ Y tế.
4. Nếu trẻ có kết quả xét nghiệm PCR khẳng định (lần 2) âm tính
Cần tiếp tục theo dõi tại phòng khám ngoại trú và làm xét nghiệm phát hiện kháng thể kháng HIV khi trẻ đủ 18 tháng tuổi để khẳng định tình trạng nhiễm.
TIÊU CHUẨN CỦA CƠ SỞ THỰC HIỆN KỸ THUẬT XÉT NGHIỆM PHÁT HIỆN NHIẾM HIV CHO TRẺ DƯỚI 18 THÁNG TUỔI
Các cơ sở thực hiện kỹ thuật xét nghiệm phát hiện nhiễm HIV cho trẻ dưới 18 tháng tuổi phải được Bộ Y tế cho phép.
Cán bộ thực hiện xét nghiệm phải có chứng chỉ đào tạo về kỹ thuật xét nghiệm PCR phát hiện HIV.
II. ĐIỀU KIỆN VỀ CƠ SỞ VẬT CHẤT VÀ TRANG THIẾT BỊ
Cơ sở vật chất và trang thiết bị phải đảm bảo các tiêu chuẩn được quy định tại Phụ lục 1 kèm theo Quyết định này.
CHẾ ĐỘ BÁO CÁO VÀ QUẢN LÝ SỐ LIỆU
1. Các cơ sở chỉ định xét nghiệm phát hiện nhiễm HIV cho trẻ dưới 18 tháng tuổi HIV cần báo cáo cho Trung tâm Phòng, chống HIV/AIDS tỉnh/thành phố trước ngày cuối cùng của mỗi tháng về các nội dung sau:
a) Số lượng trẻ dưới 18 tháng tuổi được làm xét nghiệm phát hiện nhiễm HIV theo biểu mẫu quy định tại Phụ lục 5 kèm theo quyết định này.
b) Tình hình sử dụng bộ dụng cụ lấy máu (nếu được Bộ Y tế cấp miễn phí) theo biểu mẫu quy định tại Phụ lục 7 kèm theo Quyết định này.
2. Các cơ sở thực hiện kỹ thuật xét nghiệm phát hiện nhiễm HIV cần báo cáo trực tiếp cho Cục Phòng, chống HIV/AIDS trước ngày 05 hàng tháng về tình hình sinh phẩm làm xét nghiệm phát hiện nhiễm HIV cho trẻ dưới 18 tháng tuổi (nếu được Bộ Y tế cấp miễn phí), theo biểu mẫu quy định tại Phụ lục 6 kèm theo Quyết định này.
3. Trung tâm Phòng, chống HIV/AIDS tỉnh/thành phố tổng hợp và báo cáo cho Cục Phòng, chống HIV/AIDS vào trước ngày 5 hàng tháng về số lượng bệnh nhân dưới 18 tháng tuổi được xét nghiệm phát hiện nhiễm HIV và tình hình sử dụng bộ dụng cụ lấy máu.
4. Viện, Bệnh viện tuyến Trung ương và các đơn vị trực thuộc Bộ Y tế báo cáo Cục Phòng, chống HIV/AIDS - Bộ Y tế trước ngày 5 hàng tháng, các nội dung sau:
a) Số lượng trẻ dưới 18 tháng tuổi được làm xét nghiệm phát hiện nhiễm HIV theo biểu mẫu quy định tại Phụ lục 5 kèm theo quyết định này.
b) Tình hình sử dụng bộ dụng cụ lấy máu (nếu được Bộ Y tế cấp miễn phí) theo biểu mẫu quy định tại Phụ lục 7 kèm theo Quyết định này.
II. BIỂU MẪU GHI CHÉP, QUẢN LÝ SỐ LIỆU
1. Cơ sở chỉ định xét nghiệm phát hiện nhiễm HIV cho trẻ dưới 18 tháng tuổi
Chỉ định xét nghiệm và viết “Phiếu xét nghiệm phát hiện nhiễm HIV cho trẻ dưới 18 tháng tuổi” theo biểu mẫu quy định tại Phụ lục 2 kèm theo Quyết định này.
Ghi chép “Sổ quản lý theo dõi trẻ phơi nhiễm HIV tại các cơ sở nhi” theo biểu mẫu được quy định tại phụ lục 2.5 kèm theo Quyết định 4361/QĐ-Bộ Y tế ngày 07/11/2007 của Bộ trưởng Bộ Y tế về việc ban hành “Quy trình chăm sóc và Điều trị dự phòng lây truyền HIV từ mẹ sang con”.
2. Cơ sở thực hiện kỹ thuật xét nghiệm phát hiện nhiễm HIV
Thực hiện ghi chép các biểu mẫu và sổ sách theo phụ lục 3,4,7 Quyết định này.
Cơ sở tiến hành kỹ thuật xét nghiệm phát hiện nhiễm HIV phải thực hiện các quy định về đảm bảo chất lượng xét nghiệm, nội kiểm và ngoại kiểm.
Xét nghiệm mẫu bệnh phẩm phải được tiến hành song song với mẫu chứng âm và chứng dương đã được xác định để kiểm tra đánh giá toàn bộ quy trình từ tách chiết ADN/ARN và phản ứng PCR.
Tham gia hệ thống ngoại kiểm và thực hiện các xét nghiệm định kỳ trên mẫu panel chuẩn, do hệ thống đánh giá chất lượng Ngoại kiểm cung cấp.
I. TRÁCH NHIỆM CỦA CỤC PHÒNG, CHỐNG HIV/AIDS
Chủ trì và phối hợp với các đơn vị liên quan để xây dựng tài liệu hướng dẫn chuyên môn về xét nghiệm phát hiện nhiễm HIV cho trẻ dưới 18 tháng tuổi;
Phối hợp với các đơn vị liên quan tổ chức kiểm tra, giám sát và thẩm định các Phòng xét nghiệm phát hiện nhiễm HIV cho trẻ dưới 18 tháng tuổi.
Thẩm định các phòng xét nghiệm và đề xuất Bộ Y tế cho phép các cơ sở đủ điều kiện thực hiện xét nghiệm phát hiện nhiễm HIV cho trẻ dưới 18 tháng tuổi;
Tiếp nhận mẫu máu DBS, triển khai thực hiện xét nghiệm, lưu giữ mẫu và trả lời kết quả xét nghiệm theo quy trình có liên quan tại mục II, chương II Quyết định này;
Thông báo và trả lời kết quả xét nghiệm theo các quy định tại mục II Chương II và thực hiện các báo cáo, biểu mẫu theo các quy định tại chương IV ban hành kèm theo Quyết định này;
Đào tạo, tập huấn và cấp chứng chỉ cho các cán bộ thực hiện xét nghiệm phát hiện nhiễm HIV cho trẻ dưới 18 tháng tuổi, theo các quy định hiện hành;
Tổ chức triển khai các hoạt động ngoại kiểm tra chất lượng xét nghiệm phát hiện nhiễm HIV cho trẻ em dưới 18 tháng tuổi trên phạm vi toàn quốc;
Hướng dẫn các cơ sở điều trị HIV/AIDS thực hiện lấy mẫu xét nghiệm, giám sát, hỗ trợ chuyên môn kỹ thuật về xét nghiệm phát hiện nhiễm HIV cho trẻ dưới 18 tháng tuổi.
III. TRÁCH NHIỆM CỦA SỞ Y TẾ TỈNH/THÀNH PHỐ
Chỉ đạo tổ chức, triển khai thực hiện xét nghiệm phát hiện nhiễm HIV cho trẻ dưới 18 tháng tuổi trên địa bàn tỉnh theo quy định của Bộ Y tế;
Giám sát hoạt động xét nghiệm phát hiện nhiễm HIV cho trẻ dưới 18 tháng tuổi tại các cơ sở chăm sóc điều trị HIV/AIDS, cơ sở tư vấn xét nghiệm HIV tự nguyện, cơ sở y tế có dịch vụ Phòng lây truyền HIV từ mẹ sang con trên địa bàn tỉnh/thành phố.
IV. TRÁCH NHIỆM CỦA CƠ QUAN THƯỜNG TRỰC PHÒNG, CHỐNG HIV/AIDS TỈNH/THÀNH PHỐ
Tham mưu cho Sở Y tế về việc tổ chức, triển khai xét nghiệm phát hiện nhiễm HIV cho trẻ dưới 18 tháng tuổi trên địa bàn tỉnh theo quy định của Bộ Y tế.
Phối hợp với các đơn vị liên quan lập kế hoạch triển khai thực hiện xét nghiệm phát hiện nhiễm HIV cho trẻ em dưới 18 tháng tuổi.
Là đầu mối quản lý sinh phẩm xét nghiệm, tổng hợp, phân tích và báo cáo số liệu trong địa bàn tỉnh, thành phố theo quy định tại mục I Chương IV Quyết định này.
V. TRÁCH NHIỆM CỦA CƠ SỞ CHỈ ĐỊNH XÉT NGHIỆM PHÁT HIỆN NHIỄM HIV CHO TRẺ DƯỚI 18 THÁNG TUỔI
Thực hiện việc chỉ định xét nghiệm, tư vấn trước và sau khi có kết quả xét nghiệm phát hiện nhiễm HIV cho trẻ dưới 18 tháng tuổi theo chương II Quyết định này;
Thực hiện việc ghi chép, quản lý số liệu, báo cáo tình hình sử dụng bộ dụng cụ lấy máu theo Chương IV Quyết định này./.
|
| KT. BỘ TRƯỞNG |
(Ban hành kèm theo Quyết định số 1053/QĐ-BYT ngày 02 tháng 04 năm 2010 của Bộ trưởng Bộ Y tế)
TIÊU CHUẨN CƠ SỞ XÉT NGHIỆM THỰC HIỆN KỸ THUẬT PCR XÉT NGHIỆM PHÁT HIỆN NHIỄM HIV
I. TIÊU CHUẨN CỦA PHÒNG XÉT NGHIỆM:
Để thực hiện kỹ thuật PCR các cơ sở cần phải có đủ các điều kiện dưới đây:
- Thiết kế theo Quy Tắc Một Chiều để tránh nhiễm chéo hoặc nhiễm từ môi trường bên ngoài.
- Phòng xét nghiệm PCR được chia thành ba khu vực:
■ Khu vực chuẩn bị xét nghiệm PCR
■ Khu vực thực hiện phản ứng PCR
■ Khu vực phân tích sản phẩm PCR
1. Khu vực chuẩn bị xét nghiệm PCR: bao gồm hai phòng
a) Phòng chuẩn bị dung dịch phản ứng và bảo quản sinh phẩm:
- Tủ lạnh để giữ hóa chất, sinh phẩm: 4oC và âm 20oC;
- Tủ an toàn sinh học có đèn UV và đèn chiếu sáng;
- Máy ly tâm ống nghiệm 1,5-2ml;
- Máy trộn lắc;
- Bộ pi pét và đầu côn có lọc dùng riêng để pha dung dịch phản ứng.
b) Phòng chuẩn bị mẫu để xử lý và tách chiết ADN/ARN:
- Tủ lưu mẫu (âm 20oC);
- Tủ an toàn sinh học có đèn UV và đèn chiếu sáng;
- Máy và ống ly tâm (loại 2 ml và 5 ml);
- Máy ủ nhiệt khô 600C và 1000C;
- Máy trộn lắc;
- Máy trộn xoay;
- Bộ pi pét dùng riêng cho phòng tách chiết;
- Ít nhất 02 bộ dụng cụ cắt mẫu hoặc đục lỗ DBS;
- Dung dịch khử trùng: nước Javel 10% và cồn 70 độ.
2. Khu vực thực hiện phản ứng PCR
- Máy PCR hoặc Real Time PCR;
- Tủ lạnh 40C để lưu các sản phẩm PCR.
3. Khu vực phân tích sản phẩm PCR
- Máy điện di và bộ nguồn;
- Dụng cụ đổ gel (khuôn gel, lược);
- Máy đọc phân tích gel;
- Dàn máy ELISA gồm máy rửa, máy ủ, máy đọc và máy in (trường hợp phân tích sản phẩm bằng kỹ thuật ELISA);
Máy li tâm nhỏ cho ống nghiệm 0,2 - 2ml;
- Bộ pi pét và các đầu côn có lọc.
II. CÁC TRANG THIẾT BỊ CẦN THIẾT
- Máy PCR hoặc Real Time PCR;
- Máy ly tâm tube 2-5 ml;
- Máy ly tâm tube 1,5-2ml;
- Máy ly tâm ống 0,2-2ml;
- Máy trộn lắc (Vortex Mixer);
- Máy trộn xoay (Rotator);
- Máy ủ nhiệt;
- Dàn máy ELISA gồm máy rửa, máy ủ, máy đọc và máy in (trường hợp phân tích sản phẩm bằng kỹ thuật ELISA);
- Tủ lạnh bảo quản bệnh phẩm và lưu mẫu (tủ lạnh âm 20o, âm 80o và tủ lạnh thường);
- Tủ an toàn sinh học;
- Bộ pi pét từ 0,1 l – 1000 l dùng trong các thao tác;
- Đồng hồ;
- Các dụng cụ tiêu hao cho kỹ thuật sinh học phân tử (đầu côn có lọc, ống nghiệm không có ADN/ARN, găng tay không bột...);
- Các phương tiện phòng hộ cho nhân viên.
PHIẾU XÉT NGHIỆM
PHÁT HIỆN NHIỄM HIV CHO TRẺ DƯỚI 18 THÁNG
(Ban hành kèm theo Quyết định số 1053/QĐ-BYT ngày 02 tháng 04 năm 2010 của Bộ trưởng Bộ Y tế)
| Phòng khám :……………………… Địa chỉ:………………………………. | Điện thoại:……………………….. Fax:……………………………….. Email:……………………………… |
PHIẾU XÉT NGHIỆM
PHÁT HIỆN NHIỄM HIV CHO TRẺ DƯỚI 18 THÁNG
| Họ và tên trẻ …………………………………. Họ và tên mẹ (hoặc người bảo trợ) ………….. Địa chỉ …………………………………………… | Giới tính: Nam £ Nữ £ Ngày sinh của trẻ: _ _/_ _/_ _ _ _ Nơi sinh của trẻ: ................................... |
| Phát hiện nhiễm HIV của mẹ | □ Trước khi mang thai □ Lúc có thai ..... tuần □ Lúc sinh □ Khác: | Mẹ đã được dùng ARV trước hoặc trong lúc sinh | □ Chưa □ Phòng LTMC Phác đồ........................... □ Điều trị ARV □ Khác: |
| Trẻ được nuôi bằng | □ Bú mẹ □ Sữa thay thế □ Kết hợp sữa mẹ và ăn thêm □ Khác: | Trẻ được dự phòng ARV ngay sau sinh | □ Không □ Có Phác đồ.................................................... Thời gian dùng ......................................... |
| Nếu trẻ có bú sữa mẹ | □ Đang bú mẹ □ Đã dừng bú mẹ □ Thời gian dừng bú mẹ ........ tuần □ Khác: ........................................... …………………………………………. | Trẻ có các triệu chứng nghi ngờ nhiễm HIV | □ Không □ Có Triệu chứng: .............................................................. ……………………………………………. |
| Trẻ được dùng Cotrimoxazole | □ Có □ Không | Kết quả xét nghiệm kháng thể kháng HIV | □ Dương tính □ Âm tính □ Chưa xét nghiệm |
Chỉ định xét nghiệm chẩn đoán nhiễm HIV
| □ Lần một Ngày: _ _/_ _/_ _ _ Giờ lấy máu: _ _ : _ _ |
| □ Lần hai Ngày: _ _/_ _/_ _ _ Giờ lấy máu: _ _ : _ _
Kết quả PCR lần 1: □ Âm tính □ Dương tính |
| □ Khác Ngày: _ _/_ _/_ _ _ Giờ lấy máu: _ _ : _ _
....................................... ....................................... |
| Cán bộ lấy mẫu |
Phòng xét nghiệm HIV/AIDS ghi
| Thời gian nhận mẫu: Giờ _ _ : _ _ Ngày _ _/_ _/_ _ _ Mã số người bệnh: _ _ _ _ _/_ _ _ _ Tình trạng mẫu: □ tốt □ không tốt Giải thích:…………………………………………………….. Cán bộ nhận mẫu:………………………………………….. |
| Trả lời kết quả xét nghiệm Kỹ thuật thực hiện:……………………………………….. Kết quả xét nghiệm: ....................................................................................... ……………………………………………………............... |
| Ngày tháng năm Cán bộ thực hiện xét nghiệm | Ngày tháng năm Trưởng Khoa xét nghiệm |
PHIẾU GỬI MẪU XÉT NGHIỆM PHÁT HIỆN NHIỄM HIV CHO TRẺ DƯỚI 18 THÁNG TUỔI
(Ban hành kèm theo Quyết định số 1053/QĐ-BYT ngày 02 tháng 04 năm 2010 của Bộ trưởng Bộ Y tế)
ĐƠN VỊ…………..
CỘNG HÒA XÃ HỘI CHỦ NGHĨA VIỆT NAM
Độc Lập - Tự Do - Hạnh Phúc
---------------------
Ngày tháng năm .
Kính gửi: …………………………………………………………………….
PHIẾU GỬI MẪU XÉT NGHIỆM PHÁT HIỆN NHIỄM HIV CHO TRẺ DƯỚI 18 THÁNG TUỔI
| STT | Họ, tên (Hoặc Mã số) | Ngày sinh | Giới | Địa chỉ | Kết quả xét nghiệm kháng thể (nếu có) | Chỉ định xét nghiệm PCR | Ngày lấy mẫu | Ghi chú | |||
| Nam | Nữ | lần 1 | lần 2 | khác | |||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| Trưởng phòng khám Ký, ghi rõ họ tên) | Người lập phiếu (Ký, ghi rõ họ tên) | Người nhận (Ký, ghi rõ họ tên) |
PHIẾU TRẢ LỜI KẾT QUẢ PHÁT HIỆN NHIỄM HIV CHO TRẺ DƯỚI 18 THÁNG TUỔI
(Ban hành kèm theo Quyết định số 1053/QĐ-BYT ngày 02 tháng 04 năm 2010 của Bộ trưởng Bộ Y tế)
ĐƠN VỊ…………
CỘNG HÒA XÃ HỘI CHỦ NGHĨA VIỆT NAM
Độc Lập - Tự Do - Hạnh Phúc
---------------------
Ngày tháng năm .
Kính gửi: …………………………………………………………………….
PHIẾU TRẢ LỜI KẾT QUẢ XÉT NGHIỆM PHÁT HIỆN NHIỄM HIV CHO TRẺ DƯỚI 18 THÁNG TUỔI
Ngày nhận mẫu: …………………………………………………………………………...
Ngày làm xét nghiệm: …………………………………………………………………….
Kỹ thuật xét nghiệm: ………………………………………………………………………
| TT | Họ tên/Mã số | Ngày sinh | Địa chỉ | Chỉ định xét nghiệm PCR | Ngày lấy mẫu | Kết quả xét nghiệm PCR | Ghi chú | |||
|
|
| Nam | Nữ |
| Lần 1 | Lần2 | Khác |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| Phụ trách phòng xét nghiệm (Ký, ghi rõ họ tên) | Thủ trưởng đơn vị (Ký, đóng dấu) |
BÁO CÁO BỆNH NHÂN DƯỚI 18 THÁNG TUỔI ĐƯỢC XÉT NGHIỆM PHÁT HIỆN NHIỄM HIV
(Ban hành kèm theo Quyết định số 1053/QĐ-BYT ngày 02 tháng 04 năm 2010 của Bộ trưởng Bộ Y tế)
ĐƠN VỊ…
CỘNG HÒA XÃ HỘI CHỦ NGHĨA VIỆT NAM
Độc lập - Tự do - Hạnh phúc
----------------------
BÁO CÁO BỆNH NHÂN DƯỚI 18 THÁNG TUỔI ĐƯỢC XÉT NGHIỆM PHÁT HIỆN NHIỄM HIV
| Phòng khám |
| Ngày tháng (ngày/tháng/năm) |
|
| Huyện |
| Báo cáo cho tháng (tháng/năm) |
|
| Tỉnh/Thành phố |
| Tống số trẻ được lấy mẫu để làm xét nghiệm PCR |
|
| Điện thoại liên hệ/ Email |
| Số xét nghiệm trung bình hàng tháng |
|
| Họ tên cán bộ lập báo cáo |
|
| STT | Số trẻ được làm xét nghiệm PCR | Số trẻ có kết quả PCR lần 1 dương tính | Số trẻ dưới 12 tháng tuổi có kết quả PCR lần 1 dương tính | Số trẻ dưới 12 tháng tuổi có kết quả PCR lần 1 dương tính được điều trị ARV | Số trẻ có kết quả PCR lần 2 dương tính | Số trẻ tử vong sau khi đăng kí nhưng chưa được điều trị ARV | Số trẻ mất dấu sau khi đăng kí | Số lượng trẻ dự tính được làm xét nghiệm PCR trong tháng tới | |
|
| PCR lần 1 | PCR lần 2 | |||||||
| (1) | (2) | (3) | (4) | (5) | (6) | (7) | (8) | (9) | (10) |
|
|
|
|
|
|
|
|
|
|
|
|
Nơi nhận: | CÁN BỘ BÁO CÁO | THỦ TRƯỞNG ĐƠN VỊ (Kí tên, đóng dấu)
|
BÁO CÁO TÌNH HÌNH SỬ DỤNG SINH PHẨM XÉT NGHIỆM PHÁT HIỆN NHIỄM HIV CHO TRẺ DƯỚI 18 THÁNG TUỔI
(Ban hành kèm theo Quyết định số 1053/QĐ-BYT ngày 02 tháng 04 năm 2010 của Bộ trưởng Bộ Y tế)
ĐƠN VỊ…
CỘNG HÒA XÃ HỘI CHỦ NGHĨA VIỆT NAM
Độc lập - Tự do - Hạnh phúc
--------------------------
Kính gửi:...................................
BÁO CÁO TÌNH HÌNH SỬ DỤNG SINH PHẨM XÉT NGHIỆM PHÁT HIỆN NHIỄM HIV CHO TRẺ DƯỚI 18 THÁNG TUỔI
| Tên cơ sở xét nghiệm |
| Ngày báo cáo |
|
| Quận/Huyện |
| Báo cáo cho tháng |
|
| Tỉnh/Thành |
| Tổng số trẻ được xét nghiệm trong tháng |
|
| Tổng số xét nghiệm có kết quả không xác định |
| ||
| Điện thoại liên hệ, Fax: Email : |
| Tổng số xét nghiệm có kết quả dương tính |
|
| Dự trù số xét nghiệm trong tháng tới |
|
| STT | Loại sinh phẩm | Số lô | Hạn dùng | Tồn đầu kỳ | Số bộ Test Kiểm toán nhận trong tháng | Sử dụng trong tháng | Số lượng hư hỏng/ hết hạn | Tồn cuối kỳ | Số test dự tính hết hạn trong 3 tháng tới | |||
| Bộ Test Kit | Test lẻ | Bộ Test Kit | Test lẻ | Bộ Test Kit | Test lẻ | |||||||
| (1) | (2) | (3) | (4) | (5) | (6) | (7) | (8) | (9) | (10) | (11) | (12) | (13) |
| 1 |
|
|
|
|
|
|
|
|
|
|
|
|
| 2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
Nơi nhận: | CÁN BỘ BÁO CÁO | THỦ TRƯỞNG ĐƠN VỊ (ký tên, đóng dấu) |
BÁO CÁO TÌNH HÌNH SỬ DỤNG BỘ DỤNG CỤ LẤY GIỌT MÁU KHÔ (DBS)
(Ban hành kèm theo Quyết định số 1053/QĐ-BYT ngày 02 tháng 04 năm 2010 của Bộ trưởng Bộ Y tế)
ĐƠN VỊ…
CỘNG HÒA XÃ HỘI CHỦ NGHĨA VIỆT NAM
Độc lập - Tự do - Hạnh phúc
----------------------
Kính gửi:...................................
BÁO CÁO TÌNH HÌNH SỬ DỤNG BỘ DỤNG CỤ LẤY GIỌT MÁU KHÔ (DBS)
| Tên cơ sở xét nghiệm |
| Ngày báo cáo |
|
| Quận/Huyện |
| Báo cáo cho tháng |
|
| Tỉnh/Thành |
| Tổng số trẻ được xét nghiệm DBS trong tháng |
|
| Điện thoại liên hệ, Fax: Email : |
| Tổng số trẻ nhận được kết quả ADN/ARN PCR |
|
| Dự trù số trẻ được lấy mẫu DBS trong tháng tới |
|
| STT | Chủng loại | Số lô | Hạn dùng | Tồn đầu kỳ | Nhận trong kỳ | Sử dụng trong tháng | Số lượng hư hỏng/ hết hạn | Tồn cuối kỳ | Số sinh phẩm sẽ hết hạn trong 6 tháng tới |
| (1) | (2) | (3) | (4) | (5) | (6) | (7) | (8) | (9) | (10) |
| 1. | Bộ lấy giọt máu khô đóng riêng lẻ (Single use DBS kits) |
|
|
|
|
|
|
|
|
| 2. | Bộ lấy giọt máu khô (DBS kits) |
|
|
|
|
|
|
|
|
| 3. | Gói hút ẩm |
|
|
|
|
|
|
|
|
| 4. | Giá phơi khô mẫu |
|
|
|
|
|
|
|
|
| 5. | Thẻ chỉ thị độ ẩm |
|
|
|
|
|
|
|
|
| 6. | Túi chuyên dụng có khóa kéo |
|
|
|
|
|
|
|
|
| 7. | Găng tay không bột |
|
|
|
|
|
|
|
|
| 8. | Lancet 2 mm |
|
|
|
|
|
|
|
|
|
Nơi nhận: | CÁN BỘ BÁO CÁO | THỦ TRƯỞNG ĐƠN VỊ (ký tên, đóng dấu) |
SƠ ĐỒ QUY TRÌNH XÉT NGHIỆM PHÁT HIỆN NHIỄM HIV CHO TRẺ DƯỚI 18 THÁNG TUỔI
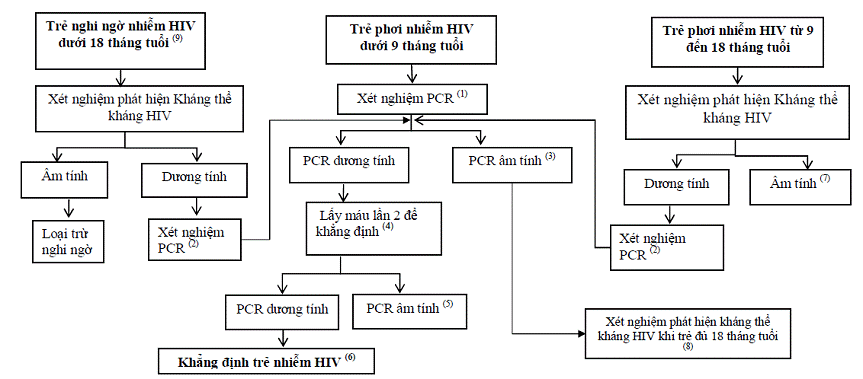
| (1) Làm xét nghiệm PCR cho trẻ từ 4 đến 6 tuần tuổi, hoặc ngay sau đó càng sớm càng tốt. (2) Nếu trẻ đủ tiêu chuẩn lâm sàng bệnh HIV nặng điều trị ngay bằng ARV, đồng thời xét nghiệm PCR. (3) Nếu trẻ hoàn toàn không bú sữa mẹ trong 6 tuần trước khi xét nghiệm, trẻ có thể không nhiễm HIV. Nếu trẻ có bú sữa mẹ, trẻ vẫn có nguy cơ phơi nhiễm HIV, làm lại xét nghiệm 6 tuần sau khi ngưng bú. (4) Tư vấn chăm sóc điều trị HIV/AIDS, điều trị theo Hướng dẫn chẩn đoán điều trị HIV/AIDS. (5) Phòng xét nghiệm làm lại xét nghiệm PCR trên các mẫu DBS còn lưu để khẳng định kết quả. Kết quả cuối cùng khẳng định dương tính, tiếp tục điều trị ARV. Kết quả cuối cùng khẳng định âm tính, dừng điều trị ARV. (6) Tiếp tục điều trị ARV theo quy định. (7) Nếu trẻ hoàn toàn không bú sữa mẹ đủ 6 tuần trước khi làm xét nghiệm, trẻ không nhiễm HIV. Nếu trẻ có bú sữa mẹ thực hiện lại xét nghiệm phát hiện kháng thể kháng HIV sau khi trẻ ngừng bú sữa mẹ đủ 6 tuần; nếu kết quả xét nghiệm kháng thể kháng HIV dương tính, thực hiện xét nghiệm PCR; nếu kết quả xét nghiệm kháng thể kháng HIV âm tính, trẻ không bị nhiễm HIV tại thời điểm xét nghiệm. (8) Nên làm lại xét nghiệm phát hiện kháng thể kháng HIV khi trẻ đủ 18 tháng tuổi (9) Nếu mẹ có xét nghiệm HIV dương tính, xử trí như trẻ phơi nhiễm |
- 1Công văn 5160/BYT-KCB năm 2013 tăng cường rà soát, chấn chỉnh và báo cáo thực hiện quy định, quy chế chuyên môn về xét nghiệm do Bộ Y tế ban hành
- 2Quyết định 5042/QĐ-BYT năm 2013 giao Viện Vệ sinh dịch tễ Trung ương xây dựng phương cách xét nghiệm HIV do Bộ trưởng Bộ Y tế ban hành
- 3Quyết định 2674/QĐ-BYT năm 2018 về hướng dẫn quốc gia xét nghiệm HIV do Bộ trưởng Bộ Y tế ban hành
- 1Nghị định 188/2007/NĐ-CP quy định chức năng, nhiệm vụ, quyền hạn và cơ cấu tổ chức của Bộ Y tế
- 2Quyết định 3003/QĐ-BYT năm 2009 Hướng dẫn chẩn đoán và điều trị HIV/AIDS do Bộ trưởng Bộ Y tế ban hành
- 3Thông tư 01/2010/TT-BYT quy định trách nhiệm, trình tự thông báo kết quả xét nghiệm HIV dương tính do Bộ Y tế ban hành
- 4Quyết định 4361/QĐ-BYT năm 2007 về Quy trình chăm sóc và điều trị dự phòng lây truyền HIV từ mẹ sang con do Bộ trưởng Bộ Y tế ban hành
- 5Công văn 5160/BYT-KCB năm 2013 tăng cường rà soát, chấn chỉnh và báo cáo thực hiện quy định, quy chế chuyên môn về xét nghiệm do Bộ Y tế ban hành
- 6Quyết định 5042/QĐ-BYT năm 2013 giao Viện Vệ sinh dịch tễ Trung ương xây dựng phương cách xét nghiệm HIV do Bộ trưởng Bộ Y tế ban hành
Quyết định 1053/QĐ-BYT năm 2010 ban hành Hướng dẫn xét nghiệm phát hiện nhiễm HIV cho trẻ em dưới 18 tháng tuổi do Bộ trưởng Bộ Y tế ban hành
- Số hiệu: 1053/QĐ-BYT
- Loại văn bản: Quyết định
- Ngày ban hành: 02/04/2010
- Nơi ban hành: Bộ Y tế
- Người ký: Trịnh Quân Huấn
- Ngày công báo: Đang cập nhật
- Số công báo: Dữ liệu đang cập nhật
- Ngày hiệu lực: 02/04/2010
- Tình trạng hiệu lực: Kiểm tra


