Để sử dụng toàn bộ tiện ích nâng cao của Hệ Thống Pháp Luật vui lòng lựa chọn và đăng ký gói cước.
| BỘ Y TẾ | CỘNG HÒA XÃ HỘI CHỦ NGHĨA VIỆT NAM |
| Số: 750/QĐ-QLD | Hà Nội, ngày 07 tháng 11 năm 2024 |
QUYẾT ĐỊNH
VỀ VIỆC BAN HÀNH QUY TRÌNH THAO TÁC CHUẨN TRONG HỆ THỐNG QUẢN LÝ CHẤT LƯỢNG THEO TIÊU CHUẨN ISO 9001:2015 ÁP DỤNG VÀO HOẠT ĐỘNG QUẢN LÝ NHÀ NƯỚC TẠI CỤC QUẢN LÝ DƯỢC
CỤC TRƯỞNG CỤC QUẢN LÝ DƯỢC
Căn cứ Nghị định số 95/2022/NĐ-CP ngày 15/11/2022 của Chính phủ quy định chức năng, nhiệm vụ, quyền hạn và cơ cấu tổ chức của Bộ Y tế;
Căn cứ Quyết định số 1969/QĐ-BYT ngày 26/4/2023 của Bộ trưởng Bộ Y tế quy định chức năng, nhiệm vụ, quyền hạn và cơ cấu tổ chức của Cục Quản lý Dược thuộc Bộ Y tế;
Căn cứ Quyết định số 388/QĐ-QLD ngày 29/5/2023 của Cục trưởng Cục Quản lý Dược về việc ban hành Quy định chức năng, nhiệm vụ, quyền hạn của Văn phòng và các phòng thuộc Cục Quản lý Dược;
Căn cứ yêu cầu thực tế công tác quản lý của Cục Quản lý Dược;
Theo đề nghị của Chánh Văn phòng Cục.
QUYẾT ĐỊNH:
Điều 1. Ban hành kèm theo Quyết định này Quy trình thao tác chuẩn trong Hệ thống quản lý chất lượng theo tiêu chuẩn ISO 9001:2015 áp dụng vào hoạt động quản lý nhà nước tại Cục Quản lý Dược, cụ thể:
Quy trình tiếp nhận, xử lý và cập nhật thông tin về an toàn, hiệu quả của thuốc liên quan đến hoạt động đăng ký thuốc (Mã số QT.ĐK.18.03 thay thế Quy trình mã số QT.ĐK.18.02).
Điều 2. Quyết định này có hiệu lực kể từ ngày ký ban hành.
Điều 3. Các Ông/bà: Lãnh đạo Cục, Lãnh đạo Ban QMS, Chánh Văn phòng, Trưởng các phòng thuộc Cục Quản lý Dược chịu trách nhiệm thi hành Quyết định này./.
|
| CỤC TRƯỞNG |
|
CỤC QUẢN LÝ DƯỢC
QUY TRÌNH
MÃ SỐ: QT.ĐK.18.03 | |||
|
| Người biên soạn | Người kiểm tra | Người phê duyệt |
| Họ và tên | Nguyễn Lan Phương | Nguyễn Văn Lợi | Vũ Tuấn Cường |
| Chữ ký |
|
|
|
|
CỤC QUẢN LÝ DƯỢC | QUY TRÌNH TIẾP NHẬN, XỬ LÝ VÀ CẬP NHẬT THÔNG TIN VỀ AN TOÀN, HIỆU QUẢ CỦA THUỐC LIÊN QUAN ĐẾN HOẠT ĐỘNG ĐĂNG KÝ THUỐC | Mã số: QT.ĐK.18.03 Ngày ban hành: 07/11/2024 Lần ban hành: 03 Tổng số trang: 11 |
| 1. Người có liên quan phải nghiên cứu và thực hiện đúng các nội dung của quy định này. 2. Nội dung trong quy trình này có hiệu lực thi hành như sự chỉ đạo của lãnh đạo Cục Quản lý Dược. 3. Mỗi đơn vị chỉ được phân phối 01 bản (có đóng dấu kiểm soát). Khi các đơn vị có nhu cầu phân phối thêm tài liệu phải đề nghị với Ban QMS để có bản đóng dấu có kiểm soát. File mềm được cung cấp trên mạng nội bộ để chia sẻ thông tin. | ||||||
| NƠI NHẬN (ghi rõ nơi nhận rồi đánh dấu X ô bên cạnh) | ||||||
|
| Lãnh đạo Cục |
| Phòng Đăng ký thuốc | |||
|
| Ban QMS |
| Phòng Quản lý chất lượng thuốc | |||
|
| Văn phòng Cục |
| Phòng Quản lý giá thuốc | |||
|
| Phòng Pháp chế - Hội nhập |
| Phòng Quản lý mỹ phẩm | |||
|
| Phòng Quản lý kinh doanh dược |
| Trung tâm Đào tạo và Hỗ trợ doanh nghiệp dược mỹ phẩm | |||
|
| Văn phòng NRA |
| Văn phòng Hội đồng tư vấn cấp GĐKLH thuốc, nguyên liệu làm thuốc | |||
| BẢNG THEO DÕI TÌNH TRẠNG SỬA ĐỔI | ||||||
| STT | Ngày sửa đổi | Vị trí sửa đổi | Nội dung sửa đổi | Ghi chú | ||
| 1 |
| Nơi nhận | Cập nhật chức năng, nhiệm vụ mới của Cục Quản lý Dược và của các phòng trong Cục |
| ||
| 2 |
| Phạm vi áp dụng | Điều chỉnh lại phạm vi áp dụng đúng với thực tế và cập nhật các văn bản hiện hành |
| ||
| 3 |
| Tài liệu tham chiếu | Cập nhật lại các văn bản quy phạm pháp luật có liên quan đăng ký thuốc |
| ||
| 4 |
| Trách nhiệm thực hiện | Cập nhật theo các SOP hiện hành |
| ||
| 5 |
| Định nghĩa và chữ viết tắt | Cập nhật theo các văn bản hiện hành |
| ||
| 6 |
| Toàn quy trình | Cập nhật phiên bản SOP hiện hành |
| ||
1. MỤC ĐÍCH
1.1. Quy trình này nhằm quy định thống nhất thực hiện việc tiếp nhận, xử lý và cập nhật thông tin về an toàn - hiệu quả của thuốc liên quan hoạt động đăng ký thuốc.
1.2. Để đảm bảo các thuốc được cấp phép lưu hành an toàn - hiệu quả cho người sử dụng.
2. PHẠM VI ÁP DỤNG
- Tất cả các lãnh đạo, cán bộ/chuyên viên Cục Quản lý Dược được phân công tham gia trong quá trình tiếp nhận, giải quyết, xử lý và thẩm định hồ sơ đăng ký thuốc.
- Quy trình này áp dụng để xử lý các thuốc đã được cấp phép lưu hành tại Việt Nam.
3. TÀI LIỆU THAM CHIẾU
- Luật Dược số 105/2016/QH13 ngày 06/4/2016.
- Thông tư số 08/2022/TT-BYT ngày 05/09/2022 của Bộ trưởng Bộ Y tế quy định việc ĐKLH thuốc, nguyên liệu làm thuốc.
- Thông tư số 16/2023/TT-BYT ngày 15/08/2023 quy định việc đăng ký lưu hành đối với thuốc gia công, thuốc chuyển giao công nghệ tại Việt Nam.
4. TRÁCH NHIỆM THỰC HIỆN
- Lãnh đạo Phòng Đăng ký thuốc có trách nhiệm thường xuyên kiểm tra, đôn đốc, tổ chức thực hiện theo đúng quy định tại quy trình này.
- Lãnh đạo Cục, Lãnh đạo Phòng Đăng ký thuốc và chuyên viên có liên quan của Phòng Đăng ký thuốc, Văn phòng Cục có trách nhiệm thực hiện và tuân thủ những quy định trong quy trình này.
- Lãnh đạo các phòng có liên quan trong Cục Quản lý Dược có trách nhiệm phối hợp, kiểm tra và bảo đảm những quy định trong quy trình này được thực hiện và tuân thủ.
- Các cán bộ, chuyên viên được phân công tham gia quá trình tiếp nhận, xử lý thông tin liên quan đến an toàn - hiệu quả của thuốc có trách nhiệm thực hiện và tuân thủ những quy định trong quy trình này.
5. ĐỊNH NGHĨA VÀ CHỮ VIẾT TẮT
5.1. Định nghĩa
- Quyết định cấp giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc: là văn bản hành chính do cơ quan có thẩm quyền ban hành danh mục các thuốc, nguyên liệu làm thuốc sản xuất trong nước hoặc nước ngoài được cấp giấy đăng ký lưu hành tại Việt Nam.
- Thông tin an toàn hiệu quả trong quá trình lưu hành: là các thông tin liên quan đến tính an toàn - hiệu quả của thuốc được theo dõi và tổng hợp trong suốt quá trình lưu hành của thuốc trên thị trường.
5.2 Chữ viết tắt:
- Cục QLD: Cục Quản lý Dược
- VPC: Văn phòng Cục
- ĐKT: Đăng ký thuốc
- LĐP: Lãnh đạo Phòng
- TP: Trưởng phòng
- PTP: Phó Trưởng phòng
- CV: Chuyên viên
- CG: Chuyên gia
- VB: Văn bản
- GĐKLH: Giấy đăng ký lưu hành
- TCMR: Chương trình tiêm chủng mở rộng
- AT-HQ: An toàn - Hiệu quả
- Trung tâm DI&ADR: Trung tâm thông tin thuốc và theo dõi phản ứng có hại của thuốc.
- Hội đồng: Hội đồng tư vấn cấp giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc
6. QUY ĐỊNH CHUNG:
6.1. Một số quy định chung
6.1.1. Quy trình tiếp nhận, xử lý và cập nhật thông tin về an toàn - hiệu quả của thuốc liên quan hoạt động đăng ký thuốc được thống nhất áp dụng và thực hiện chung cho tất cả các bộ phận có liên quan của Cục QLD.
6.1.2. Việc tiếp nhận văn bản/ thông tin về an toàn - hiệu quả của thuốc liên quan hoạt động đăng ký thuốc từ Văn phòng Cục vào các ngày làm việc trong tuần và thực hiện nhận theo QT.VP.22.01.
6.2. Nhiệm vụ và trách nhiệm của Lãnh đao Cục, TP ĐKT, PTP ĐKT, cán bộ, chuyên viên được phân công tham gia quá trình tiếp nhận, xử lý thông tin liên quan đến AT-HQ của thuốc
6.2.1. Lãnh đạo Cục phụ trách lĩnh vực đăng ký thuốc:
- Xem xét, rà soát đối với nội dung báo cáo về thông tin AT-HQ của thuốc dự kiến trình Hội đồng do Phòng Đăng ký thuốc đề xuất.
- Xem xét, ký công văn đề nghị cung cấp thông tin về AT-HQ của thuốc khi được Cục trưởng phân công.
- Xem xét và ký công văn chuyển Văn phòng Hội đồng nội dung báo cáo về thông tin AT-HQ của thuốc cần xin ý kiến Hội đồng khi được Cục trưởng phân công.
- Xem xét, ký công văn thông báo kết luận của Hội đồng đối với nội dung cập nhật an toàn, hiệu quả của thuốc khi được Cục trưởng phân công.
6.2.2. Trưởng phòng ĐKT:
Nhiệm vụ và trách nhiệm của Trưởng Phòng ĐKT trong quy trình này bao gồm:
- Xem xét nội dung báo cáo về thông tin AT-HQ của thuốc dự kiến trình Hội đồng, cho ý kiến về nội dung đề xuất, báo cáo của chuyên viên; rà soát và ký tắt nội dung đề xuất trình Hội đồng trên cơ sở tổng hợp của chuyên viên đầu mối.
- Rà soát, ký tắt công văn đề nghị cung cấp thông tin về AT-HQ của thuốc, cho ý kiến (nếu có) trên cơ sở tổng hợp của chuyên viên đầu mối.
- Ký Phiếu trình báo cáo Lãnh đạo Cục về nội dung báo cáo về thông tin AT-HQ của thuốc trình Hội đồng.
- Rà soát, ký tắt công văn thông báo kết luận của Hội đồng đối với nội dung cập nhật an toàn, hiệu quả của thuốc.
6.2.3 Phó Trưởng Phòng ĐKT: PTP ĐKT phụ trách một trong ba nhóm: nhóm thuốc sản xuất trong nước; nhóm thuốc nhập khẩu; nhóm vắc xin, sinh phẩm.
Nhiệm vụ và trách nhiệm của PTP ĐKT trong Quy trình này bao gồm:
- Xem xét nội dung báo cáo về thông tin AT-HQ của thuốc dự kiến trình Hội đồng, cho ý kiến về nội dung đề xuất, báo cáo của chuyên viên; rà soát và ký tắt nội dung đề xuất trình Hội đồng trên cơ sở tổng hợp của chuyên viên đầu mối theo sự phân công của Trưởng Phòng.
- Rà soát, ký tắt công văn đề nghị cung cấp thông tin về AT-HQ, cho ý kiến (nếu có) trên cơ sở tổng hợp của chuyên viên đầu mối.
- Rà soát, ký tắt công văn thông báo kết luận của Hội đồng đối với nội dung cập nhật an toàn, hiệu quả khi được Trưởng phòng phân công.
6.2.5. Cán bộ, chuyên viên được phân công đầu mối xử lý thông tin liên quan đến AT-HQ của thuốc:
- Thực hiện xem xét, phân loại, tìm kiếm thông tin về AT-HQ của thuốc.
- Dự thảo và ký tắt công văn đề nghị cung cấp thông tin (nếu có) gửi các đơn vị hoặc chuyên gia có liên quan.
- Dự thảo và ký tắt nội dung báo cáo về thông tin AT-HQ của thuốc dự kiến trình Hội đồng.
- Dự thảo và ký tắt văn bản thông báo kết luận của Hội đồng.
7. NỘI DUNG QUY TRÌNH
7.1 Sơ đồ quy trình:
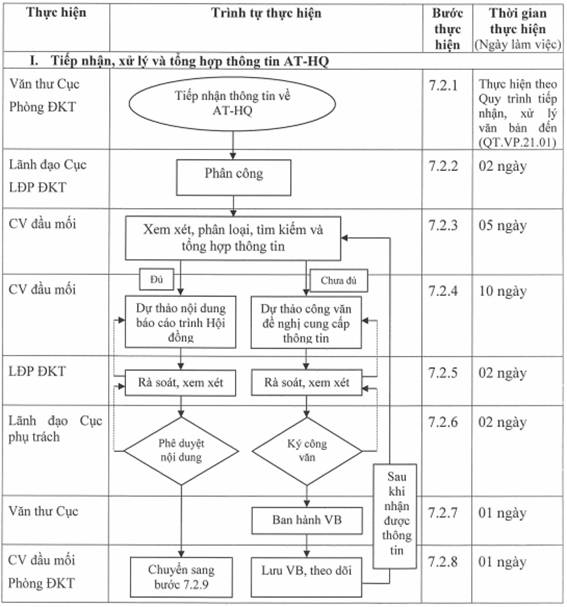
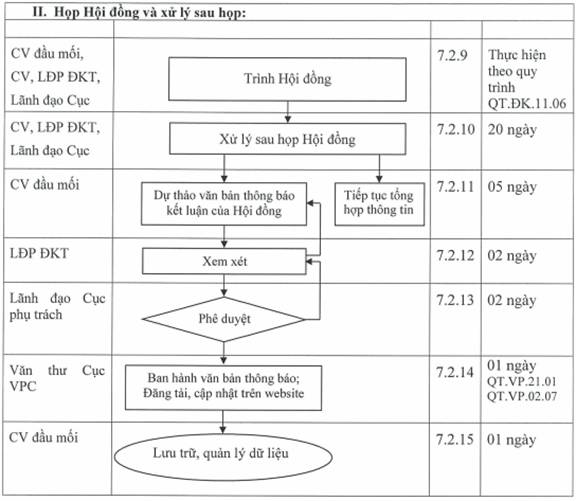
7.2. Mô tả các bước của quy trình
Phần I: Tiếp nhận, xử lý và tổng hợp thông tin về AT-HQ của thuốc
7.2.1 Tiếp nhận thông tin về an toàn, hiệu quả trong quá trình theo dõi hậu mại, cảnh giác dược:
Văn thư Cục/Phòng ĐKT tiếp nhận thông tin liên quan an toàn - hiệu quả của thuốc từ các nguồn khác nhau (qua văn bản, email, phương tiện truyền thông...):
- Trung tâm DI&ADR;
- Cục Y tế dự phòng, TCMR, các cơ sở sử dụng vắc xin cho tiêm chủng;
- Các doanh nghiệp; đơn vị, tổ chức liên quan;
- Các tổ chức quốc tế như Tổ chức Y tế thế giới (WHO), Liên minh toàn cầu về vaccine và tiêm chủng (GAVI),...;
- Cơ quan quản lý dược các nước;
- Các phòng khác trong Cục QLD;
- Các nguồn khác ...
Văn thư Cục/Phòng ĐKT tiếp nhận thông tin và báo cáo Lãnh đạo Cục.
7.2.2 Phân công của Lãnh đạo Cục và Lãnh đạo phòng:
- Lãnh đạo Cục phân công cho Phòng ĐKT giải quyết theo chức năng, nhiệm vụ của phòng.
- Lãnh đạo Phòng ĐKT phân công chuyên viên đầu mối xử lý theo bảng phân công nhiệm vụ.
- Thời gian thực hiện phân công: 02 ngày.
7.2.3 Xem xét, phân loại, tìm kiếm và tổng hợp thông tin:
- Chuyên viên đầu mối xem xét nội dung thông tin AT-HQ đã được tiếp nhận và phân loại thông tin thuộc loại thông tin về an toàn, hiệu quả của thuốc hay các thông tin khác. Đối với các thông tin liên quan đến chức năng, nhiệm vụ các phòng khác trong Cục, chuyên viên đầu mối dự thảo công văn trình lãnh đạo phòng chuyển các phòng liên quan để xử lý.
- Chuyên viên đầu mối rà soát, tổng hợp thông tin AT-HQ liên quan đến chức năng, nhiệm vụ của Phòng ĐKT:
+ Trường hợp thông tin đầy đủ: Thực hiện từ bước 7.2.4.1.
+ Trường hợp thông tin chưa có đủ căn cứ hay cần tìm hiểu thêm, cần đề nghị đơn vị liên quan cung cấp thông tin bổ sung: Thực hiện bước 7.2.4.2.
- Thời gian thực hiện: 05 ngày.
7.2.4 Đề xuất của chuyên viên đầu mối:
7.2.4.1. Trường hợp thông tin đầy đủ: Chuyên viên đầu mối dự thảo nội dung báo cáo về thông tin AT-HQ của thuốc dự kiến trình Hội đồng (có đề xuất cụ thể).
7.2.4.2. Trường hợp thông tin chưa đầy đủ căn cứ để xử lý tiếp theo: Chuyên viên đầu mối dự thảo công văn đề nghị các đơn vị liên quan cung cấp thông tin liên quan nội dung đang xử lý; cụ thể:
- Các đơn vị liên quan bao gồm:
+ Cục Y tế dự phòng, trung tâm DI&ADR;
+ Cơ sở đăng ký, cơ sở sản xuất, cơ sở khám chữa bệnh/cơ sở sử dụng thuốc.
+ WHO, các tổ chức quốc tế liên quan khác, cơ quan quản lý các nước;
+ Các đơn vị liên quan khác.
- Trường hợp cần thiết, có thể chuyển chuyên gia để cho ý kiến về nội dung thông tin AT-HQ của thuốc dự kiến trình Hội đồng.
* Thời gian thực hiện: 10 ngày.
7.2.5 Lãnh đạo phòng rà soát, xem xét đề xuất của chuyên viên đầu mối:
- Lãnh đạo Phòng rà soát, xem xét nội dung báo cáo về thông tin AT-HQ của thuốc dự kiến trình Hội đồng (trong trường hợp thông tin đầy đủ) hoặc dự thảo công văn đề nghị cung cấp thông tin (trong trường hợp thông tin chưa đủ căn cứ để xử lý tiếp theo):
+ Nếu đồng ý, ký tắt để trình Lãnh đạo Cục xem xét.
+ Nếu chưa đồng ý, chuyển lại chuyên viên đầu mối để bổ sung, chỉnh sửa nội dung đề xuất.
- Thời gian thực hiện: 02 ngày.
7.2.6 Lãnh đạo Cục phụ trách phê duyệt nội dung đề xuất:
7.2.6.1 Trường hợp thông tin đầy đủ: Lãnh đạo Cục xem xét dự thảo nội dung báo cáo về thông tin AT-HQ của thuốc dự kiến trình Hội đồng:
- Nếu đồng ý, phê duyệt nội dung báo cáo về thông tin AT-HQ của thuốc cần xin ý kiến Hội đồng và chuyển sang bước 7.2.9.
- Nếu chưa đồng ý, chuyển lại Phòng ĐKT để bổ sung, chỉnh sửa nội dung báo cáo.
7.2.6.2. Trường hợp thông tin chưa đầy đủ: Lãnh đạo Cục xem xét dự thảo công văn đề nghị các đơn vị cung cấp thông tin hoặc chuyển chuyên gia đề nghị cho ý kiến liên quan nội dung đang xử lý:
- Nếu đồng ý, ký công văn đề nghị.
- Nếu chưa đồng ý, chuyển lại Phòng ĐKT để bổ sung, chỉnh sửa dự thảo công văn.
* Thời gian thực hiện: 02 ngày.
7.2.7 Ban hành văn bản
- Văn thư Cục ban hành công văn đề nghị cung cấp thông tin gửi các đơn vị có liên quan theo Quy trình tiếp nhận, xử lý văn bản đến (QT.VP.21.01).
- Thời gian thực hiện: 01 ngày.
7.2.8 Lưu và theo dõi văn bản
- Chuyên viên đầu mối lưu công văn đề nghị cung cấp thông tin gửi các đơn vị có liên quan sau khi được ban hành.
- Chuyên viên đầu mối theo dõi, sau khi nhận được văn bản trả lời của chuyên gia hoặc các đơn vị có liên quan, tiếp tục tổng hợp thông tin (chuyển lại từ bước 7.2.3 để thực hiện).
- Thời gian thực hiện: 01 ngày.
Phần II: Họp Hội đồng và xử lý sau họp Hội đồng
7.2.9 Trình Hội đồng xem xét, kết luận:
- Sau khi tổng hợp đầy đủ dữ liệu liên quan AT-HQ của thuốc, Phòng ĐKT sẽ trình Hội đồng xem xét.
- Thời gian thực hiện và các bước thực hiện cụ thể: thực hiện theo Quy trình Quy trình giải quyết hồ sơ cấp giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc (QT.ĐK.11.06).
7.2.10 Xử lý sau họp Hội đồng:
- Sau khi Hội đồng thảo luận và thống nhất nội dung để đưa ra kết luận đối với nội dung cập nhật an toàn, hiệu quả, Cục QLD (Phòng ĐKT) thực hiện các bước tiếp theo theo kết luận của Hội đồng.
+ Trường hợp cần thêm các dữ liệu để có cơ sở quyết định tại cuộc họp Hội đồng, Phòng ĐKT sẽ tiếp tục bổ sung thông tin theo đề nghị của Hội đồng và sẽ trình lại Hội đồng vào đợt họp tiếp theo (chuyển lại từ bước 7.2.3 để thực hiện).
+ Trường hợp kết luận cuối cùng của Hội đồng yêu cầu có văn bản thông báo cho các đơn vị đối với nội dung cập nhật an toàn, hiệu quả: chuyển sang bước 7.2.11.
- Thời gian thực hiện: 20 ngày.
7.2.11 Dự thảo văn bản thông báo kết luận của Hội đồng
- Sau khi nhận được biên bản họp có kết luận của Hội đồng, chuyên viên đầu mối dự thảo văn bản thông báo nội dung kết luận của Hội đồng.
- Thời gian thực hiện: 05 ngày.
7.2.12 Xem xét dự thảo văn bản thông báo kết luận của Hội đồng
- Lãnh đạo Phòng rà soát, xem xét dự thảo văn bản thông báo nội dung kết luận của Hội đồng:
+ Nếu đồng ý, ký tắt để trình Lãnh đạo Cục xem xét.
+ Nếu chưa đồng ý, chuyển lại chuyên viên đầu mối để bổ sung, chỉnh sửa.
- Thời gian thực hiện: 02 ngày.
7.2.13 Phê duyệt dự thảo văn bản thông báo kết luận của Hội đồng
- Lãnh đạo Cục phụ trách xem xét dự thảo văn bản thông báo nội dung kết luận của Hội đồng:
+ Nếu đồng ý, ký văn bản thông báo cho các đơn vị đối với nội dung cập nhật an toàn, hiệu quả của thuốc theo kết luận của Hội đồng.
+ Nếu chưa đồng ý, chuyển lại Phòng ĐKT để bổ sung, chỉnh sửa dự thảo.
- Thời gian thực hiện: 02 ngày.
7.2.14 Ban hành văn bản và đăng tải, cập nhật thông tin trên website Cục QLD:
- Văn thư Cục ban hành văn bản theo Quy trình tiếp nhận, xử lý văn bản đến (QT.VP.21.01).
- Đối với văn bản thông báo cho các đơn vị về nội dung cập nhật an toàn, hiệu quả của thuốc theo kết luận của Hội đồng, Văn phòng Cục thực hiện đăng tải, cập nhật thông tin trên website của Cục QLD theo Quy trình đăng tải, cập nhật thông tin trên trang thông tin điện tử tổng hợp của Cục QLD (QT.VP.02.07).
- Thời gian thực hiện: 01 ngày.
7.2.15 Lưu trữ, quản lý dữ liệu:
- Chuyên viên đầu mối thực hiện việc lưu trữ, quản lý tài liệu liên quan đến việc xử lý thông tin an toàn - hiệu quả theo quy định chung (bao gồm cả các hồ sơ bản giấy và dữ liệu mềm).
- Thời gian thực hiện: 01 ngày.
Quyết định 750/QĐ-QLD năm 2024 về Quy trình thao tác chuẩn trong Hệ thống quản lý chất lượng theo tiêu chuẩn ISO 9001:2015 áp dụng vào hoạt động quản lý Nhà nước tại Cục Quản lý Dược
- Số hiệu: 750/QĐ-QLD
- Loại văn bản: Quyết định
- Ngày ban hành: 07/11/2024
- Nơi ban hành: Cục Quản lý dược
- Người ký: Vũ Tuấn Cường
- Ngày công báo: Đang cập nhật
- Số công báo: Đang cập nhật
- Ngày hiệu lực: 07/11/2024
- Tình trạng hiệu lực: Kiểm tra



