Để sử dụng toàn bộ tiện ích nâng cao của Hệ Thống Pháp Luật vui lòng lựa chọn và đăng ký gói cước.
| BỘ Y TẾ | CỘNG HÒA XÃ HỘI CHỦ NGHĨA VIỆT NAM |
| Số: 2834/QĐ-BYT | Hà Nội, ngày 09 tháng 06 năm 2021 |
QUYẾT ĐỊNH
BAN HÀNH HƯỚNG DẪN THỰC HIỆN XÉT NGHIỆM PHÁT HIỆN NHIỄM MỚI HIV VÀ SỬ DỤNG SỐ LIỆU XÉT NGHIỆM PHÁT HIỆN NHIỄM MỚI HIV TRONG PHÒNG CHỐNG HIV/AIDS
BỘ TRƯỞNG BỘ Y TẾ
Căn cứ Luật “Phòng, chống nhiễm vi rút gây ra Hội chứng suy giảm miễn dịch mắc phải ở người (HIV/AIDS)”;
Căn cứ Nghị định số 75/2017/NĐ-CP ngày 20 tháng 6 năm 2017 của Chính phủ quy định chức năng, nhiệm vụ, quyền hạn và cơ cấu tổ chức của Bộ Y tế;
Căn cứ Nghị định số 75/2016/NĐ-CP ngày 01 tháng 7 năm 2016 của Chính phủ quy định điều kiện thực hiện xét nghiệm HIV và Nghị định số 155/2018/NĐ-CP ngày 11 tháng 12 năm 2018 của Chính phủ về việc sửa đổi bổ sung một số quy định liên quan đến điều kiện đầu tư kinh doanh thuộc phạm vi quản lý nhà nước của Bộ Y tế;
Căn cứ Quyết định số 2520/QĐ-BYT ngày 15 tháng 6 năm 2020 của Bộ Y tế về việc ban hành Kế hoạch triển khai mở rộng xét nghiệm nhiễm mới HIV;
Theo đề nghị của Cục trưởng Cục Phòng, chống HIV/AIDS, Bộ Y tế.
QUYẾT ĐỊNH:
Điều 1. Ban hành kèm theo Quyết định này “Hướng dẫn thực hiện xét nghiệm phát hiện nhiễm mới HIV và sử dụng số liệu xét nghiệm phát hiện nhiễm mới HIV trong phòng chống HIV/AIDS”.
Điều 2. Quyết định này có hiệu lực kể từ ngày ký, ban hành.
Điều 3. Các ông/bà: Chánh Văn phòng Bộ, Cục trưởng, Vụ trưởng, Tổng Cục trưởng các Vụ, Cục, Tổng cục, Thủ trưởng các đơn vị trực thuộc Bộ Y tế, Giám đốc Sở Y tế các tỉnh/thành phố trực thuộc Trung ương và Thủ trưởng các đơn vị liên quan chịu trách nhiệm thi hành Quyết định này./.
|
| KT. BỘ TRƯỞNG |
HƯỚNG DẪN
THỰC HIỆN XÉT NGHIỆM PHÁT HIỆN NHIỄM MỚI HIV VÀ SỬ DỤNG SỐ LIỆU XÉT NGHIỆM PHÁT HIỆN NHIỄM MỚI HIV TRONG PHÒNG, CHỐNG HIV/AIDS
(Ban hành kèm theo Quyết định số 2834/QĐ-BYT, ngày 09 tháng 6 năm 2021 của Bộ Y tế)
Phần I.
QUY ĐỊNH CHUNG
1. Hướng dẫn này quy định một số vấn đề sau
a. Phương pháp và kỹ thuật thực hiện xét nghiệm phát hiện nhiễm mới HIV.
b. Sử dụng kết quả xét nghiệm phát hiện nhiễm mới HIV trong tăng cường tư vấn xét nghiệm cho bạn tình, bạn chích chung của ca nhiễm mới HIV và cung cấp bằng chứng để đề xuất, triển khai các can thiệp dự phòng và điều trị phù hợp.
2. Đối tượng áp dụng
a. Hướng dẫn này áp dụng cho các cơ sở y tế triển khai xét nghiệm phát hiện nhiễm mới HIV theo Quyết định số 2520/QĐ-BYT ngày 15/6/2020 của Bộ Y tế về việc ban hành Kế hoạch triển khai mở rộng xét nghiệm phát hiện nhiễm mới HIV.
b. Thực hiện xét nghiệm phát hiện nhiễm mới HIV cho tất cả các trường hợp đồng ý xét nghiệm và có kết quả xét nghiệm khẳng định HIV dương tính. Lưu ý cho các đối tượng thuộc nhóm có hành vi nguy cơ cao, bao gồm nam quan hệ tình dục đồng giới (MSM), người chuyển giới nữ, người nghiện chích ma túy (NCMT), phụ nữ bán dâm, bạn tình, bạn chích chung của người nhiễm HIV và các nhóm có hành vi nguy cơ cao.
3. Nguyên tắc thực hiện tư vấn và xét nghiệm phát hiện nhiễm mới HIV
a. Tư vấn xét nghiệm phát hiện nhiễm mới HIV được lồng ghép vào quy trình cung cấp dịch vụ tư vấn xét nghiệm HIV tại cơ sở y tế cho tất cả các đối tượng xét nghiệm HIV.
b. Xét nghiệm phát hiện nhiễm mới HIV chỉ được thực hiện tại các cơ sở y tế được cấp giấy chứng nhận đủ điều kiện khẳng định các trường hợp HIV dương tính theo quy định và với các mẫu đã có kết quả khẳng định HIV dương tính do cơ sở y tế gửi.
c. Không nên thực hiện xét nghiệm nhiễm mới HIV cho các trường hợp sau:
- Người nhiễm HIV đã từng hoặc đang điều trị ARV ≥ 01 tháng.
- Người có hành vi nguy cơ cao đang điều trị PrEP.
- Người đã có kết quả xét nghiệm khẳng định HIV dương tính ≥ 01 năm.
- Người nhiễm HIV có các biểu hiện lâm sàng của việc nhiễm trùng cơ hội, nhiễm HIV ở giai đoạn 3 hoặc 4.
d. Không thông báo và không trả kết quả xét nghiệm phát hiện nhiễm mới HIV cho đối tượng làm xét nghiệm.
4. Một số khái niệm
4.1. Nhiễm mới HIV: là tình trạng nhiễm HIV được xác định sau khi HIV xâm nhập vào cơ thể đến trước 12 tháng hoặc xác định theo các dấu ấn sinh học quan sát được.
4.2. Xét nghiệm phát hiện nhiễm mới HIV: là phương pháp áp dụng các kỹ thuật xét nghiệm HIV để phân biệt một trường hợp đã khẳng định HIV dương tính là nhiễm mới hoặc nhiễm lâu.
4.3. Phương pháp phát hiện nhiễm mới HIV:
a. Xét nghiệm nhiễm mới HIV bằng sinh phẩm nhanh (RTRI - Rapid Test for Recent Infection): sử dụng sinh phẩm nhanh để xét nghiệm sàng lọc phát hiện nhiễm mới HIV trong các mẫu đã được khẳng định HIV dương tính.
b. Phương cách xét nghiệm nhiễm mới HIV (RITA - Recent Infection Testing Algorithm): là sự kết hợp kết quả của một hay nhiều xét nghiệm khác nhau hoặc kết hợp kết quả các xét nghiệm với các thông tin lâm sàng để phân loại một trường hợp đã nhiễm HIV là nhiễm mới hay nhiễm lâu.
4.4. Sử dụng số liệu phát hiện nhiễm mới HIV:
Kết quả nhiễm mới HIV nhằm cung cấp các bằng chứng khoa học cho chương trình phòng, chống HIV/AIDS, cụ thể như sau:
a. Đáp ứng ở cấp độ quần thể: cung cấp dữ liệu cấp độ quần thể về nhiễm mới HIV để phân tích nhóm có hành vi nguy cơ lây nhiễm HIV, xác định điểm nóng cần lập kế hoạch dự phòng và đáp ứng y tế công cộng.
b. Đáp ứng ở cấp độ cá nhân: giúp nhân viên y tế xác định ưu tiên và tư vấn tăng cường, hiệu quả trong việc tìm ra các ca nhiễm HIV khác, kết hợp đồng bộ việc chăm sóc điều trị ngay, can thiệp dự phòng, chuyển gửi ưu tiên và giám sát chủ động.
Phần II.
HƯỚNG DẪN THỰC HIỆN XÉT NGHIỆM PHÁT HIỆN NHIỄM MỚI HIV
MỤC I. TƯ VẤN XÉT NGHIỆM NHIỄM MỚI HIV
I. Tư vấn trước xét nghiệm nhiễm mới HIV
1. Đối tượng từ nguồn xét nghiệm sàng lọc tại cộng đồng chuyển đến
a. Tư vấn bổ sung cho đối tượng:
- Giải thích nguy cơ lây nhiễm HIV ở giai đoạn mới nhiễm HIV.
- Ý nghĩa, lợi ích của xét nghiệm phát hiện nhiễm mới HIV nhằm phục vụ mục đích giám sát dịch và khống chế dịch.
- Giới thiệu quy trình thực hiện và các xét nghiệm tiếp theo.
- Các yếu tố ảnh hưởng đến kết quả xét nghiệm nhiễm mới HIV.
b. Quản lý thông tin tư vấn xét nghiệm phát hiện nhiễm mới HIV thực hiện như sau:
- Hoàn thiện phiếu đồng ý xét nghiệm HIV theo quy định tại phụ lục số 01 ban hành kèm theo Hướng dẫn này.
- Thu thập và điền các thông tin đối tượng đến tư vấn theo quy định tại phụ lục số 02 ban hành kèm theo Hướng dẫn này.
- Ghi chép thông tin “Đối tượng đồng ý thực hiện xét nghiệm phát hiện nhiễm mới HIV” vào phiếu gửi mẫu xét nghiệm được quy định tại mục 1 phụ lục số 03 ban hành kèm theo Hướng dẫn này.
c. Chuyển gửi đối tượng đến bộ phận lấy mẫu và thực hiện xét nghiệm.
2. Đối tượng tới cơ sở y tế
a. Thực hiện việc tư vấn bổ sung về xét nghiệm nhiễm mới HIV cho đối tượng xét nghiệm sàng lọc HIV có phản ứng thực hiện theo quy định tại điểm a, khoản 1 mục này.
b. Quản lý thông tin tư vấn xét nghiệm phát hiện nhiễm mới thực hiện theo quy định tại điểm b, khoản 1 mục này.
c. Chuyển gửi đối tượng đến bộ phận lấy mẫu và thực hiện xét nghiệm HIV.
II. Tư vấn sau xét nghiệm nhiễm mới HIV
Kết quả xét nghiệm phát hiện nhiễm mới HIV chỉ được thông báo cho cán bộ tư vấn để tăng cường các giải pháp can thiệp phù hợp cho đối tượng.
1. Nội dung tư vấn
a. Thực hiện tư vấn sau xét nghiệm HIV theo các quy định hiện hành.
b. Tư vấn bổ sung các nội dung tăng cường theo mục I, phần III của Hướng dẫn này về hướng dẫn sử dụng kết quả xét nghiệm phát hiện nhiễm mới HIV.
2. Quản lý thông tin tư vấn xét nghiệm HIV
Ghi chép vào sổ tư vấn các thông tin về kết quả xét nghiệm HIV và giới thiệu chuyển gửi các dịch vụ dự phòng, điều trị sau xét nghiệm.
MỤC II. XÉT NGHIỆM PHÁT HIỆN NHIỄM MỚI HIV
I. Lấy mẫu, đóng gói, vận chuyển và sử dụng mẫu bệnh phẩm
Nếu đối tượng có kết quả sàng lọc HIV dương tính và đồng ý thực hiện xét nghiệm phát hiện nhiễm mới HIV:
1. Lấy mẫu:
- Lấy 06 ml máu toàn phần vào ống có chứa chất chống đông theo quy trình lấy mẫu quy định tại phụ lục 04 ban hành kèm theo Hướng dẫn này.
- Ly tâm tách huyết tương.
2. Đóng gói:
Quy trình đóng gói thực hiện theo các quy định tại phụ lục 04 ban hành kèm theo Hướng dẫn này.
3. Vận chuyển mẫu:
- Vận chuyển mẫu xét nghiệm tới phòng xét nghiệm khẳng định các trường hợp HIV dương tính cùng với phiếu vận chuyển theo đúng Quyết định 2674/QĐ-BYT ngày 27/4/2018 của Bộ Y tế về Hướng dẫn quốc gia xét nghiệm HIV.
- Điền nội dung “xét nghiệm nhiễm mới HIV” vào cột ghi chú trong phiếu gửi mẫu được quy định tại mục 1, phụ lục 03 ban hành kèm theo Hướng dẫn này.
4. Sử dụng mẫu: theo quy định tại phụ lục 04 ban hành kèm theo Hướng dẫn này.
II. Trình tự thực hiện xét nghiệm nhiễm mới HIV
1. Xét nghiệm khẳng định HIV
Thực hiện xét nghiệm khẳng định HIV theo quy định tại mục III chương I phần II Quyết định số 2674/QĐ-BYT .
2. Xét nghiệm phát hiện nhiễm mới HIV bằng sinh phẩm nhanh
a. Chỉ thực hiện xét nghiệm phát hiện nhiễm mới HIV cho các mẫu có đề nghị làm xét nghiệm nhiễm mới HIV ghi trên phiếu gửi mẫu xét nghiệm.
b. Thực hiện xét nghiệm nhiễm mới HIV theo hướng dẫn của nhà sản xuất và quy trình quy định tại mục IV phần này.
c. Trả kết quả xét nghiệm khẳng định HIV dương tính và kết quả xét nghiệm nhiễm mới HIV bằng sinh phẩm xét nghiệm nhanh cho cơ sở y tế nơi đã gửi mẫu.
d. Đóng gói vận chuyển mẫu huyết tương còn lại của các mẫu có kết quả nhiễm mới HIV bằng sinh phẩm nhanh và gửi tới cơ sở thực hiện xét nghiệm tải lượng HIV theo phân vùng chuyển mẫu xét nghiệm tải lượng HIV.
3. Xét nghiệm tải lượng HIV
Cơ sở xét nghiệm tải lượng HIV thực hiện xét nghiệm theo quy định tại Quyết định số 1112/QĐ-BYT ngày 26/3/2019 của Bộ Y tế về việc ban hành Hướng dẫn xét nghiệm tải lượng HIV trong theo dõi điều trị HIV/AIDS và trả kết quả xét nghiệm tải lượng HIV cho cơ sở gửi mẫu.
4. Nhận kết quả xét nghiệm tải lượng HIV
a. Phòng xét nghiệm khẳng định HIV nhận kết quả xét nghiệm tải lượng HIV và ghi chép vào sổ xét nghiệm khẳng định HIV.
b. Trả kết quả xét nghiệm tải lượng HIV cho cơ sở tư vấn xét nghiệm nơi đã gửi mẫu đồng thời chuyển một bản sao kết quả xét nghiệm tải lượng HIV này cho cơ sở điều trị ARV (nếu đối tượng đã chuyển gửi sang cơ sở điều trị).
5. Phân tích biện luận kết quả xét nghiệm nhiễm mới HIV
a. Kết quả xét nghiệm phát hiện nhiễm mới bằng sinh phẩm nhanh (RTRI) là kết quả sàng lọc tình trạng nhiễm mới HIV ban đầu.
b. Để kết luận một trường hợp nhiễm mới HIV cần sử dụng phương cách xét nghiệm kết hợp kết quả xét nghiệm nhiễm mới HIV bằng sinh phẩm xét nghiệm nhanh với kết quả xét nghiệm tải lượng HIV (hay còn gọi là phương cách xét nghiệm RITA) đồng thời khẳng định đối tượng chưa từng điều trị ARV có thể phân tích và biện luận kết quả như sau:
- Đối với đối tượng có kết quả xét nghiệm nhiễm mới HIV với sinh phẩm nhanh và kết quả xét nghiệm tải lượng HIV ≥1.000 bản sao/ml thì ghi nhận đối tượng nhiễm mới HIV (hay còn gọi là “nhiễm mới HIV”).
- Đối với đối tượng có kết quả xét nghiệm nhiễm mới HIV bằng sinh phẩm xét nghiệm nhanh và có kết quả xét nghiệm tải lượng HIV <1.000 bản sao/ml thì ghi nhận đối tượng nhiễm HIV lâu (hay còn gọi là “nhiễm lâu”) trừ các trường hợp được quy định tại điểm c mục này.
c. Lưu ý một số trường hợp sau:
- Khi kết quả xét nghiệm bằng sinh phẩm nhanh phát hiện nhiễm mới HIV cho kết quả âm tính với HIV, tiến hành kiểm tra lại quy trình lấy mẫu xét nghiệm xem có nhầm lẫn, sai sót không, khi cần có thể xét nghiệm khẳng định lại hoặc lấy mẫu lại.
- Khi đối tượng có kết quả xét nghiệm nhiễm mới HIV bằng sinh phẩm nhanh và có kết quả xét nghiệm tải lượng HIV <1.000 bản sao/ml, đồng thời có bằng chứng xác định đối tượng nhiễm HIV dưới 12 tháng (những đối tượng được nghiên cứu theo dõi thuần tập, khi điều trị PrEP hoặc Methadone) thì ghi nhận đối tượng là nhiễm mới HIV.
- Khi đối tượng có kết quả xét nghiệm nhiễm mới HIV bằng sinh phẩm nhanh và cơ sở y tế không tiếp cận được với xét nghiệm tải lượng HIV, sử dụng xét nghiệm CD4 và các yếu tố liên quan đến lâm sàng để loại trừ, có thể sử dụng kết quả xét nghiệm nhiễm mới bằng sinh phẩm nhanh để ghi nhận báo cáo giám sát.
6. Ghi chép kết quả xét nghiệm phát hiện nhiễm mới HIV
a. Ghi bổ sung vào cột ghi chú của sổ xét nghiệm sàng lọc, sổ xét nghiệm khẳng định HIV (mục 2, 3, phụ lục 03, Hướng dẫn này): ghi chép kết quả xét nghiệm phát hiện nhiễm mới bằng sinh phẩm nhanh và kết quả xét nghiệm tải lượng HIV (nếu có).
b. Phiếu trả lời kết quả xét nghiệm phát hiện nhiễm mới HIV: thực hiện theo mục 4, phụ lục 03 Hướng dẫn này.
III. Quản lý số liệu xét nghiệm nhiễm mới HIV
1. Sử dụng bộ công cụ quản lý số liệu để cập nhật, theo dõi, phân tích và báo cáo dữ liệu nhiễm mới HIV.
2. Dữ liệu nhiễm mới HIV được quản lý theo từng trường hợp, phân tích báo cáo sử dụng theo hệ thống quản lý dữ liệu tuân thủ tính bảo mật thông tin.
3. Các cơ sở xét nghiệm tham gia vào quá trình xét nghiệm phát hiện nhiễm mới HIV có trách nhiệm cập nhật dữ liệu ngay sau khi có kết quả xét nghiệm.
4. Sau khi có số liệu xét nghiệm phát hiện nhiễm mới HIV, bộ phận quản lý dữ liệu HIV/AIDS có trách nhiệm rà soát đối chiếu và loại bỏ các trường hợp nhiễm HIV đã được quản lý trên phần mềm HIV info để lập danh sách các trường hợp nhiễm mới HIV.
5. Chia sẻ, sử dụng số liệu phát hiện nhiễm mới HIV để đánh giá phân tích tình hình dịch và đề xuất các đáp ứng y tế công cộng.
IV. Sơ đồ thực hiện xét nghiệm phát hiện nhiễm mới HIV (RITA)
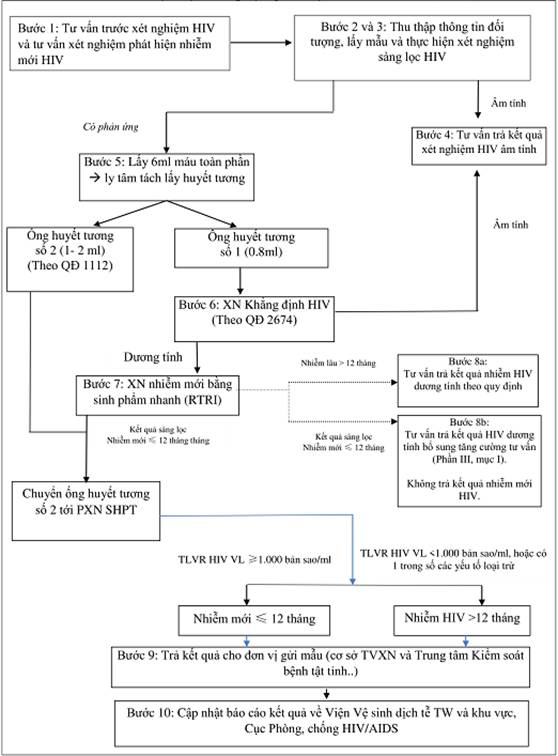
Phần III.
SỬ DỤNG KẾT QUẢ XÉT NGHIỆM PHÁT HIỆN NHIỄM MỚI HIV
I. Đáp ứng với trường hợp có kết quả xét nghiệm nhiễm mới HIV
Cần ưu tiên nhân lực có kinh nghiệm, thời gian và chủ động thực hiện ngay các hoạt động sau:
1. Tiếp cận, tư vấn, chuyển gửi và điều trị ARV trong ngày. Trường hợp không điều trị ARV được trong ngày cần hỗ trợ liên tục cho đến khi được điều trị ARV.
2. Tư vấn xét nghiệm bạn tình, bạn chích của ca nhiễm mới HIV theo phụ lục 05, Hướng dẫn này.
3. Chuyển gửi ngay bạn tình, bạn chích có kết quả xét nghiệm HIV âm tính tới dịch vụ PrEP và các dịch vụ dự phòng khác.
4. Chuyển gửi bạn tình, bạn chích có kết quả xét nghiệm HIV dương tính tới điều trị ARV và tiếp tục tư vấn bạn tình, bạn chích cho các trường hợp HIV dương tính này.
II. Đáp ứng với địa bàn cấp huyện có trường hợp nhiễm mới HIV
Các huyện chỉ cần có 01 trường hợp nhiễm mới HIV qua xét nghiệm sàng lọc bằng sinh phẩm nhanh phải triển khai các giải pháp ngăn chặn sự gia tăng nhiễm mới HIV.
1. Đánh giá nguy cơ trên địa bàn có ca nhiễm mới
1.1. Yếu tố nguy cơ: Nhóm đối tượng, quy mô quần thể nguy cơ, điều kiện thuận lợi làm lây nhiễm HIV
- Tính toán tỷ lệ phần trăm nhiễm mới HIV (%).
- Xác định thời điểm xuất hiện các trường hợp nhiễm mới HIV.
- Phân tích dịch tễ học nhiễm mới HIV theo nhóm tuổi, giới, yếu tố/hành vi nguy cơ.
- Xác định nguồn phát hiện nhiễm mới HIV (phòng khám ngoại trú, cộng đồng, cơ sở tư vấn xét nghiệm HIV…).
1.2. Tổ chức triển khai xác định đặc tính sinh học trường hợp nhiễm mới HIV
- Cơ sở tư vấn gửi mẫu có kết quả nhiễm mới HIV và các trường hợp có liên quan (thông qua kênh tư vấn xét nghiệm bạn tình, bạn chích…) tới các phòng xét nghiệm tham chiếu để thực hiện giải trình tự gen chủng vi rút, nhằm đánh giá chính xác tình hình dịch tễ nhiễm HIV tại địa phương.
- Thu thập những thông tin đặc điểm liên quan đến lâm sàng và cận lâm sàng để bổ sung, so sánh với kết quả xét nghiệm nhiễm mới HIV bằng sinh phẩm nhanh và phương cách xét nghiệm khẳng định bằng tải lượng HIV để xác định chính xác các trường hợp nhiễm mới.
1.3. Xác định độ bao phủ, chất lượng và nhu cầu dịch vụ phòng, chống HIV/AIDS trên địa bàn:
- Đánh giá thực trạng công tác phòng chống HIV/AIDS bao gồm: tình hình dịch HIV/AIDS; hoạt động phòng, chống HIV/AIDS đã và đang triển khai; mô hình cung cấp dịch vụ; nguồn lực trên địa bàn huyện, tỉnh, khu vực.
- Phân tích nguyên nhân có thể dẫn đến tăng tỷ lệ lây truyền HIV trong cộng đồng. Đề xuất các giải pháp khống chế lây nhiễm HIV và xây dựng các chương trình can thiệp phù hợp.
- Lựa chọn và triển khai các chương trình can thiệp.
2. Nhóm đáp ứng nhanh với địa bàn có trường hợp nhiễm mới
2.1. Thành phần: Tùy mức độ nguy cơ để thiết lập các đội phản ứng nhanh phù hợp với tình hình tại địa phương
- Lãnh đạo Trung tâm kiểm soát bệnh tật/Trung tâm phòng, chống HIV/AIDS tuyến tỉnh hoặc Lãnh đạo của cơ sở y tế huyện làm trưởng nhóm.
- Lãnh đạo khoa HIV/AIDS làm phó trưởng nhóm.
- 01 cán bộ giám sát dịch hoặc cán bộ tư vấn xét nghiệm HIV hoặc cán bộ tiếp cận cộng đồng của Trung tâm kiểm soát bệnh tật/Trung tâm phòng, chống HIV/AIDS tuyến tỉnh hoặc cơ sở y tế tuyến huyện.
2.2. Nhiệm vụ:
- Kết nối điều trị ARV trong ngày.
- Lập danh sách bạn tình, bạn chích (tư vấn bạn tình, bạn chích).
- Truy vết (liên hệ, tiếp cận, tư vấn, giới thiệu dịch vụ xét nghiệm, kết nối dịch vụ xét nghiệm).
- Xét nghiệm HIV (tổ chức xét nghiệm, kết nối chuyển gửi sau xét nghiệm).
- Xác định và phân loại chùm lây nhiễm.
- Khuyến cáo các can thiệp đồng bộ tại các địa bàn có nguy cơ lây nhiễm cao.
- Kết nối hệ thống giám sát ca bệnh.
- Triển khai các biện pháp đáp ứng y tế công cộng khác.
3. Theo dõi, kiểm tra giám sát
- Triển khai bộ công cụ theo dõi quản lý số liệu nhiễm mới HIV (các chỉ số đầu vào, đầu ra, biểu mẫu thống kê báo cáo).
- Phân tích, điều chỉnh các hoạt động phòng, chống HIV/AIDS (giám sát chùm ca nhiễm, chuyển gửi kết nối điều trị ARV, can thiệp dự phòng).
III. Đánh giá hiệu quả các hoạt động sử dụng kết quả xét nghiệm phát hiện nhiễm mới HIV
1. Tổ chức đánh giá hiệu quả triển khai các hoạt động sử dụng kết quả xét nghiệm phát hiện nhiễm mới HIV.
2. Tổng kết và công bố kết quả triển khai hoạt động định kỳ, đột xuất đến các cấp lãnh đạo và các đơn vị tổ chức có liên quan.
Phần IV.
TỔ CHỨC THỰC HIỆN
I. Cục Phòng, chống HIV/AIDS - Bộ Y tế
1. Chỉ đạo, kiểm tra, giám sát, đánh giá hoạt động và tổng hợp số liệu hoạt động xét nghiệm phát hiện nhiễm mới HIV trên phạm vi toàn quốc.
2. Chỉ đạo, phối hợp với các cơ sở có phòng tham chiếu quốc gia về xét nghiệm HIV xây dựng tài liệu và tổ chức tập huấn về xét nghiệm nhiễm mới HIV cho các đơn vị, địa phương.
3. Hàng năm, chủ trì, phối hợp tổ chức hội nghị đánh giá và triển khai công tác thực hiện bảo đảm chất lượng xét nghiệm nhiễm mới HIV.
4. Ban hành các hướng dẫn, chiến lược và chính sách bổ sung hoặc quy trình chuẩn để tăng cường các can thiệp cần thiết dựa trên các số liệu thu thập được về trường hợp phát hiện nhiễm mới HIV.
II. Sở Y tế các tỉnh/thành phố trực thuộc Trung ương
1. Chỉ đạo thực hiện công tác xét nghiệm phát hiện nhiễm mới HIV trên địa bàn.
2. Phối hợp với các ban ngành có liên quan hỗ trợ và tổ chức giám sát việc triển khai xét nghiệm phát hiện nhiễm mới HIV.
3. Chỉ đạo thực hiện các hoạt động ứng dụng kết quả xét nghiệm nhiễm mới HIV nhằm tăng cường chất lượng chương trình và can thiệp phòng chống lây nhiễm HIV.
III. Phòng tham chiếu quốc gia về xét nghiệm HIV và các Viện khu vực
1. Hỗ trợ kỹ thuật cho việc xây dựng và ban hành các chiến lược, kế hoạch, hướng dẫn và quy trình chuẩn cho hoạt động xét nghiệm phát hiện nhiễm mới HIV.
2. Giám sát thu thập số liệu, mẫu bệnh phẩm và hỗ trợ kỹ thuật xét nghiệm cho các tuyến tỉnh, huyện.
3. Phân bổ, theo dõi, quản lý sử dụng sinh phẩm xét nghiệm phát hiện nhiễm mới HIV.
4. Tiếp nhận các mẫu và thực hiện xét nghiệm tải lượng HIV và giải trình tự gen chủng vi rút.
5. Triển khai chương trình đảm bảo chất lượng xét nghiệm nhiễm mới lồng ghép thông qua các bộ mẫu nội kiểm, ngoại kiểm.
6. Cập nhật ngay các dữ liệu xét nghiệm tải lượng HIV và các xét nghiệm liên quan khác lên bộ công cụ quản lý trực tuyến dữ liệu nhiễm mới HIV. Đồng thời chia sẻ dữ liệu nhiễm mới HIV cho đơn vị gửi mẫu.
7. Phối hợp thu thập theo dõi và phân tích số liệu của các tỉnh theo phân công, kịp thời phát hiện các sai sót và hỗ trợ kỹ thuật cho các đơn vị trong địa bàn phụ trách.
8. Hỗ trợ cơ quan thường trực phòng chống HIV/AIDS tuyến tỉnh, tuyến huyện đưa ra các hoạt động can thiệp phù hợp và đánh giá hiệu quả triển khai các hoạt động này.
IV. Trung tâm kiểm soát bệnh tật/Trung tâm phòng, chống HIV/AIDS tuyến tỉnh
1. Tham mưu cho Sở Y tế về việc tổ chức, triển khai hoạt động xét nghiệm phát hiện nhiễm mới HIV trên địa bàn tỉnh, thành phố.
2. Tiếp nhận, phân phối, bảo quản và sử dụng sinh phẩm, vật tư, trang thiết bị phục vụ việc xét nghiệm phát hiện nhiễm mới HIV.
3. Tổ chức và phối hợp với các đơn vị liên quan lập kế hoạch, tổ chức triển khai hoạt động xét nghiệm phát hiện nhiễm mới HIV trong giám sát dịch và sử dụng kết quả xét nghiệm nhiễm mới HIV.
4. Giám sát, hỗ trợ kỹ thuật cho tuyến dưới thuộc địa bàn phụ trách.
5. Kiểm tra đôn đốc các cơ sở xét nghiệm khẳng định HIV thực hiện việc cập nhật thường xuyên các trường hợp nhiễm mới HIV lên bộ công cụ quản lý trực tuyến dữ liệu nhiễm mới HIV.
6. Đầu mối thu thập số liệu xét nghiệm phát hiện nhiễm mới HIV trên địa bàn, cập nhật và báo cáo về Cục Phòng, chống HIV/AIDS theo quy định.
7. Theo dõi và đề xuất cảnh báo dịch cấp tỉnh.
8. Tổ chức triển khai thực hiện các giải pháp can thiệp khống chế lây nhiễm HIV phù hợp với tình hình của địa phương và khu vực.
V. Cơ sở xét nghiệm tải lượng HIV
1. Tiếp nhận các mẫu và thực hiện xét nghiệm tải lượng HIV.
2. Cập nhật ngay các dữ liệu xét nghiệm tải lượng HIV và các xét nghiệm liên quan khác lên bộ công cụ quản lý trực tuyến dữ liệu nhiễm mới HIV. Đồng thời chia sẻ dữ liệu tải lượng HIV cho đơn vị gửi mẫu.
VI. Cơ sở xét nghiệm khẳng định HIV
1. Thực hiện các xét nghiệm phát hiện nhiễm mới HIV cho các mẫu bệnh phẩm theo quy định.
2. Lấy mẫu, đóng gói và vận chuyển mẫu để làm các xét nghiệm tải lượng HIV, xét nghiệm giải trình tự gen chủng vi rút và các xét nghiệm khác (nếu cần).
3. Cập nhật ngay các trường hợp nhiễm mới HIV lên bộ công cụ quản lý trực tuyến dữ liệu nhiễm mới HIV. Đồng thời chia sẻ dữ liệu nhiễm mới HIV cho đơn vị gửi mẫu.
4. Định kỳ thực hiện báo cáo tổng hợp các trường hợp nhiễm mới HIV tới đơn vị chuyên trách giám sát dịch HIV/AIDS tuyến tỉnh/thành phố để điều tra và cung cấp số liệu hỗ trợ chương trình HIV.
5. Phối hợp chặt chẽ, trao đổi thông tin với đơn vị triển khai các hoạt động tư vấn xét nghiệm HIV và cơ sở điều trị ARV nhằm tăng cường các hoạt động tư vấn xét nghiệm HIV cho bạn tình/bạn chích, kết nối dự phòng, điều trị ARV.
VII. Cơ sở y tế xét nghiệm sàng lọc HIV
1. Tư vấn về lợi ích của xét nghiệm phát hiện nhiễm mới HIV cho các đối tượng và tiến hành việc lấy hoặc tiếp nhận mẫu, vận chuyển các mẫu bệnh phẩm cho việc thực hiện các xét nghiệm phát hiện nhiễm mới HIV theo quy định.
2. Tổ chức thực hiện việc tư vấn xét nghiệm HIV, thông báo kết quả xét nghiệm HIV theo các quy định hiện hành.
3. Thực hiện sử dụng số liệu xét nghiệm nhiễm mới nhằm tổ chức và triển khai các hoạt động tư vấn tăng cường cho các trường hợp nhiễm mới, tư vấn xét nghiệm bạn tình, bạn chích tại các cơ sở và tại địa bàn có ca nhiễm mới. Đề xuất và triển khai các hoạt động can thiệp dự phòng và tăng cường điều trị phù hợp với thực trạng tại địa bàn và cơ sở.
4. Thực hiện thống kê báo cáo số liệu theo quy định.
PHỤ LỤC 01:
Tên đơn vị chủ quản:...................
Tên cơ sở y tế: ............................
PHIẾU XÁC NHẬN ĐỒNG Ý XÉT NGHIỆM HIV
Họ và tên người được tư vấn:
Số điện thoại:
Số CMND (hoặc giấy tờ tùy thân):
Dân tộc:
Giới tính:
Năm sinh:
Nơi đăng ký hộ khẩu thường trú:
Nơi đăng ký cư trú hiện tại (nếu khác nơi đăng ký hộ khẩu thường trú):
Nghề nghiệp:
Đối tượng:
Nguy cơ lây nhiễm HIV:
Sau khi được tư vấn đầy đủ, rõ ràng về nguy cơ lây nhiễm HIV, lợi ích của việc làm xét nghiệm HIV, tôi hoàn toàn đồng ý, tự nguyện làm xét nghiệm HIV, xét nghiệm phát hiện nhiễm mới HIV, xét nghiệm tải lượng HIV và các xét nghiệm khác (nếu cần).
.................., ngày........ tháng ....... năm 20….
| Đối tượng được tư vấn | Cán bộ y tế
|
PHỤ LỤC 02:
PHIẾU THÔNG TIN ĐỐI TƯỢNG TƯ VẤN XÉT NGHIỆM HIV (TVXN HIV)
| C1. Tỉnh/thành phố: .................................................... | C5. Loại hình dịch vụ TVXN HIV. | ||||||||
| C2. Tên cơ sở: ............................................................ | 1. Khoa/ phòng/ bệnh viện (không bao gồm PKNT HIV) | ||||||||
| C3. Họ tên tư vấn viên: ............................................... | 2. Cơ sở TVXN HIV (VCT, PKNT, MMT, PrEP, trại giam...) | ||||||||
| C4. Ngày tư vấn trước XN HIV: …/…/…… | Ghi rõ: .............................................................................. | ||||||||
|
| |||||||||
| C6. Mã số đối tượng: ................................ C7. Giới tính khi sinh: 1. Nam .... 2. Nữ ....... C8. Năm sinh: ........................... | |||||||||
| C9. Đối tượng thuộc nhóm nguy cơ nào? (nhiều lựa chọn; tư vấn viên đánh giá và xác định) | |||||||||
| 1. Người nghiện chích ma túy | 9. Người mua dâm | ||||||||
| 2. Nam có quan hệ tình dục đồng giới (MSM) | 10. Người có nhiều bạn tình | ||||||||
| 3. Người bán dâm | 11. Bệnh nhân nghi AIDS | ||||||||
| 4. Người chuyển giới | 12. Bệnh nhân lao | ||||||||
| 5- Vợ/chồng/bạn tình/con đẻ ≤ 15 tuổi của người có HIV | 13. Người mắc nhiễm trùng lây truyền qua đường tình dục (LTQĐTD) | ||||||||
| 6. Bạn chích chung của người có HIV | 14. Phạm nhân | ||||||||
| 7. Vợ/chồng/bạn tình của người nghiện chích ma túy (NCMT) | 15. Phụ nữ mang thai | ||||||||
| 8. Vợ/bạn tình nữ của nam có quan hệ tình dục đồng giới | 16. Khác, ghi rõ: ................................................ | ||||||||
| C10. Đối tượng do ai giới thiệu/chuyến đến? |
| ||||||||
| 1. Đối tượng tự đến |
| ||||||||
| 2. Dịch vụ thông báo xét nghiệm bạn tình/bạn chích của người có HIV → Ghi rõ mã số người có HIV liên quan: .............. | |||||||||
| 3. Chương trình tiếp cận cộng đồng → Tên chương trình/người chuyển gửi: ................................................................... | |||||||||
| 4. Khác, ghi rõ: ................................................. |
| ||||||||
| C11. Đối tượng đã có kết quả XN phản ứng trước khi đến và cần làm XN khẳng định nhiễm HIV? | |||||||||
| 1. Không | 2. Có | ||||||||
| a. Nếu có, XN HIV có phản ứng với: |
| ||||||||
| 1. Dịch miệng | 2. Máu mao mạch đầu ngón tay | 3. Khác, ghi rõ: | |||||||
| b. Nếu có, đối tượng đã sử dụng hình thức TVXN HIV nào? | |||||||||
| 1. Tự làm XN | 2. XN do nhóm cộng đồng thực hiện | 3. XN do y tế xã/phường thực hiện | |||||||
| c. Nếu có, đối tượng có phiếu chuyển gửi XN HIV khẳng định theo quy định? | |||||||||
| 1. Không | 2. Có | → Thu lại phiếu chuyển gửi và ghi rõ mã số TVXN cộng đồng: | |||||||
| C12. Kết quả XN HIV lần gần nhất? | C13. Nếu kết quả XN HIV lần gần nhất là dương tính: | ||||||||
| 1. Chưa bao giờ XN HIV | 1. Thời gian XN: a. ≤ 12 tháng b. > 12 tháng | ||||||||
| 2. Có, kết quả XN âm tính | 2. Điều trị ARV: | ||||||||
| 3. Có, kết quả XN dương tính |
| a. Chưa bao giờ điều trị ARV | |||||||
| 4. Có, không xác định hoặc không biết kết quả XN |
| b. Đang điều trị ARV | |||||||
|
|
| c. Đã bỏ điều trị ARV | |||||||
| C14. Kết quả XN HIV khẳng định lần này? | |||||||||
| 1. Âm tính 2. Dương tính | 3. Không xác định | ||||||||
| C15. Đối tượng được tư vấn sau XN và nhận kết quả XN HIV? | |||||||||
| 1. Không | 2. Có, ghi rõ ngày đối tượng quay lại nhận kết quả: …/…/…… | ||||||||
| C16. Nếu kết quả XN HIV khẳng định âm tính, đối tượng có được giới thiệu chuyển gửi đến dịch vụ PrEP? | |||||||||
| 1. Không |
| ||||||||
| 2. Có, ghi rõ: ........... a. Tên cơ sở tiếp nhận: ..................... | b. Ngày nhận dịch vụ: .........../................................. | ||||||||
| C17. Nếu kết quả XN khẳng định HIV dương tính, kết quả XN sàng lọc phát hiện nhiễm mới HIV? | |||||||||
| 1. Nhiễm mới HIV | 2. Nhiễm HIV lâu | 3. Không làm XN nhiễm mới | |||||||
| C18. Nếu nhiễm mới HIV, kết quả XN tải lượng vi-rút? | |||||||||
| 1. < 1.000 bản sao/ml | 2. ≥ 1 000 bản sao/ml | 3. Không làm XN tải lượng vi-rút | |||||||
| THÔNG TIN CỦA ĐỐI TƯỢNG KHẲNG ĐỊNH DƯƠNG TÍNH HIV CÓ QUAY LẠI NHẬN KẾT QUẢ XN | |||||||||
| C19. Thông tin về XN khẳng định HIV? | C20. Đối tượng nhận dịch vụ điều trị HIV? | ||||||||
| 1. Phòng XN khẳng định: | Chưa có thông tin | ||||||||
| 2. Ngày XN khẳng định: …/…/…… | Không, ghi rõ lý do: | ||||||||
| 3. Mã số XN khẳng định: ..................................................... | Có, ghi rõ thông tin điều trị, bao gồm: | ||||||||
| C21. Được tư vấn về dịch vụ TBXNBT/BC? | |||||||||
| 1. Không | - Cơ sở tiếp nhận: | ||||||||
| 2. Có, ghi rõ ngày tư vấn: …/…/…… | - Ngày đăng ký điều trị: …/…/…… | ||||||||
|
| - Mã số điều trị: | ||||||||
| C22. Nếu đã được tư vấn, đối tượng có đồng ý nhận dịch vụ TBXNBT/BC? | |||||||||
| 1. Không | 2. Có (sử dụng “Phiếu thông tin BT/BC/con đẻ phơi nhiễm HIV") | ||||||||
| C23. Thông tin nhân khẩu, xã hội | |||||||||
| 1. Họ và tên: ......................................... | 7. Nơi đăng ký hộ khấu | Tỉnh/TP: | |||||||
| 2. Dân tộc: ............................................ | Quận/huyện: | Phường/xã: | |||||||
| 3. Nghề nghiệp: .................................... | Thôn/số nhà: |
| |||||||
| 4. Số CMND/CCCD: ............................. | 8. Nơi cư trú hiện tại: | Tỉnh/TP: | |||||||
| 5. Số điện thoại: .................................... | Quận/huyện: | Phường/xã: | |||||||
| 6. Ghi chú: ............................................. | Thôn/số nhà: |
| |||||||
| C24. Kết quả xác minh ca HIV dương tính? (theo xác nhận từ đơn vị đầu mối về phòng chống HIV tuyến tỉnh) | |||||||||
| 1. Đối tượng dương tính mới 2. Đối tượng dương tính cũ 3. Đang chờ kết quả xác minh | |||||||||
PHỤ LỤC 03:
BIỂU MẪU/SỔ XÉT NGHIỆM HIV
1. Phiếu gửi mẫu xét nghiệm HIV (dùng cho cơ sở xét nghiệm sàng lọc HIV)
| BỘ (SỞ) Y TẾ…………………. Tên đơn vị……………………..… | CỘNG HÒA XÃ HỘI CHỦ NGHĨA VIỆT NAM |
|
| ………., ngày ... tháng ... năm ..…... |
Kính gửi: …………………………………………
PHIẾU GỬI MẪU XÉT NGHIỆM HIV
(Dùng cho đơn vị gửi mẫu xét nghiệm)
| STT | HỌ TÊN | NĂM SINH | ĐỊA CHỈ | ĐỐI TƯỢNG | NGÀY LẤY MẪU | KẾT QUẢ XÉT NGHIỆM | CHẤT LƯỢNG MẪU | MÃ SỐ PXN | GHI CHÚ | |
| Nam | Nữ | SP (ghi rõ tên sp) | ||||||||
| (1) | (2) | (3) | (4) | (5) | (6) | (7) | (8) | (9) | (10) | (11) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ghi chú: Phiếu này lập thành 02 bản, mỗi bên giữ 01 bản.
| Ngày ……. tháng ………. năm …. | Ngày …….tháng ….năm …
|
Cách ghi: + Với các đối tượng CÓ chỉ định thực hiện xét nghiệm nhiễm mới, ghi “XN nhiễm mới” vào cột ghi chú (11).
2. Sổ xét nghiệm sàng lọc HIV
| STT | THÔNG TIN ĐỐI TƯỢNG | NGÀY LẤY MẪU | NGÀY XÉT NGHIỆM | KẾT QUẢ XÉT NGHIỆM | KẾT LUẬN | KẾT QUẢ KHẲNG ĐỊNH | GHI CHÚ | |||||
| HỌ TÊN | MÃ SỐ | NĂM SINH | ĐỊA CHỈ | ĐỐI TƯỢNG | SP (ghi rõ tên sinh phẩm) | |||||||
| Nam | Nữ | |||||||||||
| (1) | (2) | (3) | (4) | (5) | (6) | (7) | (8) | (9) | (10) | (11) | (12) | (13) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cách ghi xét nghiệm nhiễm mới HIV vào sổ:
1. Ghi lý do không chỉ định làm xét nghiệm nhiễm mới vào cột ghi chú (tại cột 13) nếu đối tượng không làm XN nhiễm mới HIV
2. Cách ghi kết quả nhiễm mới HIV:
- Xét nghiệm nhiễm mới HIV bằng sinh phẩm nhanh:
Có phản ứng tại vạch chứng và vạch xác định nhiễm mới: ghi R+;
Có phản ứng tại vạch chứng, vạch nhiễm mới và vạch nhiễm lâu: ghi LT.
Chỉ có 1 vạch chứng: ghi âm tính.
- Xét nghiệm tải lượng vi rút HIV: ghi cụ thể số lượng copy/ml.
3. Ghi nhận kết quả: nhiễm mới (NM); nhiễm lâu (NL)
- Thứ tự ghi kết quả tại cột (13): Kết quả XN bằng sinh phẩm nhanh, XN TLVR/ghi nhận kết quả nhiễm mới.
Ví dụ: R+, 1500/NM hoặc LT/NL hoặc R+, 700/NL.
3. Sổ xét nghiệm khẳng định HIV
| STT | THÔNG TIN ĐỐI TƯỢNG (từ cơ sở gửi mẫu) | ĐƠN VỊ GỬI MẪU
| KẾT QUẢ XÉT NGHIỆM | KẾT LUẬN | MÃ SỐ BN của PXN | KẾT QUẢ NHIỄM MỚI | GHI CHÚ | ||||||||||
| HỌ TÊN | MÃ SỐ | NĂM SINH | ĐỊA CHỈ | ĐỐI TƯỢNG
| SP 1 (ghi rõ tên sinh phẩm) | SP 2 (ghi rõ tên sinh phẩm) | SP 3 (ghi rõ tên sinh phẩm) | ||||||||||
| Nam | Nữ | Ngày XN | Kết quả XN | Ngày XN | Kết quả XN | Ngày XN | Kết quả XN | ||||||||||
| (1) | (2) | (3) | (4) | (5) | (6) | (7) | (8) | (9) | (10) | (11) | (12) | (13) | (14) | (15) | (16) | (17) | (18) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cách ghi xét nghiệm nhiễm mới HIV vào sổ:
1. Ghi lý do không chỉ định làm xét nghiệm nhiễm mới vào cột ghi chú (tại cột 18)
2. Cách ghi kết quả nhiễm mới HIV:
- Xét nghiệm nhiễm mới HIV bằng sinh phẩm nhanh:
Có phản ứng tại vạch chứng và vạch xác định nhiễm mới: ghi R+;
Có phản ứng tại vạch chứng, vạch nhiễm mới và vạch nhiễm lâu: ghi LT.
Chỉ có 1 vạch chứng: ghi âm tính.
- Xét nghiệm tải lượng vi rút HIV ghi cụ thể số lượng copy/ml.
3. Ghi nhận kết quả: nhiễm mới (NM); nhiễm lâu (NL)
- Thứ tự ghi nhận kết quả tại cột (17): Kết quả XN bằng sinh phẩm nhanh, XN TLVR/ghi nhận kết quả nhiễm mới.
Ví dụ: R+, 1500/NM hoặc LT/NL hoặc R+, 700/NL.
4. Phiếu trả lời kết quả xét nghiệm nhiễm mới HIV
| BỘ (SỞ) Y TẾ……………. Tên đơn vị………………… | CỘNG HÒA XÃ HỘI CHỦ NGHĨA VIỆT NAM |
|
| ………., ngày ... tháng ... năm ..…... |
PHIẾU TRẢ LỜI KẾT QUẢ XÉT NGHIỆM HIV
(Dùng trả cho đơn vị gửi mẫu xét nghiệm)
Kính gửi:……………………………………
Ngày nhận mẫu:……………………………………………..………….
Ngày xét nghiệm:……………..….……………………….…………….
| STT | HỌ TÊN | MÃ SỐ | NĂM SINH | ĐỊA CHỈ | ĐỐI TƯỢNG | KẾT QUẢ XÉT NGHIỆM | KẾT LUẬN | GHI CHÚ | ||||
| Nam | Nữ | SP1 (ghi rõ tên SP) | SP2 (ghi rõ tên SP) | SP3 (ghi rõ tên SP) | Kỹ thuật khác | |||||||
| (1) | (2) | (3) | (4) | (5) | (6) | (7) | (8) | (9) | (10) | (11) | (12) | (13) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| PHỤ TRÁCH PHÒNG XÉT NGHIỆM |
Cách ghi xét nghiệm nhiễm mới HIV vào sổ:
1. Cách ghi kết quả nhiễm mới HIV tại cột ghi chú (Cột số 13):
- Xét nghiệm nhiễm mới HIV bằng sinh phẩm nhanh:
Có phản ứng tại vạch chứng và vạch xác định nhiễm mới: ghi R+;
Có phản ứng tại vạch chứng, vạch nhiễm mới và vạch nhiễm lâu: ghi LT.
Chỉ có 1 vạch chứng: ghi âm tính.
- Xét nghiệm tải lượng vi rút HIV ghi cụ thể số lượng copy/ml.
2. Ghi nhận kết quả: nhiễm mới (NM); nhiễm lâu (NL)
- Thứ tự ghi nhận kết quả tại cột (13): Kết quả XN bằng sinh phẩm nhanh, XN TLVR/ghi nhận kết quả nhiễm mới.
Ví dụ: R+, 1500/NM hoặc LT/NL hoặc R+, 700/NL.
5. Báo cáo tổng hợp các trường hợp ghi nhận xét nghiệm nhiễm mới HIV
| SỞ Y TẾ TỈNH/THÀNH PHỐ…… |
|
Kính gửi: .................................................................................................................
BÁO CÁO TỔNG HỢP CÁC TRƯỜNG HỢP GHI NHẬN NHIỄM MỚI HIV
BÁO CÁO THÁNG: .........................................
| Đơn vị gửi (Đơn vị tuyến huyện) | Số mẫu HIV dương tính | Số mẫu thực hiện XN phát hiện nhiễm mới | Số mẫu nhiễm lâu | Số mẫu nhiễm mới | Số mẫu nhiễm mới đã thực hiện XN VL | Số mẫu nhiễm mới có kết quả VL>103 | Số mẫu nhiễm mới có kết quả VL<103 | Số mẫu nhiễm mới đang chờ kết quả VL | Số ca nhiễm mới chưa thực hiện XN VL | Số ca nhiễm mới đã ghi nhận (RITA) | Số được chuyển gửi điều trị ARV | Số bạn tình/bạn chích được chia sẻ | Số bạn tình/bạn chích được XN HIV | Số bạn tình/bạn chích có KQXN HIV(+) | Số bạn tình/bạn chích có KQXN HIV(-) được điều trị dự phòng PrEP | |
| Số nhiễm mới | Số nhiễm lâu | |||||||||||||||
| (1) | (2) | (3) | (4) | (5) | (6) | (7) | (8) | (9) | (10) | (11) | (12) | (13) | (14) | (15) | (16) | (17) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| ………., ngày ... tháng ... năm ..…...
|
6. Báo cáo truy vết ca nhiễm mới (Dùng cho cơ sở tư vấn xét nghiệm, sàng lọc HIV: gửi Đơn vị phòng, chống HIV/AIDS tuyến tỉnh)
Tên đơn vị: ……………………………….. ……
Kính gửi: .................................................................................................................
BÁO CÁO TRUY VẾT CA NHIỄM MỚI
| I. Ca nhiễm mới | ||||||||||||||||||
| Họ tên và Mã đối tượng theo Cơ sở tư vấn XN (VCT, OPC) | Đơn vị tư vấn XN và gửi mẫu (VCT, OPC) | Ngày XN khẳng định và XNNM | Giới tính | Năm sinh | Nhóm nguy cơ | Ghi nhận kết quả nhiễm mới | Ngày bắt đầu điều trị ARV | Nơi và mã điều trị ARV | Ngày tư vấn bạn tình/bạn chích (PNS) | |||||||||
| .................. | ........ | ...... | ........ | ........ | ........ | .............. | ........ | ........ | ........ | |||||||||
| II. Thông tin BT/BC được chia sẻ | ||||||||||||||||||
| STT | Họ và tên bạn tình/bạn chích | XN HIV | Số BT/BC có KQXN HIV (-) | Số BT/BC có KQXN HIV (+) | Được điều trị ARV | |||||||||||||
| Có XN | Không XN | Có điều trị PrEP | Không điều trị dự phòng PrEP | Ghi nhận nhiễm mới | Ghi nhận nhiễm lâu | Có điều trị trong ngày | Không điều trị ARV trong ngày | Không gửi điều trị (lý do) | ||||||||||
| 1 |
|
|
|
|
|
|
|
|
|
| ||||||||
| 2 |
|
|
|
|
|
|
|
|
|
| ||||||||
| 3 |
|
|
|
|
|
|
|
|
|
| ||||||||
| 4 |
|
|
|
|
|
|
|
|
|
| ||||||||
| 5 |
|
|
|
|
|
|
|
|
|
| ||||||||
|
| ………., ngày ... tháng ... năm ..…... |
PHỤ LỤC 04: QUY TRÌNH LẤY MẪU, ĐÓNG GÓI VÀ VẬN CHUYỂN MẪU
I. Lấy mẫu máu
1. Chuẩn bị dụng cụ:
- Bông thấm nước vô trùng, cồn 70 độ hoặc cồn i-ốt, băng cá nhân;
- Bơm kim tiêm (6ml hoặc 10ml, đầu kim 21G - 23G) hoặc bộ dụng cụ lấy máu bằng ống hút chân không (vacutainer, kim 21G - 23G, giá đỡ), dây ga-rô, giá để ống nghiệm, bút dạ (loại mực chịu nước);
- Ống lấy máu có chứa chất chống đông EDTA hoặc chất chống đông khác theo yêu cầu của kỹ thuật sử dụng (tốt nhất là dạng phun sương). Không dùng chất chống đông bằng Heparin vì sẽ ức chế phản ứng của kỹ thuật sinh học phân tử;
- Đầu côn có lọc (không có ADNase/ARNase); ống cryotube (1,8 - 2ml, không có ADNase/ARNase); hộp đựng các vật sắc nhọn và rác thải y tế;
- Găng tay không bột (trường hợp không có găng tay không bột có thể dùng găng tay thường nhưng phải rửa sạch bột talcum trước khi lấy máu cho bệnh nhân).
2. Chuẩn bị lấy mẫu:
- Điền đầy đủ thông tin của người bệnh (họ tên, mã số, tuổi) và giờ, ngày lấy mẫu trên ống đựng mẫu;
- Kiểm tra, đối chiếu tên người bệnh, mã số trên phiếu và trên ống nghiệm;
- Rửa tay và đi găng tay.
3. Tiến hành lấy máu:
- Xác định vị trí lấy máu (tĩnh mạch) và ga rô cách vị trí lấy máu 5cm về phía trên;
- Sát trùng vị trí lấy máu bằng cồn 70 độ và để khô 30 giây;
- Đưa kim vào tĩnh mạch lấy 6 ml máu cho vào ống có chứa chất chống đông. Có thể dùng bơm kim tiêm loại 10 ml (đầu kim cỡ 21G - 23G) để lấy máu hoặc dùng bộ dụng cụ lấy máu với ống hút chân không (vacutainer). Nếu dùng bơm kim tiêm để lấy máu thì tháo đầu kim ra (đảm bảo thao tác an toàn), để bơm tiêm chếch với thành ống nghiệm và bơm từ từ cho máu chảy theo thành ống nghiệm tránh làm vỡ hồng cầu;
- Thải bỏ đầu kim vào hộp đựng các vật sắc nhọn, các chất thải không sắc nhọn khác cho vào thùng đựng rác thải y tế;
- Sát trùng lại vị trí đã lấy máu bằng cồn 70 độ và băng lại;
- Sau khi lấy máu vào ống có chất chống đông, trộn đều bằng cách nhẹ nhàng đảo ngược ống máu 8-10 lần hoặc để trên máy xoay trộn trong tối thiểu 2 phút. Để ống máu ở nhiệt độ phòng tối thiểu 15 phút và bảo quản ở 2°C -8°C cho đến khi chuyển đến phòng xét nghiệm;
- Nếu trong vòng 8 giờ kể từ khi lấy mẫu máu mà không gửi được đến phòng xét nghiệm thì bắt buộc phải ly tâm tách huyết tương.
4. Hướng dẫn tách huyết tương từ mẫu máu toàn phần:
- Ly tâm ống máu với tốc độ 2.500 - 3.000 vòng/phút trong 20 phút ở nhiệt độ phòng (18-25) hoặc tốt nhất là ở 4°C;
- Dùng pi-pét với đầu côn có lọc (không có ADNase/ARNase) để hút toàn bộ huyết tương chuyển sang 02 ống cryotube đã có dán mã số tương ứng: ống 1 lấy 1 ml (tối thiểu 0,8 ml) và ống 2 lấy 1-2 ml (tối thiểu 1,0 ml);
- Mẫu huyết tương bảo quản ở 2°C - 8°C trong vòng 3-5 ngày (tùy thuộc kỹ thuật sử dụng tại đơn vị xét nghiệm) nếu cần bảo quản lâu hơn phải bảo quản từ âm 20°C đến âm 70°C cho đến khi thực hiện xét nghiệm tải lượng HIV, giải trình tự hoặc các xét nghiệm khác nếu chưa thực hiện ngay.
II. Đóng gói mẫu bệnh phẩm
- Đeo găng tay đóng chặt các nắp của ống mẫu và xếp tất cả các ống mẫu theo phương thẳng đứng vào trong giá đựng mẫu. Dùng băng dính cố định các ống mẫu trong giá đựng mẫu. Cho mẫu đã được cố định và vật liệu thấm hút (bông hoặc giấy thấm nước) để trong túi nylon dán kín.
- Đặt túi nylon có chứa mẫu và cho đủ vật liệu thấm hút (bông hoặc giấy thấm nước) vào thùng vận chuyển mẫu.
- Đặt các túi tích lạnh vào thùng đựng mẫu để đảm bảo mẫu được bảo quản từ 2-8°C trong quá trình vận chuyển.
- Đóng nắp thùng đựng mẫu và chốt khoá lại. Trường hợp không có chốt khoá thì dùng băng dính dán xung quanh.
- Dán hoặc in ký hiệu nguy hiểm sinh học và số điện thoại liên hệ trong trường hợp khẩn cấp bên ngoài của hộp đựng mẫu bệnh phẩm.
III. Vận chuyển bệnh phẩm
1. Vận chuyển mẫu đến phòng xét nghiệm khẳng định HIV
Thực hiện theo quy định tại Quyết định số 2674/QĐ-BYT ngày 27/4/2018 của Bộ Y tế về việc ban hành Hướng dẫn quốc gia xét nghiệm HIV.
2. Vận chuyển mẫu đến phòng xét nghiệm sinh học phân tử HIV
Thực hiện theo quy định tại Quyết định số 1112/QĐ-BYT ngày 26/3/2019 của Bộ Y tế về việc ban hành Hướng dẫn xét nghiệm tải lượng HIV trong theo dõi điều trị HIV/AIDS và trả kết quả xét nghiệm đo tải lượng HIV cho cơ sở gửi mẫu.
IV. Tiếp nhận và sử dụng mẫu bệnh phẩm
1. Tiêu chuẩn mẫu đạt yêu cầu: khi đủ các tiêu chuẩn sau:
- Mẫu huyết tương chống đông bằng chất chống đông đúng quy định
- Mẫu trong, không tán huyết
- Đủ thể tích
- Có mã số rõ ràng
- Được bảo quản theo đúng nhiệt độ quy định: 2-8°C trong vòng 3-5 ngày (kể từ lúc lấy mẫu hoặc bảo quản ở -20°C trở xuống nếu để lâu hơn
- Vận chuyển mẫu huyết tương ở nhiệt độ 2-8 °C trong vòng 3-5 ngày. Nếu vận chuyển mẫu đông đá thì phải vận chuyển bằng đá khô.
2. Tiêu chuẩn mẫu không đạt yêu cầu: Khi có một trong các tiêu chuẩn sau mẫu sẽ bị loại bỏ:
- Mẫu tán huyết, mẫu dùng chất chống đông bằng Heparin
- Không đủ thể tích theo quy định
- Mã số không có hoặc không rõ
- Được bảo quản và vận chuyển không đúng nhiệt độ quy định.
3. Sử dụng mẫu bệnh phẩm
Ống huyết tương số 1 và số 2 được tách chiết cùng một lúc và vận chuyển về phòng xét nghiệm khẳng định HIV. Sau đó:
- Ống mẫu số 1: Dùng để xét nghiệm khẳng định nhiễm HIV và xét nghiệm nhiễm mới.
- Ống mẫu số 2: Đối với các mẫu có kết quả xét nghiệm nhiễm mới vận chuyển ống mẫu số 2 đến phòng xét nghiệm sinh học phân tử HIV để làm xét nghiệm đo tải lượng HIV và các xét nghiệm sinh học phân tử khác (nếu cần).
PHỤ LỤC 05: HƯỚNG DẪN TĂNG CƯỜNG TƯ VẤN XÉT NGHIỆM HIV CHO BẠN TÌNH, BẠN CHÍCH CỦA CÁC CA CÓ KẾT QUẢ XÉT NGHIỆM PHÁT HIỆN NHIỄM MỚI HIV
Bước 1: Giới thiệu dịch vụ ngay khi tư vấn trả kết quả xét nghiệm khẳng định HIV dương tính: dù bệnh nhân có chấp thuận điều trị ARV trong ngày hay không. Nếu đối tượng nhiễm mới HIV không chấp thuận thông báo xét nghiệm cho bạn tình, bạn chích: tiến hành trong vòng 3 ngày sau khi có kết quả xét nghiệm nhiễm mới HIV
Bước 2: Trao đối với các đối tượng và lập danh sách bạn tình, bạn chích trong 12 tháng qua: tập trung khai thác triệt để bạn tình, bạn chích trong 6 tháng gần nhất
Bước 3: Sàng lọc khả năng bạo lực trong bạn tình, bạn chích
Bước 4: Xác định biện pháp liên lạc, thông báo cho bạn tình, bạn chích:
- Thương lượng các biện pháp thông báo chủ động, có hỗ trợ
- Đề nghị biện pháp nhân viên y tế thực hiện ngay từ đầu
- Nếu không được, thương lượng biện pháp cùng thực hiện
- Sau cùng, biện pháp thỏa thuận thực hiện nếu người có HIV muốn tự thông báo
- Nếu chọn biện pháp thỏa thuận thực hiện:
+ Yêu cầu người có HIV thông báo cho bạn tình, bạn chích trong vòng 3 ngày (thay vì 07 ngày như quy trình thông thường) sau khi tư vấn và bạn tình, bạn chích cần được xét nghiệm HIV trong vòng 1 tuần
+ Tiến hành biện pháp nhân viên y tế thực hiện nếu bạn tình, bạn chích không được xét nghiệm HIV trong vòng 3 ngày sau khi đã tư vấn hỗ trợ
- Tiến hành tư vấn khai thác tiếp trong vòng 1 tuần nếu thấy cần thiết
Bước 5: Liên lạc với bạn tình, bạn chích
- Nhân viên y tế thực hiện
- Nỗ lực đầu tiên trong vòng 24 giờ sau khi có thông tin liên lạc của bạn tình, bạn chích; tối thiểu 3 nỗ lực, ít nhất 1 lần gặp trực tiếp, trong vòng 1 tuần
- Bạn tình, bạn chích phải được thông báo trong vòng 1 tuần sau khi có thông tin, và phải được xét nghiệm HIV (nếu chưa biết tình trạng) trong vòng 1 tuần sau khi được thông báo
- Huy động sự hỗ trợ của nhân viên cộng đồng khi cần thiết
- Ghi chép thông tin và báo cáo với giám sát viên sau 1 tuần nỗ lực thông báo không có kết quả
- Thỏa thuận thực hiện:
+ Liên lạc với người có HIV sau 3 ngày để đánh giá tình hình, hỗ trợ cho họ trong việc tự thông báo nếu cần
+ Đề nghị tiến hành biện pháp nhân viên y tế thực hiện nếu không có kết quả
+ Gọi lại vào ngày thứ 3 để đảm bảo chắc chắn bạn tình, bạn chích đã được thông báo
+ Nếu bạn tình, bạn chích chưa được thông báo, tiến hành liên lạc lần đầu cùng ngày
Bước 6: Xét nghiệm HIV cho bạn tình, bạn chích
- Với bạn tình, bạn chích chưa xét nghiệm hoặc xét nghiệm HIV âm tính trên 6 tháng
- Tư vấn tích cực và hẹn xét nghiệm HIV ngay, sớm nhất (trong vòng 1 tuần sau khi thông báo)
- Đề xuất phương thức xét nghiệm HIV nhanh chóng, tiện lợi cho bạn tình, bạn chích và tránh mất dấu
- Xét nghiệm HIV tại nhà, cộng đồng: chuẩn bị sẵn sàng sinh phẩm khi tư vấn trực tiếp tại nhà, cộng đồng
- Cung cấp sinh phẩm tự xét nghiệm HIV
- Phối hợp với đơn vị xét nghiệm HIV tại cộng đồng
Bước 7: Chuyển gửi dịch vụ cho bạn tình, bạn chích theo tình trạng HIV
Nếu bạn tình, bạn chích có HIV(+), sẽ có hai tình huống:
- Đã biết HIV dương tính và chưa điều trị ARV: theo quy trình chuyển tiếp thông thường
- Mới có kết quả xét nghiệm khẳng định HIV dương tính:
+ Kết nối điều trị ARV như thường quy
+ Tư vấn thông báo xét nghiệm bạn tình, bạn chích
Nếu bạn tình, bạn chích có kết quả xét nghiệm HIV(-):
+ Tư vấn tích cực về PrEP và chuyển tiếp đến dịch vụ PrEP trên địa bàn
+ Tư vấn tích cực về các bệnh lây truyền qua quan hệ tình dục, chuyển tiếp đến dịch vụ các bệnh lây truyền qua quan hệ tình dục
+ Tư vấn tích cực về các dịch vụ dự phòng HIV phù hợp khác như bao cao su, bơm kim tiêm, chất bôi trơn
THAM KHẢO
PHỤ LỤC 06: PHIẾU THÔNG TIN BẠN TÌNH/BẠN CHÍCH CHUNG/CON ĐẺ PHƠI NHIỄM HIV
| Tỉnh/TP: | Họ tên NCH: | Giới tính khi sinh: 1. Nam 2. Nữ | Năm sinh: | |
| Ngày XNKĐ HIV+: __/__/__ | Tình trạng ĐT ARV [1 lựa chọn] (*): | Nguy cơ [nhiều lựa chọn] (**): | ||
| Tên cơ sở: | Họ tên tư vấn viên: | Mã số KH: | Ngày tư vấn dịch vụ TBXNBT/BC: __/__/__ | Đồng ý nhận dịch vụ TBXNBT/BC: 1. Có, ngày __/__/__ 2. Không |
|
| BT/BC/con đẻ phơi nhiễm #... | BT/BC/con đẻ phơi nhiễm#... | BT/BC/con đẻ phơi nhiễm#... | |||
| Họ tên |
|
|
| |||
| Năm sinh |
|
|
| |||
| Giới tính khi sinh | 1. Nam 2. Nữ | 1. Nam 2. Nữ | 1. Nam 2. Nữ | |||
| Địa chỉ cư trú hiện nay, số điện thoại |
|
|
| |||
| C1. Quan hệ với NCH (nhiều lựa chọn) | 1. Vợ/chồng 2. Bạn tình khác 3. Bạn TCMT chung 4. Con đẻ ≤ 15 tuổi của mẹ HIV+ 5. Mẹ sinh con ≤ 15 tuổi HIV+ | 1. Vợ/chồng 2. Bạn tình khác 3. Bạn TCMT chung 4. Con đẻ ≤ 15 tuổi của mẹ HIV+ 5. Mẹ sinh con ≤ 15 tuổi HIV+ | 1. Vợ/chồng 2. Bạn tình khác 3. Bạn TCMT chung 4. Con đẻ ≤ 15 tuổi của mẹ HIV+ 5. Mẹ sinh con ≤ 15 tuổi HIV+ | |||
| C2. Tình trạng HIV | 1. HIV+ đã được KĐ (dừng tại đây) 2. Không biết hoặc HIV- | 1. HIV+ đã được KĐ (dừng tại đây) 2. Không biết hoặc HIV- | 1. HIV+ đã được KĐ (dừng tại đây) 2. Không biết hoặc HIV- | |||
| C3. Nguy cơ bạo lực | 1. Có (dừng tại đây) 2. Không | 1. Có (dừng tại đây) 2. Không | 1. Có (dừng tại đây) 2. Không | |||
| C4. Ngày các lần đã liên lạc thông báo phơi nhiễm và đề nghị XN HIV | 1. Lần 1, ngày …/…/…… 2. Lần 2, ngày …/…/…… 3. Lần 3, ngày …/…/…… | 1. Lần 1, ngày …/…/…… 2. Lần 2, ngày …/…/…… 3. Lần 3, ngày …/…/…… | 1. Lần 1, ngày …/…/…… 2. Lần 2, ngày …/…/…… 3. Lần 3, ngày …/…/…… |
| ||
| C5. Đã liên lạc được để thông báo phơi nhiễm và đề nghị XN HIV? | 1. Có 2. Không (chọn lý do và dừng tại đây) a. Không ở địa phương b. Đã tử vong c. Không liên lạc được/từ chối | 1. Có 2. Không (chọn lý do và dừng tại đây) a. Không ở địa phương b. Đã tử vong c. Không liên lạc được/từ chối | 1. Có 2. Không (chọn lý do và dừng tại đây) a. Không ở địa phương b. Đã tử vong c. Không liên lạc được/từ chối |
| ||
| C6. Biện pháp đã thành công thông báo và đề nghị XN HIV (1 lựa chọn) | 1. NCH 2. Thỏa thuận thực hiện 3. Cùng thực hiện 4. Nhân viên y tế | 1. NCH 2. Thỏa thuận thực hiện 3. Cùng thực hiện 4. Nhân viên y tế | 1. NCH 2. Thỏa thuận thực hiện 3. Cùng thực hiện 4. Nhân viên y tế |
| ||
| C7. Cách đã liên lạc thành công (1 lựa chọn) | 1. Gọi điện thoại 2. Gửi tin nhắn 3. Internet (facebook, viber, zalo, email, ứng dụng khác) 4. Gặp trực tiếp 5. Khác ............ | 1. Gọi điện thoại 2. Gửi tin nhắn 3. Internet (facebook, viber, zalo, email, ứng dụng khác) 4. Gặp trực tiếp 5. Khác .................. | 1. Gọi điện thoại 2. Gửi tin nhắn 3. Internet (facebook, viber, zalo, email, ứng dụng khác) 4. Gặp trực tiếp 5. Khác ..................... |
| ||
| C8. Xét nghiệm HIV | 1. Có, cơ sở này → mã số KH TVXN HIV: 2. Có, cơ sở khác → tên: ngày XN HIV: …/…/…… 3. Không (dừng tại đây) | 1. Có, cơ sở này → mã số KH TVXN HIV: 2. Có, cơ sở khác → tên: ngày XN HIV: …/…/…… 3. Không (dừng tại đây) | 1. Có, cơ sở này → mã số KH TVXNHIV: 2. Có, cơ sở khác → tên: ngày XN HIV: …/…/…… 3. Không (dừng tại đây) |
| ||
| C9. Kết quả XN HIV | 1. Âm tính a. Có, đã tham gia PrEP ngày: …/…/…… 2. Dương tính khẳng định a. Có, đã tham gia ART ngày: …/…/…… 3. Không xác định 4. Từ chối trả lời | 1. Âm tính a. Có, đã tham gia PrEP ngày: …/…/…… 2. Dương tính khẳng định a. Có, đã tham gia ART ngày: …/…/…… 3. Không xác định 4. Từ chối trả lời | 1. Âm tính a. Có, đã tham gia PrEP ngày: …/…/…… 2. Dương tính khẳng định a. Có, đã tham gia ART ngày: …/…/…… 3. Không xác định 4. Từ chối trả lời |
| ||
[*] (1) mới nhiễm HIV và chưa điều trị; (2) chưa điều trị ARV; (3) điều trị ARV <6 tháng; (4) điều trị ARV ≥6 tháng, TLVR >200 bản sao/ml; (5) điều trị ARV ≥6 tháng, nghi ngờ thất bại; (6) điều trị ARV ≥6 tháng, TLVR ≤200 bản sao/ml; (7) bỏ trị ARV
[**] (1) người NCMT; (2) nam có QHTD đồng giới; (3) người bán dâm; (4) người chuyển giới; (5) vợ/chồng/bạn tình/con đẻ ≤15 tuổi của NCH; (6) bạn chích chung của NCH; (7) vợ/chồng/bạn tình của người NCMT; (8) vợ/bạn tình nữ của nam có QHTD đồng giới; (9) người mua dâm; (10) người có nhiều bạn tình; (11) bệnh nhân nghi AIDS; (12) bệnh nhân lao; (13) người mắc nhiễm trùng LTQĐTD; (14) phạm nhân; (15) phụ nữ mang thai; (16) khác
PHỤ LỤC 07: PHƯƠNG THỨC VÀ NỘI DUNG BÁO CÁO
1. Sơ đồ phối hợp các đơn vị triển khai hoạt động xét nghiệm nhiễm mới HIV
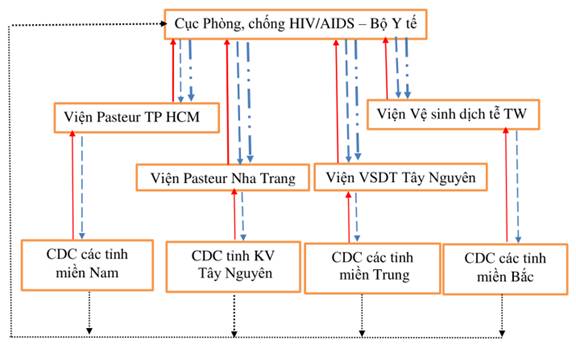
Chú thích:
![]() Báo cáo sinh phẩm
Báo cáo sinh phẩm
![]() Báo cáo chuyên môn (Bộ công cụ trực tuyến, báo cáo bản giấy)
Báo cáo chuyên môn (Bộ công cụ trực tuyến, báo cáo bản giấy)
![]() Chia sẻ số liệu
Chia sẻ số liệu
![]() Quản lý, hỗ trợ kỹ thuật và cảnh báo dịch
Quản lý, hỗ trợ kỹ thuật và cảnh báo dịch
2. Bảng phương thức và nội dung báo cáo
| Thời gian | Hoạt động | Phụ trách |
| Ngày 5 hàng tháng | Gửi báo cáo về Cục Phòng, chống HIV/AIDS: - Sổ xét nghiệm HIV với đầy đủ thông tin các ca làm xét nghiệm nhiễm mới theo đúng biểu mẫu Phụ lục 3. Lưu ý: chỉ dùng mã số do đơn vị gửi mẫu cấp để bảo mật thông tin của bệnh nhân. - Báo cáo tổng thể tình hình thuận lợi, khó khăn trong hoạt động thực hiện xét nghiệm nhiễm mới. | Cán bộ đầu mối phụ trách xét nghiệm nhiễm mới tuyến tỉnh thuộc Trung tâm kiểm soát bệnh tật hoặc Trung tâm phòng, chống HIV/AIDS tỉnh/ thành phố thu thập thông tin các cơ sở có thực hiện xét nghiệm nhiễm mới.
|
| Ngày 5 hàng tháng | - Báo cáo trực tuyến: hệ thống báo cáo bộ công cụ quản lý trực tuyến dữ liệu nhiễm mới HIV - Báo cáo bằng văn bản | Cán bộ đầu mối phụ trách xét nghiệm nhiễm mới tuyến tỉnh tải số liệu xét nghiệm nhiễm mới lên công cụ trực tuyến quản lý số liệu nhiễm mới. |
| Ngày 5 hàng tháng | Báo cáo tình hình sử dụng và quản lý sinh phẩm | Phòng xét nghiệm tham chiếu Quốc gia |
| Ngày 5 hàng tháng | Kiểm tra số liệu xét nghiệm nhiễm mới trên bộ công cụ quản lý trực tuyến dữ liệu nhiễm mới HIV của các đơn vị và đối chiếu với kết quả báo cáo trực tiếp nhằm đảm bảo chất lượng số liệu cập nhật trên hệ thống. | Cục Phòng, chống HIV/AIDS: - Kiểm tra, đôn đốc việc cập nhật số liệu của các tỉnh, - Đánh giá xu hướng, chia sẻ dữ liệu cho các chương trình khác như dự phòng, truyền thông, chăm sóc điều trị… - Điều phối, bảo đảm nguồn sinh phẩm |
- 1Công văn 282/BHXH-CSYT năm 2019 hướng dẫn thanh toán chi phí khám chữa bệnh bảo hiểm y tế của các xét nghiệm theo dõi điều trị HIV/AIDS do Bảo hiểm xã hội Việt Nam ban hành
- 2Thông tư 04/2019/TT-BYT quy định về phân cấp thẩm quyền cấp, điều chỉnh, thu hồi giấy chứng nhận đủ điều kiện xét nghiệm khẳng định các trường hợp HIV dương tính và đình chỉ hoạt động xét nghiệm khẳng định các trường hợp HIV dương tính do Bộ trưởng Bộ Y tế ban hành
- 3Nghị định 63/2021/NĐ-CP hướng dẫn Luật Phòng, chống nhiễm vi rút gây ra hội chứng suy giảm miễn dịch mắc phải ở người (HIV/AIDS) sửa đổi
- 4Công văn 367/AIDS-GSXN năm 2021 về tăng cường bảo mật và đảm bảo tính chính xác thông tin các trường hợp xét nghiệm nhiễm HIV do Cục Phòng, chống HIV/AIDS ban hành
- 5Thông tư 09/2021/TT-BYT quy định về quy trình, thời điểm, số lần xét nghiệm HIV cho phụ nữ mang thai; chăm sóc, điều trị đối với phụ nữ nhiễm HIV trong thời kỳ mang thai, khi sinh con, cho con bú và biện pháp nhằm giảm lây nhiễm HIV từ mẹ sang con do Bộ trưởng Bộ Y tế ban hành
- 6Kế hoạch 455/KH-BGDĐT thực hiện nhiệm vụ Chính phủ giao trong Chương trình công tác phòng chống HIV/ADIS, ma túy, mại dâm năm 2021 của Bộ Giáo dục và Đào tạo
- 7Quyết định 5946/QĐ-BYT năm 2021 sửa đổi nội dung trong “Kế hoạch triển khai điều trị viêm gan vi rút C trên người bệnh đồng nhiễm HIV/viêm gan vi rút C do Dự
- 1Luật phòng, chống nhiễm vi rút gây ra hội chứng suy giảm miễn dịch mắc phải ở người (HIV/AIDS) 2006
- 2Nghị định 75/2016/NĐ-CP quy định điều kiện thực hiện xét nghiệm HIV
- 3Nghị định 75/2017/NĐ-CP quy định chức năng, nhiệm vụ, quyền hạn và cơ cấu tổ chức của Bộ Y tế
- 4Quyết định 2674/QĐ-BYT năm 2018 về hướng dẫn quốc gia xét nghiệm HIV do Bộ trưởng Bộ Y tế ban hành
- 5Nghị định 155/2018/NĐ-CP sửa đổi quy định liên quan đến điều kiện đầu tư kinh doanh thuộc phạm vi quản lý nhà nước của Bộ Y tế
- 6Công văn 282/BHXH-CSYT năm 2019 hướng dẫn thanh toán chi phí khám chữa bệnh bảo hiểm y tế của các xét nghiệm theo dõi điều trị HIV/AIDS do Bảo hiểm xã hội Việt Nam ban hành
- 7Quyết định 1112/QĐ-BYT năm 2019 về Hướng dẫn thực hiện xét nghiệm tải lượng HIV trong theo dõi, điều trị HIV/AIDS do Bộ trưởng Bộ Y tế ban hành
- 8Thông tư 04/2019/TT-BYT quy định về phân cấp thẩm quyền cấp, điều chỉnh, thu hồi giấy chứng nhận đủ điều kiện xét nghiệm khẳng định các trường hợp HIV dương tính và đình chỉ hoạt động xét nghiệm khẳng định các trường hợp HIV dương tính do Bộ trưởng Bộ Y tế ban hành
- 9Nghị định 63/2021/NĐ-CP hướng dẫn Luật Phòng, chống nhiễm vi rút gây ra hội chứng suy giảm miễn dịch mắc phải ở người (HIV/AIDS) sửa đổi
- 10Công văn 367/AIDS-GSXN năm 2021 về tăng cường bảo mật và đảm bảo tính chính xác thông tin các trường hợp xét nghiệm nhiễm HIV do Cục Phòng, chống HIV/AIDS ban hành
- 11Thông tư 09/2021/TT-BYT quy định về quy trình, thời điểm, số lần xét nghiệm HIV cho phụ nữ mang thai; chăm sóc, điều trị đối với phụ nữ nhiễm HIV trong thời kỳ mang thai, khi sinh con, cho con bú và biện pháp nhằm giảm lây nhiễm HIV từ mẹ sang con do Bộ trưởng Bộ Y tế ban hành
- 12Kế hoạch 455/KH-BGDĐT thực hiện nhiệm vụ Chính phủ giao trong Chương trình công tác phòng chống HIV/ADIS, ma túy, mại dâm năm 2021 của Bộ Giáo dục và Đào tạo
- 13Quyết định 5946/QĐ-BYT năm 2021 sửa đổi nội dung trong “Kế hoạch triển khai điều trị viêm gan vi rút C trên người bệnh đồng nhiễm HIV/viêm gan vi rút C do Dự
Quyết định 2834/QĐ-BYT năm 2021 hướng dẫn thực hiện xét nghiệm phát hiện nhiễm mới HIV và sử dụng số liệu xét nghiệm phát hiện nhiễm mới HIV trong phòng chống HIV/AIDS do Bộ Y tế ban hành
- Số hiệu: 2834/QĐ-BYT
- Loại văn bản: Quyết định
- Ngày ban hành: 09/06/2021
- Nơi ban hành: Bộ Y tế
- Người ký: Đỗ Xuân Tuyên
- Ngày công báo: Đang cập nhật
- Số công báo: Dữ liệu đang cập nhật
- Ngày hiệu lực: 09/06/2021
- Tình trạng hiệu lực: Kiểm tra

