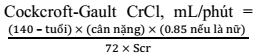Để sử dụng toàn bộ tiện ích nâng cao của Hệ Thống Pháp Luật vui lòng lựa chọn và đăng ký gói cước.
| BỘ Y TẾ | CỘNG HÒA XÃ HỘI CHỦ NGHĨA VIỆT NAM |
| Số: 2388/QĐ-BYT | Hà Nội, ngày 12 tháng 8 năm 2024 |
BỘ TRƯỞNG BỘ Y TẾ
Căn cứ Luật Khám bệnh, chữa bệnh năm 2023;
Căn cứ Nghị định số 95/2022/NĐ-CP ngày 15 tháng 11 năm 2022 của Chính phủ quy định chức năng, nhiệm vụ, quyền hạn và cơ cấu tổ chức của Bộ Y tế;
Theo đề nghị của Cục trưởng Cục Quản lý khám, chữa bệnh.
QUYẾT ĐỊNH:
Điều 1. Ban hành kèm theo Quyết định này tài liệu chuyên môn “Hướng dẫn chẩn đoán và điều trị bệnh thận mạn và một số bệnh lý thận”.
Điều 2. Tài liệu chuyên môn “Hướng dẫn chẩn đoán và điều trị bệnh thận mạn và một số bệnh lý thận” được áp dụng tại các cơ sở khám bệnh, chữa bệnh trong cả nước.
Điều 3. Bãi bỏ bài “Bệnh thận đái tháo đường”, “Bệnh thận IgA”, “Viêm thận Lupus”, “Bệnh thận mạn” trong Hướng dẫn chẩn đoán và điều trị một số bệnh về thận - tiết niệu được ban hành tại Quyết định số 3931/QĐ-BYT ngày 21 tháng 09 năm 2015 của Bộ trưởng Bộ Y tế.
Điều 5. Các ông, bà: Chánh Văn phòng Bộ, Chánh thanh tra Bộ, Cục trưởng và Vụ trưởng các Cục, Vụ thuộc Bộ Y tế, Giám đốc Sở Y tế các tỉnh, thành phố trực thuộc trung ương, Giám đốc các Bệnh viện trực thuộc Bộ Y tế, Thủ trưởng Y tế các ngành chịu trách nhiệm thi hành Quyết định này./.
|
| KT. BỘ TRƯỞNG |
CHẨN ĐOÁN & ĐIỀU TRỊ BỆNH THẬN MẠN VÀ MỘT SỐ BỆNH LÝ THẬN
(Ban hành kèm theo quyết định số 2388/QĐ-BYT ngày 12 tháng 8 năm 2024 của Bộ trưởng Bộ Y tế)
CHỈ ĐẠO BIÊN SOẠN
GS.TS. Trần Văn Thuấn - Thứ trưởng Bộ Y tế
CHỦ BIÊN
GS.TS. Võ Tam - Phó Chủ tịch Hội Tiết niệu Thận học Việt Nam
PGS.TS. Hà Phan Hải An - Phó Chủ tịch Hội Tiết niệu Thận học Việt Nam
THAM GIA BIÊN SOẠN - THẨM ĐỊNH
PGS.TS. Hà Phan Hải An
ThS. Đặng Ngọc Tuấn Anh
PGS.TS. Nguyễn Bách
PGS.TS. Hoàng Bùi Bảo
TS. Nguyễn Thế Cường
BSCKII. Tạ Phương Dung
TS. Nguyễn Hữu Dũng
PGS.TS. Đặng Thị Việt Hà
ThS. BS. Đinh Thị Minh Hảo
TS. Phạm Ngọc Hùng
BSCKII. Hoàng Thị Thanh Huyền
PGS.TS. Trần Thị Bích Hương
PGS.TS. Lê Đình Khánh
TS. Nguyễn Trọng Khoa
ThS. Đỗ Trường Minh
ThS. Trương Lê Vân Ngọc
GS.TS Võ Tam
PGS.TS. Đỗ Gia Tuyển
TS. Huỳnh Ngọc Phương Thảo
PGS.TS. Lê Việt Thắng
BSCKII. Nguyễn Lê Thuận
TS. Lê Thị Hồng Vân
TS. Nguyễn Hoàng Thanh Vân
THƯ KÝ
ThS. Đỗ Trường Minh
ThS. Trương Lê Vân Ngọc
CN. Đỗ Thị Thư
CHẨN ĐOÁN VÀ ĐIỀU TRỊ BỆNH THẬN MẠN
1. ĐẠI CƯƠNG
2. NGUYÊN NHÂN
2.1. NGUYÊN NHÂN GÂY BỆNH THẬN MẠN
2.2. YẾU TỐ NGUY CƠ GÂY BTM HOẶC ĐẨY NHANH TIẾN TRIỂN BTM
2.2.1. CÁC YẾU TỐ LÀM THẬN TĂNG NHẠY CẢM
2.2.2. CÁC YẾU TỐ KHỞI ĐỘNG TỔN THƯƠNG THẬN TRỰC TIẾP
2.2.3. CÁC YẾU TỐ THÚC ĐẨY BTM TIẾN TRIỂN (LÀM NẶNG TỔN THƯƠNG VÀ TĂNG TỐC QUÁ TRÌNH GIẢM CHỨC NĂNG THẬN)
3. CHẨN ĐOÁN
3.1. LÂM SÀNG
3.2. QUY TRÌNH SÀNG LỌC, TẦM SOÁT BỆNH THẬN MẠN
3.2.1. CÁC ĐỐI TƯỢNG CẦN ĐƯỢC TẦM SOÁT BTM CHỦ ĐỘNG VÀ TẦN SUẤT TẦM SOÁT
3.2.2. ĐÁNH GIÁ TỔN THƯƠNG HAY HƯ HỎNG MÔ THẬN
3.2.3. ĐÁNH GIÁ CHỨC NĂNG THẬN
3.3. XÁC ĐỊNH CHẨN ĐOÁN
3.4. PHÂN GIAI ĐOẠN VÀ PHÂN TẦNG NGUY CƠ
3.4.1. PHÂN GIAI ĐOẠN BỆNH THẬN MẠN
3.4.2. PHÂN TẦNG NGUY CƠ TIẾN TRIỂN BỆNH THẬN MẠN VÀ TẦN SUẤT KHÁM THEO DÕI
3.5. CHẨN ĐOÁN PHÂN BIỆT
4. ĐIỀU TRỊ BẢO TỒN CHỨC NĂNG THẬN
4.1. NGUYÊN TẮC CHUNG
4.1.1. CÁC BIỆN PHÁP ĐIỀU TRỊ BTM GIAI ĐOẠN CHƯA THAY THẾ
4.1.2. CẤU TRÚC VÀ QUY TRÌNH QUẢN LÝ BẢO TỒN THẬN TOÀN DIỆN
MỤC TIÊU CỦA ĐIỀU TRỊ BẢO TỒN TOÀN DIỆN BTM:
4.2. MỤC TIÊU ĐIỀU TRỊ BTM GIAI ĐOẠN CHƯA ĐIỀU TRỊ THAY THẾ THẬN SUY
4.3. KIỂM SOÁT HUYẾT ÁP
4.3.1. CHẨN ĐOÁN VÀ PHÂN ĐỘ TĂNG HUYẾT ÁP
4.3.2. ĐIỀU TRỊ
4.4. KIỂM SOÁT THIẾU MÁU
4.4.1. CHẨN ĐOÁN
4.4.2. KIỂM SOÁT THIẾU MÁU
4.5. KIỂM SOÁT ĐƯỜNG MÁU
4.5.1. ĐẠI CƯƠNG
4.5.2. CHẨN ĐOÁN ĐTĐ VÀ THEO DÕI ĐƯỜNG MÁU
4.5.3. ĐIỀU TRỊ
4.6. KIỂM SOÁT LIPID MÁU
4.6.1. ĐẠI CƯƠNG VỀ RỐI LOẠN LIPID MÁU VÀ BTM
4.6.2. TẦM SOÁT RỐI LOẠN LIPID MÁU
4.6.3. KIỂM SOÁT LIPID MÁU
4.7. KIỂM SOÁT TĂNG ACID URIC MÁU
4.7.1. LÂM SÀNG CỦA TĂNG ACID URIC
4.7.2. ĐIỀU TRỊ
4.8. KIỂM SOÁT RỐI LOẠN CHUYỂN HÓA XƯƠNG VÀ KHOÁNG XƯƠNG
4.8.1. ĐẠI CƯƠNG
4.8.2. CHẨN ĐOÁN VÀ CHẨN ĐOÁN PHÂN BIỆT
4.8.3. KIỂM SOÁT RỐI LOẠN XƯƠNG VÀ KHOÁNG XƯƠNG TRONG BTM
4.8.4. BỆNH XƯƠNG DO THẬN CÓ CHU CHUYỂN XƯƠNG THẤP
4.9. KIỂM SOÁT TĂNG KALI MÁU
4.9.1. NGUYÊN NHÂN
4.9.2. LÂM SÀNG VÀ CHẨN ĐOÁN
4.9.3. ĐIỀU TRỊ
4.10. KIỂM SOÁT TOAN CHUYỂN HÓA
4.10.1. NGUYÊN NHÂN NHIỄM TOAN CHUYỂN HÓA
4.10.2. CHẨN ĐOÁN NHIỄM TOAN CHUYỂN HÓA
4.10.3. ĐIỀU TRỊ TOAN CHUYỂN HÓA
4.11. KIỂM SOÁT TỔN THƯƠNG THẬN CẤP TRONG BTM
4.11.1. ĐẠI CƯƠNG
4.11.2. NGUYÊN NHÂN
4.11.3. DẤU HIỆU LÂM SÀNG
4.11.4. CẬN LÂM SÀNG
4.11.5. CHẨN ĐOÁN
4.11.6. ĐIỀU TRỊ
4.12. KIỂM SOÁT VIÊM GAN VIRUS B, C Ở BỆNH NHÂN BTM
4.12.1. VIÊM GAN VIRUS B
4.12.2. VIÊM GAN VIRUS C
5. ĐIỀU TRỊ GIAI ĐOẠN TIỀN LỌC MÁU
5.1. NGUYÊN TẮC CHUNG
5.1.1. MỘT SỐ ĐỊNH NGHĨA
5.1.2. THỜI ĐIỂM KHỞI ĐẦU ĐIỀU TRỊ THAY THẾ THẬN
5.1.3. THỜI ĐIỂM CHUYỂN CHUYÊN KHOA THẬN THEO DÕI
5.2. MỤC TIÊU ĐIỀU TRỊ
5.2.1. VAI TRÒ VÀ LỢI ÍCH CỦA GIAI ĐOẠN TIỀN LỌC MÁU
5.2.2. MỤC TIÊU CỦA GIAI ĐOẠN TIỀN LỌC MÁU
5.3. ĐIỀU TRỊ CỤ THỂ
5.3.1. NHỮNG VIỆC CẦN LÀM TRONG GIAI ĐOẠN TIỀN LỌC MÁU
5.3.2. ĐIỀU TRỊ BẢO TỒN NỘI KHOA TÍCH CỰC VÀ CHĂM SÓC HỖ TRỢ
6. ĐIỀU TRỊ THAY THẾ THẬN SUY
6.1. ĐIỀU TRỊ THAY THẾ THẬN BẰNG THẬN NHÂN TẠO
6.1.1. NGUYÊN LÝ CHUNG
6.1.2. MỤC TIÊU ĐIỀU TRỊ
6.1.3. ĐIỀU TRỊ CỤ THỂ
6.1.4. BIẾN CHỨNG CỦA THẬN NHÂN TẠO VÀ XỬ TRÍ
6.2. ĐIỀU TRỊ THAY THẾ THẬN BẰNG LỌC MÀNG BỤNG
6.2.1. NGUYÊN LÝ CHUNG
6.2.2. MỤC TIÊU ĐIỀU TRỊ LỌC MÀNG BỤNG
6.2.3. ĐIỀU TRỊ CỤ THỂ
6.2.4. BIẾN CHỨNG LỌC MÀNG BỤNG VÀ XỬ TRÍ
6.2.5. QUẢN LÝ BỆNH NHÂN LỌC MÀNG BỤNG
6.2.6. PHÒNG BỆNH
6.3. GHÉP THẬN
6.3.1. CHỈ ĐỊNH VÀ CHỐNG CHỈ ĐỊNH
6.3.2. MIỄN DỊCH TRONG GHÉP THẬN
6.3.4. MỘT SỐ BIẾN CHỨNG SAU GHÉP THẬN
7. ĐIỀU TRỊ MỘT SỐ VẤN ĐỀ KHÁC Ở BTM
7.1. ĐIỀU TRỊ SUY TIM Ở BỆNH NHÂN BỆNH THẬN MẠN
7.1.1. ĐẠI CƯƠNG
7.1.2. CHẨN ĐOÁN
7.1.3. ĐIỀU TRỊ
7.2. ĐIỀU TRỊ BỆNH MẠCH VÀNH Ở BỆNH NHÂN BỆNH THẬN MẠN
7.2.1. ĐẠI CƯƠNG
7.2.2. CHẨN ĐOÁN
7.2.3. ĐIỀU TRỊ
7.3. ĐIỀU TRỊ BỆNH ĐỘNG MẠCH NGOẠI VI Ở BỆNH NHÂN BTM
7.3.1. ĐẠI CƯƠNG
7.3.2. CHẨN ĐOÁN
7.3.3. ĐIỀU TRỊ
7.4. LƯU Ý TRONG SỬ DỤNG THUỐC Ở BỆNH NHÂN BỆNH THẬN MẠN
7.4.1. ĐẠI CƯƠNG
7.4.2. CÁC KHUYẾN CÁO VỀ LƯU Ý TRONG SỬ DỤNG THUỐC
7.5. SỬ DỤNG THUỐC CẢN QUANG CHỨA IOD Ở BỆNH NHÂN BỆNH THẬN MẠN
7.5.1. ĐẠI CƯƠNG
7.5.2. CÁC YẾU TỐ NGUY CƠ CỦA CA-AKI VÀ CI-AKI
7.5.3. ĐỐI TƯỢNG CẦN ĐIỀU TRỊ DỰ PHÒNG TRƯỚC KHI SỬ DỤNG THUỐC CẢN QUANG
7.5.4. CÁC PHƯƠNG PHÁP ĐIỀU TRỊ DỰ PHÒNG
7.6. SỬ DỤNG THUỐC ĐỐI QUANG TỪ CHỨA GADOLINIUM Ở BỆNH NHÂN BỆNH THẬN MẠN
7.6.1. ĐẠI CƯƠNG
7.6.2. KHUYẾN CÁO SỬ DỤNG THUỐC ĐỐI QUANG TỪ Ở BỆNH NHÂN BTM
7.7. CHỈNH LIỀU THUỐC Ở BỆNH NHÂN BỆNH THẬN MẠN
7.7.1. ĐẠI CƯƠNG
7.7.2. CÁC CÔNG THỨC THƯỜNG ĐƯỢC SỬ DỤNG ĐỂ ĐÁNH GIÁ CHỨC NĂNG THẬN
7.7.3. CÁC PHƯƠNG PHÁP CHỈNH LIỀU THUỐC Ở BỆNH NHÂN BTM
7.7.4. CÁC BƯỚC THỰC HIỆN CHỈNH LIỀU THUỐC CHO BỆNH NHÂN BTM
7.7.5. LIỀU LƯỢNG MỘT SỐ THUỐC DỰA TRÊN CHỨC NĂNG THẬN
7.8. DỰ PHÒNG NHIỄM TRÙNG Ở BỆNH NHÂN BỆNH THẬN MẠN
7.8.1. ĐẠI CƯƠNG
7.8.2. CÁC TÁC NHÂN GÂY NHIỄM TRÙNG PHỔ BIẾN Ở BỆNH NHÂN BTM
7.8.3. CHIẾN LƯỢC DỰ PHÒNG NHIỄM TRÙNG Ở BỆNH NHÂN BTM TẠI CÁC CƠ SỞ LỌC MÁU
7.8.4. KHUYẾN CÁO VỀ TIÊM VẮC XIN CHO BỆNH NHÂN CÓ BTM
8. TIẾN TRIỂN VÀ BIẾN CHỨNG CỦA BTM
9. PHÒNG NGỪA TIẾN TRIỂN BTM
BỆNH THẬN ĐÁI THÁO ĐƯỜNG
1. ĐẠI CƯƠNG
2. CHẨN ĐOÁN
3. ĐIỀU TRỊ
4. TIẾN TRIỂN VÀ BIẾN CHỨNG
5. PHÒNG BỆNH
VIÊM THẬN LUPUS
1. ĐẠI CƯƠNG
2. NGUYÊN NHÂN
3. CHẨN ĐOÁN
4. ĐIỀU TRỊ
5. ĐIỀU TRỊ VIÊM THẬN LUPUS TÁI PHÁT
6. VIÊM THẬN LUPUS Ở CÁC TÌNH HUỐNG LÂM SÀNG ĐẶC BIỆT
6.1 VIÊM THẬN LUPUS VÀ THUYÊN TẮC VI MẠCH HUYẾT KHỐI
6.2 THAI KỲ Ở BỆNH NHÂN VIÊM THẬN LUPUS
6.3 ĐIỀU TRỊ VIÊM THẬN LUPUS KÈM SUY THẬN
BỆNH THẬN IGA
1. ĐẠI CƯƠNG
2. NGUYÊN NHÂN
3. CHẨN ĐOÁN
4. ĐIỀU TRỊ
4.1 NGUYÊN TẮC CHUNG
4.2 MỤC TIÊU ĐIỀU TRỊ
4.3 ĐIỀU TRỊ CỤ THỂ
5. TIẾN TRIỂN VÀ BIẾN CHỨNG
BỆNH CẦU THẬN THAY ĐỔI TỐI THIỂU
1. ĐẠI CƯƠNG
2. NGUYÊN NHÂN
3. CHẨN ĐOÁN
4. ĐIỀU TRỊ BỆNH CẦU THẬN THAY ĐỔI TỐI THIỂU CÓ HCTH
5. TIẾN TRIỂN VÀ BIẾN CHỨNG
6. QUẢN LÝ VÀ PHÒNG BỆNH
XƠ CẦU THẬN Ổ-CỤC BỘ
1. ĐẠI CƯƠNG
2. NGUYÊN NHÂN
3. LÂM SÀNG VÀ CẬN LÂM SÀNG
4. CHẨN ĐOÁN
5. ĐIỀU TRỊ
6. TIẾN TRIỂN VÀ BIẾN CHỨNG
7. QUẢN LÝ VÀ PHÒNG BỆNH
BỆNH CẦU THẬN MÀNG
1. ĐẠI CƯƠNG
2. NGUYÊN NHÂN
3. LÂM SÀNG VÀ CẬN LÂM SÀNG
4. CHẨN ĐOÁN
5. ĐIỀU TRỊ
6. TIẾN TRIỂN VÀ BIẾN CHỨNG
7. QUẢN LÝ VÀ PHÒNG BỆNH
VIÊM CẦU THẬN THỨ PHÁT SAU NHIỄM TRÙNG
1. ĐẠI CƯƠNG
2. NGUYÊN NHÂN
3. LÂM SÀNG VÀ CẬN LÂM SÀNG
4. CHẨN ĐOÁN
5. ĐIỀU TRỊ
6. TIẾN TRIỂN VÀ BIẾN CHỨNG
7. QUẢN LÝ VÀ PHÒNG BỆNH
VIÊM CẦU THẬN DO VIÊM MẠCH LIÊN QUAN ĐẾN ANCA
1. ĐẠI CƯƠNG
2. CHẨN ĐOÁN
3. ĐIỀU TRỊ
4. TIẾN TRIỂN VÀ BIẾN CHỨNG
5. PHÒNG BỆNH
VIÊM CẦU THẬN DO KHÁNG THỂ KHÁNG MÀNG ĐÁY
1. ĐẠI CƯƠNG
2. NGUYÊN NHÂN
3. CHẨN ĐOÁN
4. ĐIỀU TRỊ
5. TIẾN TRIỂN VÀ BIẾN CHỨNG
6. PHÒNG BỆNH
BỆNH THẬN ĐA NANG DI TRUYỀN TRỘI NHIỄM SẮC THỂ THƯỜNG Ở NGƯỜI LỚN
1. ĐẠI CƯƠNG
2. NGUYÊN NHÂN
3. CHẨN ĐOÁN
4. ĐIỀU TRỊ
5. TIẾN TRIỂN VÀ BIẾN CHỨNG
6. PHÒNG BỆNH
TÀI LIỆU THAM KHẢO
DANH MỤC THUẬT NGỮ, CHỮ VIẾT TẮT
| Tiếng Anh | Viết tắt | Tiếng Việt | Viết tắt |
| ANCA associated vasculitides | AAV | Viêm mạch liên quan ANCA |
|
| Angiotensin converting enzyme inhibitor | ACEI | Thuốc ức chế men chuyển | ƯCMC |
| Autosomal dominant polycystic kidney disease | ADPKD | Bệnh thận đa nang di truyền trội qua nhiễm sắc thể thường |
|
| Acute kidney injury | AKI | Tổn thương thận cấp | TTTC |
| Antineutrophil cytoplasmic antibodies | ANCA | Kháng thể kháng bào tương bạch cầu đa nhân trung tính |
|
| Anti-glomerular basement membrane antibody | Anti- GBM Ab | Kháng thể kháng màng đáy cầu thận | KMĐCT |
| Angiotensin receptor blocker | ARB | Thuốc ức chế thụ thể angiotensin | ƯCTT |
| Arteriovenous fistula | AVF | Thông động - tĩnh mạch |
|
| Arteriovenous graft | AVG | Cầu nối động- tĩnh mạch |
|
| Area-under-the-curve | AUC | Diện tích dưới đường cong |
|
| Atherosclerosis |
| Xơ vữa động mạch | XVĐM |
| Body mass index | BMI | Chỉ số khối cơ thể |
|
| Blood pressure | BP | Huyết áp | HA |
| Systolic blood pressure | SBP | Huyết áp tâm thu | HATT |
| Diastolic blood pressure | DBP | Huyết áp tâm trương | HATTr |
| Office blood pressure | OPB | Huyết áp phòng khám | HAPK |
| Contrast-associated acute kidney injury | CA-AKI | Tổn thương thận cấp liên quan đến thuốc cản quang |
|
| Contrast-induced acute kidney injury | CI-AKI | Tổn thương thận cấp do thuốc cản quang |
|
| Cardiovascular disease | CVD | Bệnh tim mạch |
|
| Continuous glucose monitoring | CGM | Theo dõi đường máu liên tục |
|
| Chronic kidney disease | CKD | Bệnh thận mạn | BTM |
| Chronic kidney disease - Mineral and Bone disease | CKD- MBD | Bệnh xương và khoáng xương do bệnh thận mạn |
|
| Maximum concentration | Cmax | Nồng độ thuốc tối đa |
|
| Calcineurin inhibitor | CNI | Thuốc ức chế calcineurin |
|
| Creatinine clearance | CrCl | Độ thanh thải creatinine |
|
| Diabetes mellitus | DM | Đái tháo đường | ĐTĐ |
| Direct renin inhibitor | DRI | Thuốc ức chế renin trực tiếp |
|
| Dipeptidyl peptidase-4 inhibitor | DPP-4 | Thuốc ức chế men Dipeptidyl peptidase 4 |
|
| Erythropoietin | EPO |
|
|
| Erythropoiesis stimulating agent | ESA | Thuốc kích thích tạo hồng cầu |
|
| End-stage renal disease | ESRD | Bệnh thận giai đoạn cuối | BTGĐC |
| Ejection Fraction | EF | Phân suất tống máu |
|
| Focal segmental glomerulosclerosis | FSGS | Xơ hóa cầu thận ổ, cục bộ |
|
| Glomerular filtration rate | GFR | Mức lọc cầu thận | MLCT |
| Glucagon-like peptide-1 receptor agonist | GLP-1 RA | Thuốc đồng vận thụ thể GLP-1 |
|
| Gadolinium-based contrast media |
| Thuốc đối quang từ chứa Gadolinium | TĐQTCG |
| Hemoglobin | Hb | Huyết sắc tố |
|
| Hypertension | HT | Tăng huyết áp | THA |
| IgA nephropathy | IgAN | Bệnh thận IgA |
|
| Kidney Disease Improving Global Outcomes | KDIGO | Tổ chức nghiên cứu toàn cầu về hiệu quả cải thiện lâm sàng trong điều trị bệnh thận |
|
| Kidney disease outcomes quality initiative | KDOQI | Tổ chức nghiên cứu các sáng kiến hiệu quả chất lượng trong điều trị bệnh thận |
|
| Minimal change disease | MCD | Bệnh cầu thận thay đổi tối thiểu |
|
| Membranous nephropathy | MN | Bệnh thận màng |
|
| Mineralocorticoid receptor antagonist | MRA | Thuốc đối vận thụ thể mineralocorticoid |
|
| Nephrogenic systemic fibrosis | NSF | Bệnh xơ hóa hệ thống do thận |
|
| Peripheral arterial disease | PAD | Bệnh động mạch ngoại biên |
|
|
|
| Bệnh nhân | BN |
| Hemodialysis | HD | Thận nhân tạo | TNT |
| Peritoneal dialysis | PD | Lọc màng bụng | LMB |
| Polycystic kidney disease | PKD | Bệnh thận đa nang | BTĐN |
| Pure red cell aplasia | PRCA | Bất sản riêng dòng hồng cầu |
|
| Parathyroid hormone | PTH |
|
|
| Renin- Angiotensin- Aldosteron System inhibitor | RAASi | Thuốc ức chế hệ thống RAA |
|
| Subjective global assessment | SGA | Đánh giá chủ quan toàn diện |
|
| Sodium-Glucose contransporter 2 inhibitor | SGLT2i | Thuốc ức chế kênh đồng vận chuyển natri-glucose týp 2 |
|
| Secondary hyperparathyroidism | SHPT | Cường cận giáp thứ phát |
|
| Self Monitoring of Blood Glucose | SMGB | Tự theo dõi đường máu |
|
| Thrombotic microangiopathy | TMA | Bệnh lý vi mạch huyết khối |
|
| Transferrin saturation | TSAT | Độ bão hòa transferrin |
|
| Thiazolidinedione | TZD |
|
|
| Urine albumin-to-creatinine ratio | uACR | Tỉ số albumin/creatinine niệu |
|
| Urine protein-to-creatinine ratio | uPCR | Tỉ số protein/creatinine niệu |
|
| Urine albumin excretion | UAE | Lượng albumin niệu |
|
| Urine protein excretion | UPE | Lượng protein niệu |
|
| Ultrafiltration | UF | Siêu lọc |
|
| Ultrafiltration failure | UFF | Suy siêu lọc |
|
Bảng 1. Bảng quy đổi đơn vị
Bảng 2. Sức mạnh khuyến cáo và mức độ bằng chứng theo KDIGO
Bảng 3. Các nhóm nguyên nhân gây bệnh thận mạn theo vị trí tổn thương
Bảng 4. Một số bệnh lý thận do ung thư và thuốc điều trị ung thư
Bảng 5. Các công thức ước tính chức năng lọc cầu thận dựa vào creatinin máu
Bảng 6. Tiêu chuẩn chẩn đoán bệnh thận mạn
Bảng 7. Các giai đoạn của BTM theo KDIGO 2012 và đồng thuận 2014
Bảng 8. Các nhóm albumin/protein nước tiểu
Bảng 9. Phân giai đoạn, phân tầng nguy cơ và tần suất tái khám hàng năm theo KDIGO 2024
Bảng 10. Mục tiêu quản lý BN BTM bởi bác sĩ không chuyên khoa Thận và chuyên khoa Thận
Bảng 11. Các khuyến cáo về mức huyết áp mục tiêu cho người mắc BTM
Bảng 12. Chỉnh liều một số thuốc ƯCMC và ƯCTT trong BTM
Bảng 13. Tần suất và xét nghiệm theo dõi tình trạng thiếu máu ở BTM
Bảng 14. Một số chế phẩm sắt uống
Bảng 15. Một số chế phẩm sắt truyền tĩnh mạch
Bảng 16. Sử dụng thuốc kích thích tạo hồng cầu
Bảng 17. Liều thuốc ức chế DPP-4 hàng ngày theo chức năng thận
Bảng 18. Nguy cơ hạ đường máu của các thuốc điều trị ĐTĐ
Bảng 19. Các rối loạn lipid máu ở các nhóm BTM
Bảng 20. Liều các thuốc statin sử dụng trong BTM
Bảng 21. Liều khuyến cáo cho các thuốc hạ acid uric máu ở BTM
Bảng 22. Thuốc chỉ định điều trị cơn gút cấp và chỉnh liều trong BTM
Bảng 23. Các chỉ dấu của cường cận giáp thứ phát do thận
Bảng 24. Hệ thống TMV phân loại loạn dưỡng xương do thận
Bảng 25. So sánh các nhóm thuốc gắn phosphate
Bảng 26. Nồng độ mục tiêu của canxi, phosphate và PTH
Bảng 27. Kiểm soát CKD-MBD theo giai đoạn BTM
Bảng 28. Phân loại cơ chế gây toan chuyển hóa
Bảng 29. Phân loại toan chuyển hóa với khoảng trống anion bình thường
Bảng 30. Tiêu chuẩn tổn thương thận cấp theo KDIGO 2012
Bảng 31. Ý nghĩa các xét nghiệm sàng lọc nhiễm virus viêm gan B
Bảng 32. Tiêu chuẩn chẩn đoán các thể bệnh nhiễm viêm gan virus B mạn
Bảng 33. Lựa chọn thuốc kháng virus trong điều trị VGB kháng thuốc
Bảng 34. Liều thuốc nucleoside analogues (NA) điều trị viêm gan B mạn
Bảng 35. Các phác đồ thuốc DAA điều trị viêm gan C theo giai đoạn BTM
Bảng 36. Các yếu tố nguy cơ tiến triển suy thận giai đoạn cuối
Bảng 37. Tiếp cận phát triển chương trình tư vấn và giáo dục cho BN mắc BTM
Bảng 38. Một số thuốc có nguy cơ gây độc thận
Bảng 39. Chỉ định sử dụng thuốc cản quang tĩnh mạch
Bảng 40. Khuyến cáo về sử dụng thuốc cản quang chứa iod
Bảng 41. Phân loại thuốc TĐQTCG dựa theo nguy cơ NSF
Bảng 42. Chỉnh liều một số thuốc kháng sinh theo độ thanh thải creatinine (CrCl)
Bảng 43. Các tác nhân gây nhiễm trùng thường gặp ở bệnh nhân BTM
Bảng 44. Khuyến cáo về tiêm chủng cho người mắc BTM
Bảng 45. Liều thuốc đồng vận thụ thể GLP-1 cho BN mắc BTM
Bảng 46. Phân loại viêm thận lupus theo ISN/RPS 2004
Bảng 47. Các biện pháp làm giảm nhẹ/
Bảng 48. Các phác đồ liều glucocorticoids cho BN viêm thận Lupus
Bảng 49. Các phác đồ liều Cyclophosphamide phối hợp glucocorticoids để điều trị tấn công viêm thận lupus hoạt động nhóm III/IV
Bảng 50. Phân loại đáp ứng điều trị trong viêm thận Lupus
Bảng 51. Phân biệt một số bệnh liên quan viêm mạch máu nhỏ
Bảng 52. Một số phác đồ ức chế miễn dịch tấn công trong VCT liên quan ANCA
Bảng 53. Một số phác đồ ức chế miễn dịch duy trì trong VCT liên quan ANCA
Bảng 54. Phác đồ điều trị VCT do kháng thể kháng màng đáy
Hình 1. Sơ đồ chẩn đoán THA với các phương pháp đo HA tại phòng khám
Hình 2. Sơ đồ chẩn đoán nhiễm toan máu
Hình 3. Tiếp cận toàn diện để cải thiện kết cục của bệnh nhân ĐTĐ và BTM
Hình 4. Các yếu tố cần cân nhắc khi đặt mục tiêu HbA1C
Hình 5. Lựa chọn thuốc hạ đường máu cho bệnh nhân ĐTĐ týp 2 và BTM
Hình 6. Chỉnh liều metformin theo chức năng thận
Hình 7. Sơ đồ chẩn đoán viêm thận lupus
Hình 8. Sơ đồ điều trị ức chế miễn dịch cho viêm thận Lupus nhóm I hoặc II
Hình 9. Sơ đồ điều trị tấn công cho viêm thận Lupus hoạt động nhóm III/IV
Hình 10. Sơ đồ điều trị duy trì cho viêm thận Lupus nhóm III và nhóm IV
Hình 11. Sơ đồ điều trị viêm thận Lupus nhóm V
Hình 12. Sơ đồ điều trị viêm thận lupus kèm bệnh vi mạch huyết khối
Hình 13. Sơ đồ tiếp cận chẩn đoán viêm cầu thận liên quan ANCA
Hình 14. Sơ đồ điều trị viêm cầu thận liên quan ANCA
Bảng 1. Bảng quy đổi đơn vị
| Giá trị | Đơn vị truyền thống | Hệ số chuyển đổi | Đơn vị quốc tế SI |
| Tỉ số albumin / creatinine (ACR) | mg/g | 0,113 | mg/mmol |
| Tỉ số protein / creatinine (PCR) | mg/g | 0,113 | mg/mmol |
| Creatinine | mg/dL | 88,4 | µmol/l |
| BUN (nitơ trong ure máu) | mg/dL | 0,357 | Ure (mmol/l) |
| Phosphate | mg/dL | 0,3229 | mmol/l |
| Calci | mg/dL | 0,2495 | mmol/l |
| Urate | mg/dL | 59,48 | µmol/l |
| Đơn vị SI = Đơn vị truyền thống X Hệ số chuyển đổi | |||
Bảng 2. Sức mạnh khuyến cáo và mức độ bằng chứng theo KDIGO
| Sức mạnh khuyến cáo | Ý nghĩa |
| Mức 1: khuyến nghị | Với bác sỹ: phần lớn bệnh nhân nên được thực hành theo |
| Mức 2: gợi ý | Với bác sỹ: cân nhắc cá thể hóa tùy vào mỗi trường hợp cụ thể |
| Mức độ bằng chứng | Ý nghĩa |
| A: cao | Hiệu quả thực sự rất gần với kết quả ước tính trong nghiên cứu |
| B: trung bình | Hiệu quả thực sự có khả năng rất gần với kết quả nghiên cứu, nhưng có thể có sự khác biệt nhất định |
| C: thấp | Hiệu quả thực sự có thể khác biệt đáng kể so với kết quả nghiên cứu |
| D: rất thấp | Kết quả nghiên cứu không chắc chắn và có thể khác biệt lớn so với hiệu quả thực sự. |
CHẨN ĐOÁN VÀ ĐIỀU TRỊ BỆNH THẬN MẠN
Bệnh thận mạn (BTM) được định nghĩa là các bất thường về cấu trúc hoặc chức năng của thận kéo dài trên 3 tháng do bất kỳ nguyên nhân nào dẫn tới những tác động về sức khỏe người bệnh.
2.1. NGUYÊN NHÂN GÂY BỆNH THẬN MẠN
Bảng 3. Các nhóm nguyên nhân gây bệnh thận mạn theo vị trí tổn thương
| Các nhóm nguyên nhân bệnh thận mạn | |
| Bệnh mạch thận | Bệnh lý vi mạch (microangiopathy diseases) |
| Bệnh lý mạch máu lớn (macroangiopathy diseases) | |
| Bệnh cầu thận | Nguyên phát |
| Thứ phát | |
| Bệnh ống-kẽ thận | Nguyên phát |
| Thứ phát | |
| Bệnh lý tiết niệu | Nhiễm trùng đường tiết niệu |
| Tắc nghẽn đường tiết niệu, trào ngược bàng quang niệu quản | |
| Sỏi tiết niệu | |
| Dị dạng đường tiết niệu | |
Ngoài ra, bệnh lý thận trong ung thư được tách riêng thành một chuyên ngành, bao gồm người bệnh thận mắc ung thư hoặc người ung thư mắc bệnh thận. Tổn thương thận cấp (TTTC) và BTM làm tăng di chứng và tử vong ở tất cả BN, kể cả người bị bệnh ung thư; người bệnh ung thư có các rối loạn đặc trưng của ung thư kèm các biểu hiện của bệnh thận và tần suất BTM và ung thư cao, tuổi thọ của người bệnh ngày càng cải thiện, vì vậy cần có bác sĩ chuyên khoa Thận trong đội ngũ chăm sóc người bệnh ung thư. Tổn thương thận trong ung thư thường là hỗn hợp thông qua nhiều cơ chế khác nhau.
Bảng 4. Một số bệnh lý thận do ung thư và thuốc điều trị ung thư
| Bệnh lý | Hay gặp | Ít gặp |
| Leukemia | TTTC do nhiễm khuẩn, giảm thể tích, ngộ độc thuốc | Bệnh thâm nhiễm, viêm cầu thận, TTTC do hội chứng tiêu khối u |
| Đa u tủy xương | bệnh thận do đa u tủy xương. TTTC do giảm thể tích | Amyloidosis, bệnh lắng đọng chuỗi nhẹ (LCDD), hội chứng Fanconi, TTTC do tăng canxi máu, VCT màng tăng sinh type 1 |
| Lymphoma | TTTC do hội chứng tiêu khối u và giảm thể tích | Bệnh đường tiết niệu do tắc nghẽn, bệnh lý thâm nhiễm, bệnh thận tổn thương tối thiểu (Hodgkin), VCT màng tăng sinh type 1 (u lympho non-Hodgkin) |
| Ung thư tế bào thận | Ngộ độc thuốc ức chế yếu tố tăng trưởng nội mạch (Anti- VEGF) | Bệnh đường tiết niệu do tắc nghẽn, bệnh thận màng |
| Ung thư phổi, đầu cổ | Ngộ độc Platinum | SIADH, viêm cầu thận màng |
| Ung thư đường tiết niệu sinh dục | Bệnh đường tiết niệu do tắc nghẽn | Ngộ độc Platinum |
| Bệnh thận do thuốc thường dùng trong điều trị ung thư | Tổn thương thận cấp, bệnh ống thận, BTM do hóa trị. (VD: cisplatin, ifosfamide, methotrexate); ngộ độc các liệu pháp điều trị đích (gồm protein niệu, TMA, tăng huyết áp) | Viêm thận do xạ trị, TMA, viêm cầu thận |
| Bệnh thận do tắc nghẽn | Các ung thư đường tiết niệu, sinh dục | Lymphoma |
| TTTC: tổn thương thận cấp; LCDD: light chain deposit disease - bệnh lắng đọng chuỗi nhẹ; VCT: viêm cầu thận; TMA: thrombotic microangiopathy - bệnh vi mạch huyết khối; SIADH: Syndrome of inappropriate antidiuretic hormone secretion - Hội chứng tăng tiết hormon chống bài niệu ADH không phù hợp | ||
2.2. YẾU TỐ NGUY CƠ GÂY BTM HOẶC ĐẨY NHANH TIẾN TRIỂN BTM
2.2.1. Các yếu tố làm thận tăng nhạy cảm
- Tuổi cao (thường trên 60 tuổi)
- Tiền sử gia đình có bệnh thận giai đoạn cuối (MLCT <15ml/ph/1,73m2) hoặc bệnh thận di truyền (nhất là những người có quan hệ huyết thống thế hệ 1)
- Đái tháo đường
- Tăng huyết áp
- Gout
- Có tiền sử bị tổn thương thận cấp
- Bệnh tim mạch (bệnh tim thiếu máu cục bộ, suy tim mạn tính, bệnh mạch ngoại vi hay bệnh mạch não) hoặc có các yếu tố nguy cơ của bệnh tim mạch (hút thuốc, rối loạn lipid máu, hội chứng chuyển hóa)
- Giảm khối lượng mô thận
- Nhẹ cân khi sinh/sinh non
- Có 1 thận chức năng duy nhất
- Tiền sản giật/sản giật
- Béo phì (BMI ≥25 kg/m2)
- Điều kiện kinh tế xã hội, môi trường, quần thể mang các biến thể gen gây bệnh cao, chủng tộc châu Á
2.2.2. Các yếu tố khởi động tổn thương thận trực tiếp
- Suy thận cấp/ Tổn thương thận cấp
- Có bệnh lý tắc nghẽn đường tiết niệu hoặc có thay đổi cấu trúc đường tiết niệu, sỏi thận tái phát hay phì đại tuyến tiền liệt
- Có nhiễm trùng mạn tính, nhiễm trùng hệ thống (bao gồm cả viêm gan virus B, C, HIV, SARS-CoV-2)
- Bệnh đa hệ thống, bệnh tự miễn, bệnh ác tính với nguy cơ tổn thương thận tiềm tàng hoặc thường đi kèm với BTM, ví dụ lupus đỏ hệ thống
- Sử dụng thuốc hay cơ chất có thể ảnh hưởng xấu đến chức năng thận hoặc gây độc thận, ví dụ thuốc ức chế calcineurin (ciclosporin hay tacrolimus), hợp chất chứa nguyên tố lithium hay thuốc chống viêm không steroid (sử dụng dài hạn), thuốc kháng virus, kim loại như chì, thủy ngân, thuốc trừ sâu…, và chiếu tia
- Tăng huyết áp
- Đái tháo đường
- Được phát hiện tình cờ có đái máu hay protein nước tiểu
2.2.3. Các yếu tố thúc đẩy BTM tiến triển (làm nặng tổn thương và tăng tốc quá trình giảm chức năng thận)
- Protein nước tiểu dai dẳng
- Tăng huyết áp kiểm soát kém
- Đái tháo đường kiểm soát kém
- Bệnh lý tim mạch đi kèm hút thuốc
- Rối loạn lipid máu
- Điều trị thuốc chống viêm không steroid (NSAIDs) kéo dài
- Tắc nghẽn đường tiết niệu
- Nhiễm toan chuyển hóa
- Tổn thương thận cấp và dùng chất độc thận
- Nhập viện vì suy tim
- Người châu Á
- Béo phì
Ở giai đoạn sớm, BTM thường không có triệu chứng lâm sàng và chỉ được phát hiện nhờ xét nghiệm. Một số trường hợp có triệu chứng lâm sàng của các tình trạng bệnh lý là yếu tố nguy cơ (ví dụ đái tháo đường, tăng huyết áp) hay bệnh lý nguyên nhân gây BTM. Triệu chứng lâm sàng thường xuất hiện ở giai đoạn muộn, việc dựa vào các biểu hiện lâm sàng thường dẫn đến hậu quả chẩn đoán bệnh quá muộn không còn khả năng bảo tồn hoặc có nhiều biến chứng, khó can thiệp hiệu quả hoặc phải điều trị thay thế, làm tăng chi phí điều trị, tăng tỷ lệ biến chứng và tử vong.
3.2. QUY TRÌNH SÀNG LỌC, TẦM SOÁT BỆNH THẬN MẠN
3.2.1. Các đối tượng cần được tầm soát BTM chủ động và tần suất tầm soát
Các đối tượng có yếu tố nguy cơ được liệt kê ở mục 3.1 và 3.2 trên đây cần được ưu tiên tầm soát BTM chủ động bằng cách xác định MLCT dựa vào creatinine máu (hoặc creatinine và cystatin C máu nếu có điều kiện thực hiện cả 2 xét nghiệm này) và xét nghiệm UACR nước tiểu 1 năm 1 lần.
Người trưởng thành, người trẻ tuổi, trẻ em sử dụng thuốc có thể ảnh hưởng xấu đến chức năng thận, ví dụ thuốc ức chế calcineurin (CNI), (ciclosporin hay tacrolimus), hợp chất chứa nguyên tố lithium hay thuốc NSAID (sử dụng dài hạn) cần được theo dõi MLCT tối thiểu hàng năm.
Mọi đối tượng (người trưởng thành, người trẻ tuổi, trẻ em) có tổn thương thận cấp cần được theo dõi MLCT và UACR tối thiểu hàng năm trong ít nhất 3 năm tiếp theo ngay cả khi MLCT đã hồi phục về chỉ số ban đầu để phát hiện sự xuất hiện hay tiến triển BTM. Những người có tổn thương thận cấp ở độ 3 cần được theo dõi lâu hơn nữa.
Cần lưu ý rằng độ tuổi, giới tính, chủng tộc hay tình trạng thừa cân nhưng không đi kèm hội chứng chuyển hóa, đái tháo đường, tăng huyết áp không được coi là yếu tố nguy cơ để chỉ định việc sàng lọc BTM chủ động.
3.2.2. Đánh giá tổn thương hay hư hỏng mô thận
- Ưu tiên sử dụng chỉ số albumin nước tiểu; hoặc trong mẫu nước tiểu 24 giờ, hoặc tính tỷ số albumin/creatinin nước tiểu (UACR) 1 mẫu. Có thể xét nghiệm mẫu nước tiểu bất kỳ nhưng tốt nhất là mẫu nước tiểu đầu buổi sáng lấy giữa dòng. Tốt nhất là định lượng albumin, nếu không có thể định tính albumin bằng que nhúng. Nếu không định lượng được albumin nước tiểu có thể định lượng protein nước tiểu 24 giờ hoặc tính tỷ lệ protein/creatinin nước tiểu (UPCR) 1 mẫu. Nếu không thực hiện được tất cả các phương án trên có thể định tính protein bằng que nhúng.
+ Đối với trẻ em và người trẻ tuổi ưu tiên tầm soát albumin nước tiểu, nên sử dụng chỉ số UACR hơn là UPCR để xét nghiệm lần đầu, do UACR có độ nhạy cao hơn UPCR khi nồng độ protein nước tiểu thấp. Khi kết quả UACR trong khoảng 3-70mg/mmol (30-700mg/g) cần làm lại xét nghiệm với mẫu nước tiểu buổi sáng tiếp theo để khẳng định. Không cần làm lại xét nghiệm nếu UACR từ 70mg/mmol (700mg/g) trở lên.
+ Người trưởng thành, người trẻ tuổi và trẻ em bị đái tháo đường (ĐTĐ); người trưởng thành có MLCT ước tính dưới 60ml/phút/1,73m2 hay có MLCT ước tính từ 60ml/phút/1,73m2 nhưng nghi ngờ có BTM; trẻ em và người trẻ tuổi không bị ĐTĐ nhưng có chỉ số creatinine máu trên ngưỡng bình thường giá trị tham chiếu cho nhóm tuổi tương ứng cần được xét nghiệm protein nước tiểu và UACR.
+ Khi chỉ số UACR từ 70mg/mmol trở lên có thể sử dụng UPCR thay thế UACR.
+ Khi tình cờ phát hiện albumin hoặc protein nước tiểu bằng que nhúng chưa rõ nguyên nhân, cần tầm soát BTM bằng MLCT ước tính và UACR hoặc UPCR với mẫu nước tiểu buổi sáng lấy giữa dòng.
- Tìm hồng cầu nước tiểu
+ Xét nghiệm hồng cầu nước tiểu bằng que nhúng cho người trưởng thành, trẻ tuổi và trẻ em. Khi kết quả là 1+ trở lên cần đánh giá tiếp tục. Không cần soi nước tiểu để khằng định kết quả.
+ Để chẩn đoán phân biệt đái máu vi thể và đái máu thoáng qua khi không có protein nước tiểu, có thể dựa vào kết quả hồng cầu niệu dương tính bằng que nhúng tối thiểu 2 trong 3 lần thử.
+ Khi có đái máu vi thể dai dẳng kèm theo hoặc không kèm theo protein nước tiểu, cần thăm dò bệnh lý ác tính ở đường tiết niệu cho những đối tượng ở độ tuổi phù hợp.
+ Khi có đái máu vi thể dai dẳng không kèm protein nước tiểu cần xét nghiệm hồng cầu, protein hay albumin trong nước tiểu, MLCT và theo dõi HA hàng năm.
- Các thăm dò hình ảnh
+ Siêu âm thận: có giá trị trong phát hiện ứ nước thận đặc biệt ở giai đoạn sớm hoặc ở người bị mất nước, khi có dải xơ sau phúc mạc, khối u hoặc hạch to gây chèn ép. Đa số BN bị bệnh thận giai đoạn muộn thường có thận nhỏ và tăng âm.
+ Chụp hệ tiết niệu ngược dòng: giúp chẩn đoán tắc nghẽn khi không phát hiện được trên siêu âm, phát hiện sỏi thận.
+ Chụp MSCT: giúp xác định rõ hơn các khối và nang thận được phát hiện qua siêu âm, rất nhạy trong phát hiện sỏi thận.
+ Chụp MRI: có thể chỉ định cho BN cần chụp CT nhưng không thể dùng thuốc cản quang tĩnh mạch; rất có giá trị trong chẩn đoán huyết khối tĩnh mạch thận.
+ Chụp thận bằng chất phóng xạ: giúp khảo sát tốt tình trạng hẹp động mạch thận, lượng giá MLCT từng bên.
- Sinh thiết thận: thường được chỉ định khi có giảm chức năng thận và/hoặc có protein niệu tới mức thận hư, và khi chẩn đoán chưa rõ sau khi đã đánh giá phù hợp. Nên sinh thiết thận để đánh giá nguyên nhân và hướng dẫn điều trị khi lâm sàng cho phép
3.2.3. Đánh giá chức năng thận
- Ước tính MLCT dựa vào creatinine
+ Các phòng xét nghiệm nên báo cáo kết quả ước tính MLCT dựa vào công thức ước tính cùng với kết quả creatinine máu. Cần lưu ý xem xét một số tình huống khi mà ước tính MLCT có thể không chính xác.
+ Các phòng xét nghiệm nên chọn công thức ước tính MLCT phù hợp với kỹ thuật định lượng creatinin máu tại đơn vị mình (tham khảo bảng 5), khuyến cáo sử dụng công thức ước tính CKD-EPI cho người trưởng thành và sử dụng kỹ thuật định lượng creatinine có chuẩn hóa theo tài liệu tham chiếu bằng kỹ thuật đồng vị phóng xạ quang phổ khối pha loãng (Isotope Dilution Mass Spectrometry, IDMS).
+ Khuyến cáo người được tầm soát không ăn nhiều thịt trong vòng 12 giờ trước khi lấy máu xét nghiệm. Cần vận chuyển mẫu bệnh phẩm đến phòng xét nghiệm trong vòng 12 giờ sau khi lấy máu.
+ Cần nhận định một cách thận trọng kết quả ước tính MLCT từ 60ml/phút/1,73m2 trở lên, vì trong trường hợp này độ chính xác của chỉ số ước tính có thể giảm dần khi MLCT thực tế tăng dần.
+ Khi thu được kết quả MLCT ước tính dưới 60ml/phút/1,73m2 lần đầu, cần làm lại xét nghiệm để khẳng định trong vòng 2 tuần, có xem xét đến sự dao động sinh học và kỹ thuật của chỉ số creatinine máu được chấp nhận giữa các kết quả (+5%).
+ Trường hợp có thể xét nghiệm được Cystatin C máu, khuyến cáo ước tính MLCT bằng công thức kết hợp creatinin và cystatin C máu. Nếu không thể xét nghiệm cystatin C, nên sử dụng công thức ước tính dựa vào creatinin máu.
Bảng 5. Các công thức ước tính chức năng lọc cầu thận dựa vào creatinin máu
|
| Cockcroft-Gaut | MDRD (Modification of Diet in Renal Disease Study) | CKD-EPI 2021 |
| Ý nghĩa | Độ thanh thải Creatinin (CrCl) | Mức lọc cầu thận ước tính (eGFR) | |
| Công thức |
sCr: creatinine máu (mg/dL) Cân nặng: kg | eGFR = A x sCr-1,154 x tuổi-0,203 x 1,212 (nếu BN chủng tộc da đen) x 0,742 (nếu là nữ) A = 186 (nếu đo sCr theo phương pháp Jaffe) hoặc 175 (nếu đo sCr theo phương pháp IDMS) sCr: creatinine máu (mg/dL) | eGFR = 142 x min(sCr/κ, 1)a x max(sCr/ κ, 1)-1.200 x 0.9938tuổi x 1.012 (nếu là nữ) sCr: creatinine máu (mg/dL) κ= 0.7 (nếu là nữ) và κ= 0.9 (nếu là nam) a= -0.241 (nếu là nữ) và a= -0.302 (nếu là nam) |
| Điều kiện áp dụng | - ≥ 18 tuổi - Cân nặng thực tế nằm trong khoảng 30% cân nặng lý tưởng - Nồng độ creatinin máu ổn định | - > 18 tuổi - Không béo phì - Nồng độ creatinin máu ổn định | |
| Đặc điểm | - CrCl cao hơn GFR thực tế 10-15% (do một phần creatinine được ống thận bài tiết) - Kết quả chưa được hiệu chỉnh theo diện tích bề mặt cơ thể và đặc điểm chủng tộc | - Chính xác hơn Cockcroft-Gaut nếu eGFR < 60 mL/phút/1,73m2 - Kém chính xác hơn ở giá trị eGFR ≥ 60 mL/phút/1,73m2 | CKD-EPI chính xác hơn MDRD, đặc biệt khi eGFR ≥ 60 mL/phút/1,73m2 và không có bệnh thận trước đó |
Nếu định lượng creatinin máu bằng kỹ thuật Jaffe có thể dùng công thức CKD-EPI 2009 dưới đây:
eGFR = 141 x min(sCr/κ, 1)a x max(sCr/κ, 1)-1,209 x 0,993tuổi x 1,018 (nếu là nữ) x 1,159 (nếu da đen)
sCr: creatinine máu (mg/dL)
κ = 0,7 (nếu là nữ) và κ = 0,9 (nếu là nam)
α = −0,329 (nếu là nữ) và a = −0,411 (nếu là nam)
Nếu định lượng được đồng thời creatinin và cystatin C máu có thể dùng công thức CKD- EPI creatinin-cystatinC dưới đây:
eGFRcr-cys = 135 x min(sCr/κ, 1)α x max(sCr/κ, 1)-0,544 x min(sCys/0,8, 1)-0,323 x max(sCys/0,8, 1)-0,778 x 0,9961Tuổi x 0,963 [nếu là nữ]
sCr: creatinine máu, mg/dL
κ = 0,7 (nếu là nữ) và κ = 0,9 (nếu là nam)
α = -0,219 (nếu là nữ) và a = -0,144 (nếu là nam)
min(sCr/κ, 1) là số tối thiểu của sCr/κ hay bằng 1,0
max(sCr/κ, 1) là số tối đa của sCr/κ hay bằng 1,0
sCys: cystatin C máu (mg/L)
Tuổi: năm
- Xác định chính xác MLCT
+ Một số tình huống cần đo chính xác MLCT (ví dụ để theo dõi hóa trị, đánh giá chức năng thận ở người hiến thận sống…), nên xem xét sử dụng các phép đo được chuẩn hóa (inulin, 51Cr-EDTA, 125I-iothalamate, iohexol).
Sàng lọc BTM ở những quần thể có yếu tố nguy cơ cần luôn luôn phải được thực hiện dựa vào xác định MLCT và albumin/protein nước tiểu. Không được chẩn đoán chỉ dựa vào một chỉ tiêu duy nhất.
Những người không thuộc nhóm có yếu tố nguy cơ có thể được sàng lọc/tầm soát theo lịch khám sức khỏe định kỳ.
Cần kiểm tra lại các bằng chứng của tính mạn tính (chỉ số MLCT giai đoạn trước, tổn thương thận hay giảm MLCT trên 3 tháng, hình ảnh thận giảm kích thước hoặc giảm độ dày của vỏ thận, hình ảnh tổn thương trên mô bệnh học, các tình trạng được biết là nguy cơ hoặc nguyên nhân gây BTM, kết quả xét nghiệm trước đó, và lặp lại xét nghiệm trong vòng 3 tháng và ngoài 3 tháng); không dựa vào kết quả bất thường chỉ 1 lần.
Bảng 6. Tiêu chuẩn chẩn đoán bệnh thận mạn
(bất kỳ chỉ dấu nào được liệt kê dưới đây tồn tại từ 3 tháng trở lên)
| Giảm MLCT | MLCT < 60 ml/phút /1,73 m2 |
| Chỉ dấu thương tổn hay hư hỏng ở thận | - Albumin nước tiểu (UACR ≥ 30 mg/g (3mg/mmol); UAE ≥ 30mg/24h) hoặc Protein nước tiểu (UPCR ≥ 150mg/g (15mg/mmol); UPE ≥ 150mg/24h) nếu không xét nghiệm được albumin nước tiểu. - Thay đổi mô học trên tiêu bản sinh thiết thận - Thay đổi trong tế bào, cặn lắng nước tiểu - Thay đổi cấu trúc trên hình ảnh - Rối loạn nước-điện giải hoặc các rối loạn khác do nguyên nhân ống thận - Tiền sử ghép thận |
| MLCT: mức lọc cầu thận; UACR: tỷ lệ albumin/creatinine nước tiểu; UAE: albumin nước tiểu trong 24h; UPCR: tỷ lệ protein/creatinine nước tiểu; UPE: protein nước tiểu trong 24h | |
3.4. PHÂN GIAI ĐOẠN VÀ PHÂN TẦNG NGUY CƠ
3.4.1. Phân giai đoạn bệnh thận mạn
Bảng 7. Các giai đoạn của BTM theo KDIGO 2012 và đồng thuận 2014
| Giai đoạn | Mô tả | MLCT | Điều trị |
| 1 | Tổn thương thận kèm MLCT bình thường hoặc tăng | ≥ 90 | T nếu là thận ghép |
| 2 | Tổn thương thận kèm giảm nhẹ MLCT | 60-89 | |
| 3a | Giảm nhẹ đến vừa MLCT | 45-59 | |
| 3b | Giảm vừa đến nặng MLCT | 30-44 | |
| 4 | Giảm nặng MLCT | 15-29 | D nếu lọc máu |
| 5 | Suy thận | < 15 (hay lọc máu) |
3.4.2. Phân tầng nguy cơ tiến triển bệnh thận mạn và tần suất khám theo dõi
a. Phân tầng nguy cơ dựa vào albumin/protein nước tiểu
Bảng 8. Các nhóm albumin/protein nước tiểu
|
| A1 Bình thường đến tăng nhẹ | A2 Tăng vừa | A3 Tăng nhiều |
| UACR |
|
|
|
| mg/g mg/mmol | < 30 < 3 | 30 - 300 3 - 30 | > 300 > 30 |
| UPCR |
|
|
|
| mg/g mg/mmol | < 150 < 15 | 150 - 500 15 - 50 | > 500 > 50 |
| UAE (mg/24h) UPE (mg/24h) Test nhúng | < 30 < 150 Âm tính -> vết | 30 - 300 150 - 500 Vết -> 1+ | > 300 > 500 ≥ 1+ |
UACR: tỷ lệ albumin/creatinine nước tiểu (1 mẫu); UPCR: tỷ lệ protein/creatinine nước tiểu (1 mẫu); UAE: albumin nước tiểu trong 24h; UPE: protein nước tiểu trong 24h
b. Đánh giá nguy cơ dựa vào nguyên nhân gây BTM
Nguyên nhân gây BTM có thể có diễn biến khác nhau và ảnh hưởng trực tiếp đến sự tiến triển của BTM. Cần tìm nguyên nhân dựa vào bệnh cảnh lâm sàng, khai thác kỹ tiền sử cá nhân và gia đình, các yếu tố môi trường-xã hội, thuốc, thăm khám lâm sàng, các kết quả xét nghiệm, thăm dò hình ảnh, chẩn đoán di truyền và chẩn đoán mô bệnh học (nếu có)
Phân tầng nguy cơ chính xác nhất là dựa vào 3 yếu tố: albumin/protein nước tiểu, MLCT và nguyên nhân gây BTM (AGC).
Trường hợp không thể phân tầng nguy cơ cần có ý kiến bác sĩ chuyên khoa.
c. Phân tầng nguy cơ tiến triển BTM dựa vào MLCT kết hợp albumin nước tiểu và tần suất khám theo dõi định kỳ cho BN đã xác lập chẩn đoán BTM ổn định: xin tham khảo bảng 9 phần giải thích.
Bảng 9. Phân giai đoạn, phân tầng nguy cơ và tần suất tái khám hàng năm theo KDIGO 2024
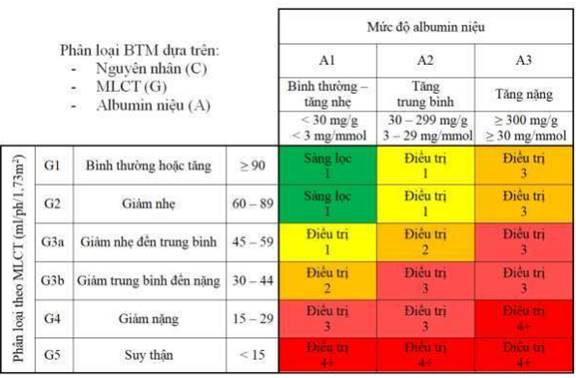
Màu xanh lá (G1-2A1) tương ứng nguy cơ mức độ thấp (nếu không có các chỉ dấu khác về bệnh thận, cũng như không có BTM). Những BN thuộc nhóm này có thể được khám và xét nghiệm với tần suất của người khỏe mạnh, thông thường là hàng năm và có thể do bác sĩ không phải chuyên khoa Thận quản lý.
Màu vàng (G1-2A2, G3aA1) tương ứng nguy cơ mức độ vừa. Những BN thuộc nhóm này cần được khám và xét nghiệm theo dõi ít nhất 1 lần mỗi năm và có thể do bác sĩ không phải chuyên khoa Thận quản lý.
Màu cam (G1-2A3, G3aA2 và G3bA1) tương ứng nguy cơ mức độ cao. Những BN thuộc nhóm này cần được khám và xét nghiệm theo dõi ít nhất 2 lần mỗi năm. Bác sĩ không phải chuyên khoa Thận có thể theo dõi nhưng cần chuyển khám bác sĩ chuyên khoa Thận nếu albumin nước tiểu tăng lên hoặc MLCT giảm xuống, nhất là ở người <70 tuổi.
Màu đỏ (G3a-bA3, G3b-4A2 và G4A1) tương ứng nguy cơ mức độ rất cao. Những BN thuộc nhóm này cần được khám và xét nghiệm theo dõi ít nhất 3 lần mỗi năm và do bác sĩ chuyên khoa Thận theo dõi quản lý.
Màu đỏ sẫm (G4-5A3 và G5A1-2) tương ứng nguy cơ ở mức cao nhất. Tất cả BN thuộc nhóm này cần được bác sĩ chuyên khoa Thận theo dõi với tần suất khám và xét nghiệm tối thiểu 4 lần mỗi năm.
Tất cả BN bị BTM giai đoạn 4 trở lên và/hoặc có Albumin niệu cao (mức A3) đều cần được bác sĩ chuyên khoa Thận theo dõi.
Những người bệnh tổn thương thận cấp cần nhập viện cần theo dõi chức năng thận và tầm soát bệnh thận mạn trong ít nhất ba năm sau khi ra viện, kể cả khi chức năng thận đã quay về mức nền.
Những trường hợp có tình trạng chưa ổn định cần cá thể hoá tần suất khám và xét nghiệm tại mỗi lần khám bệnh, ví dụ khi đang điều chỉnh liều thuốc hạ áp, điều trị thiếu máu, can thiệp dinh dưỡng, rà soát lại liều và danh mục thuốc, can thiệp ngoại khoa, nhiễm trùng v.v… Cần thăm dò thêm để tìm nguyên nhân trong các trường hợp: thay đổi MLCT >20% hoặc tăng gấp đôi UACR so với chỉ số của lần xét nghiệm trước, MLCT giảm quá 30% sau khi khởi trị bằng các thuốc có ảnh hưởng huyết động.
Đối với mọi BN bị BTM giai đoạn 3-5, khuyến cáo sử dụng công thức tính nguy cơ đã được kiểm định ngoài để ước tính nguy cơ suy thận tuyệt đối và nguy cơ tử vong do tim mạch khi xác định cần chuyển chuyên khoa Thận, cần chăm sóc đa chuyên khoa hay cần chuẩn bị điều trị thay thế thận, đồng thời xác định mục tiêu chăm sóc và các chiến lược điều trị dự phòng cho BN. Ngoài MLCT và UACR, có thể sử dụng chỉ số nguy cơ suy thận sau 5 năm từ 3-5% làm cơ sở để chuyển BN sang chuyên khoa Thận; nguy cơ suy thận sau 2 năm >10% làm cơ sở để yêu cầu chăm sóc đa chuyên khoa. Không áp dụng các công thức tính nguy cơ này cho BN bị BTM giai đoạn 1-2.
- Tổn thương thận cấp
- Hẹp động mạch thận
- Viêm mạch
- Viêm cầu thận tiến triển nhanh
4. ĐIỀU TRỊ BẢO TỒN CHỨC NĂNG THẬN
4.1.1. Các biện pháp điều trị BTM giai đoạn chưa thay thế
a. Các biện pháp không dùng thuốc: cần khuyến cáo cho người mắc BTM
- Tập thể dục: 30 - 60 phút/ngày, 4 - 7 ngày 1 tuần (ít nhất 150 phút/tuần) ở mức cường độ vừa; một số người có thể tập aerobic cường độ trung bình đến nặng và/hoặc bài tập sức mạnh để tránh lối sống thụ động. Chương trình tập luyện cần phù hợp với đặc điểm tim mạch và thể lực từng người, với thời gian và cường độ tăng dần dần.
- Bỏ hút thuốc lá, hạn chế hoặc bỏ rượu bia (Khuyến cáo không uống rượu bia quá 12 - 14 gam/ngày tương đương khoảng 300 mL bia hoặc 150 mL rượu)
- Duy trì cân nặng lý tưởng
- Lượng protein đưa vào có thể giảm dần theo mức độ giảm dần chức năng thận. Việc hạn chế protein đưa vào cần được giám sát, có thể phối hợp với các keto analog (đồng phân keto acid). Người BTM giai đoạn 3-5 chưa lọc máu có tình trạng chuyển hóa ổn định có thể được chỉ định:
+ Chế độ ăn giảm protein (low-protein diet, LPD): cung cấp 0,55 - 0,60 g protein/kg cân nặng/ ngày
+ Chế độ ăn rất giảm protein (very low-protein diet, VLPD): cung cấp 0,28 - 0,43 g protein/ kg cân nặng/ ngày kèm bổ sung thêm đồng phân keto acid/acid amin để đạt lượng protein là 0,55 - 0,60 g / kg cân nặng/ ngày.
- Năng lượng đưa vào cho bệnh nhân BTM giai đoạn 3 - 5, có tình trạng chuyển hóa ổn định, là 25 - 35 kcal/kg cân nặng/ngày tùy theo tuổi, giới, mức độ hoạt động thể lực, thành phần cơ thể, trọng lượng mục tiêu, giai đoạn BTM và các bệnh đồng mắc, tình trạng viêm mạn tính.
- Chế độ ăn ít chất béo bão hòa, ví dụ chế độ ăn Địa Trung Hải hoặc chế độ ăn DASH (Dietary Approaches to Stop Hypertension), có nhiều chất xơ, ít mỡ bão hoà và mỡ trans, được cá thể hoá theo yếu tố nguy cơ; chế độ ăn giảm muối còn 6g (tương đương với 2,4g Na)/ngày cho người THA và/ hoặc suy tim, rối loạn lipid máu. Cần có chiến lược phòng ngừa tăng Kali máu nặng nhưng cân nhắc việc hạn chế rau quả và trái cây cho người mắc BTM, do chế độ ăn giàu Kali có thể làm giảm tổn thương thận. Các chế độ ăn làm giảm chất béo trung tính trong huyết thanh bao gồm chế độ ăn ít chất béo (15% tổng lượng calo), giảm lượng monosacarit, disacarit và tổng lượng carbohydrate trong chế độ ăn, sử dụng dầu cá để thay thế chất béo trung tính chuỗi dài. Khuyến cáo tăng lượng thực phẩm nguồn thực vật hơn là từ nguồn động vật và hạn chế thực phẩm đã chế biến. Điều chỉnh chế độ ăn nên được sử dụng một cách thận trọng ở những người bị suy dinh dưỡng
- Những người có nguy cơ hoặc đang tiêu hao protein - năng lượng cần được bổ sung dinh dưỡng bằng ăn qua đường miệng và đánh giá lại sau ít nhất 3 tháng. Nếu tình trạng dinh dưỡng không cải thiện hoặc không cân bằng được nhu cầu về protein - năng lượng cần đặt ống xông để nuôi dưỡng qua đường tiêu hóa. Đối với những BN không cải thiện có thể cần bổ sung dinh dưỡng tĩnh mạch một phần hoặc hoàn toàn.
- Đối với người có THA, mục tiêu lượng muối ăn vào hàng ngày là < 2g natri (<90 mmol Na hoặc < 5g NaCl)
b. Các biện pháp có dùng thuốc: các nhóm thuốc điều trị triệu chứng đặc hiệu được trình bày trong các mục cụ thể tương ứng ở phần dưới. Các nhóm thuốc được khuyến cáo lựa chọn đầu tay để điều trị BTM bao gồm:
- Ức chế hệ renin-angiotensin (RASi)
- Ức chế kênh đồng vận chuyển natri-glucose 2 (SGLT2i)
- Đối vận thụ thể mineralocorticoid (MRA)
- Đồng vận thụ thể peptid giống glucagon (GLP-1 RA)
4.1.2. Cấu trúc và quy trình quản lý bảo tồn thận toàn diện
Không phải mọi BN bị BTM đều diễn tiến đến giai đoạn cuối. Do BTM là yếu tố nguy cơ cao nhất của bệnh lý tim mạch (không kể BN có hoặc không các yếu tố nguy cơ tim mạch kinh điển) và các biến chứng khác (thiếu máu, suy dinh dưỡng, bệnh xương và chất khoáng), BN bị BTM có thể tử vong do biến cố tim mạch trước khi đến giai đoạn cuối.
Mục tiêu của điều trị bảo tồn toàn diện BTM:
- Làm chậm tiến triển của BTM đến giai đoạn cuối.
- Điều trị các biến chứng của BTM, kiểm soát các yếu tố nguy cơ tim mạch gây tăng nguy cơ tử vong của BN ở mọi giai đoạn của BTM
4.1.2.1. Điều trị làm chậm tiến triển của BTM đến giai đoạn cuối
- Kiểm soát HA: HA mục tiêu thay đổi tùy theo các hướng dẫn (Tham khảo mục “Kiểm soát huyết áp”). Cộng đồng Thận học quốc tế thường áp dụng mục tiêu theo hướng dẫn của KDIGO. Thuốc được lựa chọn đầu tay là ức chế hệ RAA, đặc biệt khi THA kèm uACR >30mg/g
- Kiểm soát đường máu cho BN ĐTĐ type 2 : mục tiêu HbA1C < 7%, bằng thay đổi lối sống, khởi trị với metformin và thuốc SGLT2i, phối hợp thêm thuốc kiểm soát đường máu khác nếu đường máu chưa đạt mục tiêu, thường thêm đồng vận thụ thể GLP-1 (GLP-1 RA) vì có hiệu quả hiệp đồng trong kiểm soát biến cố tim mạch, đặc biệt ở những BN có bệnh mạch máu do xơ vữa động mạch, phòng ngừa diễn tiến đến albumin niệu đại lượng, giảm tiến triển của BTM và giảm cân. Nên chọn GLP-1 RA tác dụng kéo dài do có khả năng bảo vệ tim mạch đã được chứng minh.
- Dùng nhóm thuốc ức chế hệ renin angiotensin (thuốc ƯCMC, ƯCTT angiotensin 2) liều tối đa được phép cho BN không bị ĐTĐ hoặc bị ĐTĐ có albumin niệu A2- A3 và BTM giai đoạn 1-4. Bệnh nhân không có THA cần chọn liều ức chế hệ RAA tối đa dung nạp được. Xét nghiệm kali, creatinine máu sau 2-4 tuần. Khi có tăng kali máu cần áp dụng các biện pháp giảm kali máu trước khi giảm liều hay ngừng ức chế RAAS (xem phần Tăng Kali máu). Chỉ giảm liều hoặc ngừng ức chế RAAS khi BN bị tụt HA, tăng kali máu không thể kiểm soát được bằng các biện pháp nội khoa.
- Dùng thuốc ức chế kênh đồng vận chuyển Na-Glucose 2 (SGLT2i): Khởi trị SGLT2i (Empagliflozin 10mg/ngày, Dapagliflozin 10mg/ngày) cho BN BTM kèm hoặc không kèm ĐTĐ với MLCT≥20ml/phút/1,73 m2 và tiếp tục dùng cho đến khi BN lọc máu hoặc ghép thận. Sử dụng SGLT2i có mức khuyến cáo 1A cho: BN bị ĐTĐ týp 2, BN bị BTM có MLCT ≥ 20ml/phút/1,73 m2 và UACR ≥ 200mg/g (≥ 20mg/mmol), hoặc BN suy tim có MLCT ≥20ml/phút/1,73 m2 với mọi mức albumin niệu. Nên dùng thuốc ức chế SGLT2 cho các BN có MLCT từ 20-45ml/phút/1,73 m2 và có UACR < 200mg/g (< 20mg/mmol) (2B). Tạm ngừng thuốc khi BN phải nhịn ăn kéo dài, phẫu thuật, hoặc trong tình trạng nguy kịch.
- Dùng thuốc ức chế thụ thể mineralocorticoid (MRA): nên cân nhắc bổ sung loại thuốc MRA không steroid đã được chứng minh là có lợi ích trên thận và tim mạch cho BN bị ĐTĐ týp 2 có MLCT > 25ml/phút/1,73 m2, Kali máu bình thường, albumin niệu >30mg/g (>3mg/mmol) khi đã dùng thuốc ức chế RAAS liều tối đa dung nạp được và ức chế SGLT2. Theo dõi kali máu sau khởi trị MRA.
- Điều trị rối loạn lipid máu: mục tiêu là LDL-cholesterol giảm ≥50% so với nền và đạt <70mg/dL ở BTM giai đoạn 3, và <55mg/dL ở BTM giai đoạn 4. Điều trị dựa vào chế độ ăn kiêng, dùng statin đơn độc hoặc phối hợp với ezetimibe. Ezetimibe không cần chỉnh liều khi suy thận. Nếu BN tăng triglyceride >500mg/dL, cần thay đổi lối sống. Nếu triglyceride >1000mg/dL dùng fibrates.
- Điều trị tăng uric acid máu: Chỉ nên điều trị BN BTM kèm tăng uric acid có triệu chứng, ngay sau đợt đau đầu tiên, ưu tiên nhóm ức chế XO hơn nhóm thải uric, không ngừng thuốc khi BN có biểu hiện cơn gout cấp, nếu muốn thay đổi thuốc dự phòng sẽ thay sau khi kiểm soát được cơn gout cấp. (Xem “Kiểm soát tăng acid uric máu”).
- Hạn chế protein đưa vào ở mức 0,8g/Kg/ngày trở xuống khi MLCT <60ml/phút/1,73 m2. Tránh đưa vào >1,3g protein/Kg/ngày nếu có BTM tiến triển
- Giảm muối Na<2g, NaCl< 5g/ngày.
- Thay đổi lối sống: vận động ít nhất 150phút/tuần với mức độ vận động phù hợp với tình trạng tim mạch, bỏ hút thuốc
4.1.2.2. Điều trị các biến chứng của hội chứng urê máu và kiểm soát các yếu tố nguy cơ tim mạch
- Điều trị thiếu máu: Hb mục tiêu 10-12g/dL, tối ưu 11-12g/dL.
- Điều trị rối loạn chuyển hóa xương và chất khoáng xương do thận: Khi BTM giai đoạn 5, duy trì nồng độ PTH khoảng 150-300pg/mL ( 2-5 lần giới hạn trên của bình thường). Kiểm soát phosphor bằng chế độ ăn, thuốc gắn phosphate ở đường tiêu hóa, bổ sung vitamin D dạng hoạt tính (calcitriol hoặc đồng vận Vitamin D). Không dùng biphosphonate khi MLCT <60ml/phút/1,73 m2. Kiểm soát cường cận giáp bằng vitamin D và/hoặc thuốc bắt chước Ca (calcimimetics) như cinacalcet
- Điều trị toan chuyển hóa bằng natri bicarbonate uống khi bicarbonate máu<18mmol/L (đối với người trưởng thành). Có thể kèm can thiệp dinh dưỡng. HCO3 mục tiêu >22mmol/L
- Điều trị bệnh lý tim mạch đi kèm (thận trọng khi phiên giải NT-ProBNP, Troponin I nếu MLCT <60ml/phút/1,73 m2)
+ Điều trị bệnh mạch máu ngoại biên ở BN ĐTĐ
+ An toàn sử dụng thuốc
+ Chẩn đoán hình ảnh: đối với thuốc cản quang
• Không dùng Gadolinium khi MLCT <15ml/phút/1,73 m2 (khi chụp MRI)
• Không dùng thuốc rửa ruột chứa phosphate khi MLCT <60ml/phút/1,73 m2
4.1.2.3. Phòng ngừa
- Tiêm vaccin (tiêm phòng viêm gan virus B khi MLCT <30ml/phút/1,73 m2)
- Phòng ngừa TTTC
- Phòng ngừa nhập viện
Tùy theo tiến triển của BTM, các biến chứng khi thận suy để điều chỉnh việc điều trị cho phù hợp với từng giai đoạn.
Phối hợp với BS đa khoa, BS gia đình, BS các chuyên khoa khác cùng quản lý BN BTM
4.2. MỤC TIÊU ĐIỀU TRỊ BTM GIAI ĐOẠN CHƯA ĐIỀU TRỊ THAY THẾ THẬN SUY
Có thể phối hợp quản lý BN bị BTM ở cơ sở đa khoa hoặc chuyên khoa Thận. Các chỉ định chuyển khám chuyên khoa Thận và/hoặc quản lý tại phòng khám chuyên khoa Thận gồm: nguyên nhân BTM chưa rõ, bệnh thận di truyền, sỏi thận tái phát, MLCT <30ml/phút/1,73m2, MLCT giảm >20% so với mức nền kéo dài hoặc giảm >30% sau khởi trị thuốc gây ảnh hưởng huyết động, albumin niệu ≥300mg/g (≥300mg/24 giờ) hoặc protein niệu ≥500mg/g (≥500mg/24 giờ) kèm hồng cầu niệu, albumin niệu tăng gấp 2 lần trở lên, UACR >700mg/g, có trụ hồng cầu không rõ nguyên nhân, tăng huyết áp (THA) kháng trị (không đáp ứng với 4 loại thuốc hạ áp trở lên) ở BN bị BTM, K máu bất thường, nhiễm toan, thiếu máu, bệnh xương, suy dinh dưỡng, BTM đang tiến triển với tốc độ mất MLCT >5ml/phút/năm.
Bảng 10. Mục tiêu quản lý BN BTM bởi bác sĩ không chuyên khoa Thận và chuyên khoa Thận
| Giai đoạn BTM | BS không chuyên khoa Thận | BS chuyên khoa Thận |
| 1-2-3a (MLCT ≥ 45) | Phát hiện và điều trị các yếu tố nguy cơ BTM Loại trừ các nguyên nhân gây suy thận chức năng (quá nhiều thuốc hạ áp, NSAID, giảm thể tích tuần hoàn) Phát hiện BTM tiến triển Phát hiện giảm MLCT Phát hiện tăng protein niệu Kiểm soát các yếu tố gây tổn thương thận làm tiến triển BTM | Đánh giá và tìm bệnh thận cụ thể để điều trị đặc hiệu: + Viêm cầu thận nguyên phát hoặc thứ phát. + Bệnh thận do thiếu máu cục bộ Phát hiện và làm chậm tiến triển BTM. |
| 3b (MLCT 30 - 44) | Phát hiện BTM tiến triển Loại trừ các nguyên nhân gây suy thận chức năng (quá nhiều thuốc hạ áp, NSAID, giảm thể tích tuần hoàn) Điều trị và kiểm soát các yếu tố gây tổn thương thận làm tiến triển BTM Điều chỉnh liều thuốc theo MLCT Tư vấn chế độ ăn uống và vệ sinh Tiêm vaccine phòng cúm, viêm phổi do phế cầu, virus viêm gan B Phát hiện biến chứng của BTM: - Thiếu máu Rối loạn điện giải | Đánh giá và tìm các bệnh thận cụ thể để điều trị đặc hiệu Theo dõi và điều trị các yếu tố làm tiến triển BTM. Phát hiện và điều trị biến chứng của BTM: - Bệnh xương và chất khoáng - Thiếu máu Rối loạn điện giải |
| 4 (MLCT < 30) | Ưu tiên chuyển BS chuyên khoa Thận (nếu có thể) Loại trừ các nguyên nhân gây suy thận chức năng (quá nhiều thuốc hạ áp, NSAID, giảm thể tích tuần hoàn) Tư vấn chế độ ăn uống và vệ sinh Điều chỉnh liều thuốc theo MLCT Phát hiện biến chứng của BTM: - Thiếu máu Rối loạn điện giải | Chuẩn bị điều trị thay thế Sắp xếp điều trị bảo tồn và chăm sóc giảm nhẹ nếu điều trị thay thế không khả thi hoặc không được chấp nhận Đánh giá và điều trị biến chứng của BTM: - Bệnh xương và chất khoáng - Thiếu máu - Rối loạn điện giải Toan chuyển hoá |
| NSAID: thuốc chống viêm giảm đau không steroid | ||
4.3.1. Chẩn đoán và phân độ tăng huyết áp
Theo Hội Tim Mạch quốc gia Việt nam 2022
- Chẩn đoán THA khi huyết áp tâm thu (HATT) ≥ 140mmHg và/hoặc huyết áp tâm trương (HATTr) ≥ 90 mmHg. Huyết áp bình thường khi cả HATT < 130 mmHg và HATTr < 85mmHg.
- HA bình thường - cao hoặc tiền THA: 130 mmHg ≤ HATT < 140 mmHg và/hoặc 85 mmHg ≤ HATTr < 90 mmHg.
- Chẩn đoán cơn THA khi HATT ≥ 180 mmHg và/hoặc HATTr ≥ 120 mmHg; trong tình huống đó cần đánh giá tổn thương cơ quan đích để chẩn đoán THA khẩn cấp (không có tổn thương cơ quan đích trừ võng mạc) hoặc cấp cứu (có dấu hiệu tổn thương cơ quan đích) để có hướng xử trí thích hợp.
- Hướng dẫn đo HA theo KDIGO 2021 ở người bị BTM như sau:
- Phòng yên tĩnh; không hút thuốc, uống cà phê hoặc tập thể dục từ 30 phút trở lên trước khi đo; đi tiểu hết, nghỉ ngơi từ 5 phút trở lên
- Không nói chuyện trong thời gian nghỉ ngơi và khi đo HA, lưng tựa vào ghế
- Chọn băng đo HA thích hợp tay mỗi cá thể, thiết bị đo HA phải được hiệu chỉnh định kỳ
- Điểm giữa cánh tay ngang điểm giữa của xương ức, chân đặt trên sàn nhà
- Đo tối thiểu 2 lần cách nhau 1-2 phút và lấy chỉ số trung bình cộng
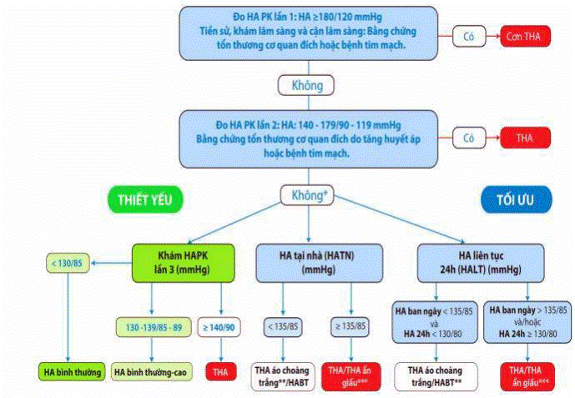
Hình 1. Sơ đồ chẩn đoán THA với các phương pháp đo HA tại phòng khám
4.3.2.1. Huyết áp mục tiêu trên bệnh nhân bệnh thận mạn tăng huyết áp
Bảng 11. Các khuyến cáo về mức huyết áp mục tiêu cho người mắc BTM
| Hiệp hội | Huyết áp mục tiêu | Tổn thương thận |
| ACC (American College of Cardiology 2017) | < 130/80 mmHg | Có protein niệu |
| NICE (National Institute for Health and Care Excellence) | < 140/90 mmHg < 130/80 mmHg | Protein niệu <1g/ ngày Protein niệu >1g/ ngày |
| ESC/ESH 2018 (European Society of Cardiology/European Society of Hypertension) | HA tâm thu <130mmHg | Có protein niệu |
| KDIGO 2024 | HA tâm thu <120mmHg (nếu có thể dung nạp được) | MLCT <60ml/phút/1,73m2 hoặc Albumin niệu >30mg/g |
| VSH/VNHA (Phân hội tăng huyết áp - Hội tim mạch quốc gia Việt Nam) | - HAPK mục tiêu: 120-129/70-79 mmHg | THA kèm BTM |
| - Chưa rõ, cá thể hóa điều trị | BTM đang lọc máu |
4.3.2.2. Điều trị thuốc
- Khuyến cáo khởi trị với thuốc ức chế hệ thống renin-angiotensin-aldosteron (RAASi) ƯCMC/ƯCTT nhất là khi có microalbumin hoặc albumin/protein niệu (G1-4, A3 ở BN không ĐTĐ, G1-4, A2-3 ở BN ĐTĐ - mức 1B; G1-G4, A2 ở BN không ĐTĐ - mức 2C) khi không có chống chỉ định.
- Kết hợp thuốc ức chế RAS với chẹn Canxi hoặc thuốc lợi tiểu
- Không kết hợp đồng thời các nhóm thuốc ƯCMC, ƯCTT hoặc ức chế renin trực tiếp (DRI) ở bệnh nhân BTM có hoặc không có đái tháo đường (1B).
- Khuyến cáo sử dụng thuốc MRA ở BN ĐTĐ type 2, MLCT ≥25ml/phút/1,73m2, nồng độ kali máu bình thường, và có albumin niệu (≥30 mg/g ) khi đã dùng thuốc ức chế RAS ở liều tối đa dung nạp được. Thuốc MRA nói chung là thuốc lựa chọn thứ 2 trong kiểm soát HA trên bệnh cầu thận.
- Theo dõi HA, nồng độ creatinin và kali máu mỗi 2 - 4 tuần sau khi bắt đầu hoặc tăng liều thuốc RAASi, phụ thuộc vào MLCT và nồng độ kali máu hiện tại. Nếu creatinin huyết thanh tăng hơn 30% trong vòng 4 tuần sau khi bắt đầu điều trị hoặc tăng liều thuốc RAASi thì xem xét giảm liều hoặc ngừng thuốc RAASi.
Bảng 12. Chỉnh liều một số thuốc ƯCMC và ƯCTT trong BTM
| Thuốc RAASi | Liều khởi đầu | Liều tối đa | Chỉnh liều theo chức năng thận |
| Benazepril | 10 mg/ngày | 80 mg | CrCl ≥30 ml/phút: không chỉnh liều. CrCl <30 ml/ phút: Giảm liều khởi đầu còn 5mg/ ngày. Thuốc không qua màng lọc |
| Captopril | 12,5 - 25 mg, 2-3 lần/ngày | 50 mg, 3 lần/ngày (có thể 450mg/ngày) | Thời gian bán hủy gia tăng khi chức năng thận giảm: CrCl 10-50 ml/phút: 75% liều hàng ngày 12-18 giờ; CrCl <10 ml/phút: 50% liều mỗi 24 giờ. Lọc máu: uống sau lọc máu, khoảng 40% qua màng lọc |
| Enalapril | 5 mg, 1 lần/ngày | 40 mg | CrCl ≤30 ml/phút: người lớn liều khởi đầu 2,5 mg 1 lần/ngày; 2,5 mg ngày sau lọc máu; Bênh nhân chưa lọc máu liều dựa vào đáp ứng lâm sàng |
| Lisinopril | 10 mg, 1 lần/ngày | 40 mg | CrCl 10-30 ml/phút: người lớn liều khởi đầu giảm 50%, tối đa 40 mg/ngày CrCl <10 ml/phút: liều khởi đầu giảm còn 2,5 mg/ngày. Tối đa 40 mg/ngày |
| Perindopril | 2 mg, 1 lần/ngày | 8 mg | Không sử dụng khi CrCl <30 ml/phút Perindopril và chuyển hóa của nó thải qua màng lọc |
| Quinapril | 10 mg, 1 lần/ngày | 80 mg | CrCl 61-89 ml/phút: 10 mg ngày; CrCl 30-60 ml/phút: bắt đầu 5 mg 1 lần ngày; CrCl 10-29 ml/phút : ít dữ liệu sử dụng |
| Ramipril | 2,5 mg, 1 lần/ngày | 20 mg | Dùng 25% liều bình thường khi CrCl <40 ml/ phút Đào thải tối thiểu qua màng lọc |
| Trandolapril | 1 mg, 1 lần/ngày | 4 mg | CrCl <30 ml/ phút: giảm liều khởi đầu còn 0,5 mg/ngày |
| Thuốc RAASi | Liều khởi đầu | Liều tối đa | Chỉnh liều theo chức năng thận |
| Candesartan | 16 mg, 1 lần/ngày | 32 mg | Ở những bệnh nhân có CrCl <30 ml/phút, AUC và Cmax tăng gấp đôi khi dùng liều lặp lại. Không đào thải qua màng lọc thận nhân tạo |
| Irbesartan | 150 mg, 1 lần/ngày | 300 mg | Không cần điều chỉnh liều lượng. Không thải qua lọc thận nhân tạo |
| Losartan | 50 mg, 1 lần/ngày | 100 mg | Không cần điều chỉnh liều lượng. Không thải qua màng lọc thận nhân tạo |
| Olmesartan | 20 mg, 1 lần/ngày | 40 mg | AUC tăng gấp 3 lần ở những bệnh nhân có CrCl <20 ml/phút. Không khuyến cáo điều chỉnh liều ban đầu cho bệnh nhân suy thận từ trung bình đến nặng (CrCl < 40 ml/phút). Chưa được nghiên cứu ở bệnh nhân lọc máu |
| Telmisartan | 40 mg, 1 lần/ngày | 80 mg | Không cần điều chỉnh liều lượng. Không thải qua màng lọc thận nhân tạo |
| Valsartan | 80 mg, 1 lần/ngày | 320 mg | Không có điều chỉnh liều lượng cho CrCl < 30ml/phút- thận trọng khi dùng. Không thải qua màng lọc thận nhân tạo |
- Thuốc đối vận thụ thể mineralcorticoid (MRA) có 2 nhóm: Steroid và không-steroid
+ Nhóm đối vận thụ thể mineralcorticoid steroid:
Spironolactone sử dụng trong điều trị THA, THA kháng trị, suy tim, phù. Lưu ý thuốc làm tăng Kali máu, cần theo dõi Kali, có thể phải giảm liều hoặc ngừng thuốc. BN tăng Kali hoặc MLCT <30ml/phút/1,73m2 không nên sử dụng nhóm này. Liều Spironolactone từ 25mg-200mg, liều thông thường 100mg chia 2 lần ngày
+ Nhóm đối vận thụ thể mineralcorticoid không-steroid:
Nhóm thuốc này có lợi ích trên thận hoặc tim mạch đã được chứng minh, đặc biệt trên BN ĐTĐ type 2. Liều thuốc cần phải điều chỉnh theo chức năng thận và Kali huyết thanh, cần theo dõi nồng độ Kali tháng đầu và định kỳ mỗi 4 tháng.
4.3.2.3. Phối hợp với các biện pháp không thuốc, chế độ ăn, thay đổi lối sống, luyện tập cho người mắc BTM
- Chẩn đoán thiếu máu ở người lớn và trẻ em >15 tuổi khi nồng độ Hb <13,0 g/dL (<130 g/L) ở nam và <12,0 g/dL (<120 g/L) ở nữ.
- Chẩn đoán thiếu sắt tuyệt đối : Độ bão hòa Transferrin (TSAT) <20% và ferritin <100 mg/L ở những bệnh nhân không lọc máu hoặc <200 mg/L ở bệnh nhân lọc máu
- Chẩn đoán thiếu sắt chức năng: TSAT <20% và ferritin >100 mg/L ở bệnh nhân BTM không điều trị lọc máu hoặc >200 mg/L ở bệnh nhân BTM có lọc máu
- Chẩn đoán tình trạng thiếu sắt có thể dựa vào tỷ lệ hồng cầu lưới nhược sắc và/hoặc lượng Hb trong hồng cầu lưới
Bảng 13. Tần suất và xét nghiệm theo dõi tình trạng thiếu máu ở BTM
| Đối tượng bệnh nhân | Tần suất theo dõi Hb | Các xét nghiệm | |
| Chưa thiếu máu | BTM giai đoạn 3 | ≥ 1 lần/năm | Công thức máu, số lượng hồng cầu lưới Độ bão hòa transferrin (TSAT), ferritin Định lượng nồng độ B12 và folate trong huyết thanh Xác định tan máu: haptoglobin, LDH, bilirubin, Coombs Điện di protein huyết tương và/hoặc nước tiểu; điện di Hb; định lượng chuỗi nhẹ; xét nghiệm tủy xương |
| BTM giai đoạn 4-5 chưa lọc máu (ND) | ≥ 2 lần/năm | ||
| BN lọc máu chu kỳ (HD), lọc màng bụng (PD) | ≥ 1 lần/3 tháng | ||
| Thiếu máu, chưa dùng EPO | BTM giai đoạn 3-5 | ≥ 1 lần/3 tháng | |
| BN lọc máu chu kỳ (HD) | ≥ 1 lần/tháng | ||
Mục tiêu:
- Ferritin huyết thanh 200-500 µg/L ở bệnh nhân BTM lọc máu, 100-500 µg /L ở bệnh nhân BTM không lọc máu và TSAT>20%
- Và/hoặc hồng cầu nhược sắc (hypochromic red cell, HRC) <6%, hoặc lượng Hb hồng cầu lưới >29 pg.
- Nồng độ ferritin huyết thanh không được vượt quá 800 μg/L ở những bệnh nhân được điều trị sắt, nên xem xét chỉnh liều sắt khi ferritin >500 μg/L.
- Không nên bắt đầu điều trị bằng Erythropoietin (ESA) khi thiếu sắt tuyệt đối (ferritin <100 µg /L) cho đến khi tình trạng này được khắc phục và tình trạng thiếu máu vẫn tiếp diễn. Bệnh nhân thiếu sắt chức năng cần được bổ sung sắt trước hoặc khi bắt đầu điều trị bằng ESA.
- Giá trị Ferritin huyết thanh bình thường hoặc cao (≥100 μg/L) không loại trừ tình trạng thiếu sắt, vì có thể do các nguyên nhân khác như nhiễm trùng hoặc viêm nhiễm.
- Sử dụng sắt uống đủ để duy trì và có thể đủ để đạt được Hb mục tiêu ở bệnh nhân BTM được điều trị bằng ESA chưa cần lọc máu và ở những bệnh nhân đang lọc màng bụng (PD).
- Đối với bệnh nhân BTM không lọc thận nhân tạo, sự lựa chọn giữa sắt uống hay tiêm truyền phụ thuộc vào mức độ nghiêm trọng của tình trạng thiếu sắt, phản ứng trước đó và tác dụng phụ, khả năng tiếp cận tĩnh mạch và nhu cầu bắt đầu điều trị bằng ESA. Ngược lại, hầu hết bệnh nhân lọc thận nhân tạo sẽ cần truyền sắt tĩnh mạch.
- Đối với bệnh nhân lọc thận nhân tạo nên cung cấp sắt sucrose đường tĩnh mạch liều cao chủ động 400 mg mỗi tháng hoặc tương đương (phác đồ “liều cao, tần suất thấp” -HD/LF) trừ khi ferritin > 700 μg/L hoặc TSAT > 40%.
- Xét nghiệm theo dõi tình trạng sắt (1-3 tháng một lần) ở những bệnh nhân được truyền sắt tĩnh mạch để tránh ngộ độc, ferritin huyết thanh luôn trên 800 μg/L mà không có bằng chứng về viêm có thể gợi ý tình trạng quá tải sắt.
Các chế phẩm sắt:
- Sắt uống: uống các chế phẩm sắt không gây biến chứng và không có tác dụng trực tiếp để tạo ra FGF23 nhưng có nhược điểm là hiệu quả thấp hơn so với truyền tĩnh mạch, kém dung nạp qua đường tiêu hóa, hấp thu kém do tăng hepcidin, và có thể thay đổi hệ vi sinh vật.
Bảng 14. Một số chế phẩm sắt uống
| Tên hoạt chất | Hàm lượng sắt/viên (v) | Tổng lượng muối/viên | Liều dùng |
| Ferrous sulfate | 65mg | 325mg | 1000mg/ngày cho BN BTM |
| Ferrous fumarate | 106mg | 325mg | 600mg/ngày cho BN BTM |
| Ferrous gluconate | 38mg | 325mg | 1600mg cho BN BTM |
| Liposomal iron | 30mg | 30mg | 30mg/ ngày cho BN BTM |
- Sắt truyền tĩnh mạch: chế phẩm sắt truyền tĩnh mạch (hạt nano) có lõi Fe3+ oxyhydroxide/oxit, với lớp vỏ carbohydrate truyền tĩnh mạch có hiệu quả tương đương trong việc cải thiện Hb, ferritin và TSAT, đồng thời giảm sử dụng ESA hoặc nhu cầu truyền máu, tuy nhiên hiệu quả và độ an toàn của các sản phẩm sắt sucrose tương tự có thể giảm so với sắt sucrose gốc, và có một số khác biệt về độ an toàn giữa các công thức. Một số chế phẩm sắt truyền tĩnh mạch có thể làm giảm phosphat máu, như oxit sắt saccharated và sắt polymaltose, do chúng có khả năng tạo ra FGF23.
- Cung cấp sắt qua dịch lọc máu: một số muối sắt hòa tan trong nước như muối sắt III của citrate với pyrophosphate có thể được cung cấp qua dịch lọc hoặc truyền tĩnh mạch.
Bảng 15. Một số chế phẩm sắt truyền tĩnh mạch
| Tên dược chất | Nồng độ Fe (mg/ml) | Liều đơn tối đa | Liều tối đa mỗi tuần | Số phút (p) truyền cho liều tối đa | Số phút (p) tiêm TM/liều tối đa |
| Iron sucrose | 20 | 200mg | 500mg | 30ph (EMA) 15ph (FDA) | 10p (EMA) 2-5p (FDA) |
| LMW iron dextran | 50 | 20mg/kg | Không đề cập | 15p, sau đó 100mg/15p, tổng 4-6 giờ (EMA) | Khoảng 20p (EMA) >60p (FDA) |
FDA: Cục Quản lý Thực phẩm và Dược phẩm Hoa Kỳ; EMA, Cơ quan Dược phẩm Châu Âu; EMC: quản lý thuốc điện tử, LMW: trọng lượng phân tử thấp
4.4.2.2. Thuốc kích thích tạo hồng cầu (Erythropoiesis-Stimulating Agents - ESAs)
Điều trị ESA cho bệnh nhân BTM thiếu máu giúp giảm nguy cơ truyền máu;
Trước khi điều trị ESA, phải đạt mục tiêu đủ sắt với Ferritin ≥ 100 μg/L và TSAT>20%, và/ hoặc hồng cầu nhược sắc (HRC) <6%, hoặc Hb hồng cầu lưới >29 pg.
(1) Mục tiêu Hb:
- Mục tiêu điều trị: Hb 10-12 g/dl
- Khi Hb <10,0 g/dl cân nhắc quyết định bắt đầu ESA tùy theo cá thể, dựa trên tốc độ giảm nồng độ Hb, đáp ứng điều trị thiếu sắt, nguy cơ cần truyền máu, những rủi ro liên quan đến liệu pháp ESA và sự hiện diện của các triệu chứng do thiếu máu.
- Bệnh nhân BTM giai đoạn 5 đã lọc máu nên tránh để nồng độ Hb <9g/dL (90g/L) (2) Sử dụng và theo dõi điều trị thuốc kích thích tạo hồng cầu:
- Thuốc ESA: Đường sử dụng được khuyến cáo cho bệnh nhân điều trị bảo tồn là tiêm dưới da và cho bệnh nhân lọc máu là tiêm tĩnh mạch.
Bảng 16. Sử dụng thuốc kích thích tạo hồng cầu
| Thuốc ESA | Thời gian bán hủy (giờ) | Liều khởi đầu |
| Epoetin alfa và Epoetin beta | Tiêm TM: 6,8 Tiêm dưới da: 19,4 | TNT: 50-100 U/kg TM hoặc TDD 3 lần/tuần Chưa TNT: 50-100 U/kg TM hoặc TDD 1-2 lần/tuần |
| Methoxy polyethylene glycol-epoetin beta | Tiêm TM :130 Tiêm dưới da: 133 | TNT: 0,6 mcg/kg TM hoặc TDD mỗi 2 tuần Chưa TNT: 0,6 mcg/kg TM hoặc TDD mỗi 2-4 tuần |
- Theo dõi đáp ứng ESA dựa trên nồng độ Hb mục tiêu, tốc độ gia tăng Hb trong khoảng từ 10 -20g/L (1-2g/dL)/ 4 tuần. Nếu chưa đạt mục tiêu hoặc tăng Hb chậm có thể tang 25% liều mỗi 2 tuần và ngược lại nếu Hb đạt trên mục tiêu thì giảm 25% mỗi 2 tuần. Duy trì liều ESA khi đạt mục tiêu, theo dõi Hb mỗi 1-3 tháng.
- Đáp ứng không đầy đủ với ESA được định nghĩa là không đạt được mức Hb mục tiêu mặc dù đã dùng liều epoetin đường tiêm dưới da >300 IU/kg/tuần (đường tĩnh mạch >450 IU/kg/tuần).
- Sử dụng ESA nên được tiếp tục trong thời gian bệnh cấp tính, phẫu thuật hoặc bất kỳ nguyên nhân nhập viện nào khác, trừ khi có chống chỉ định rõ ràng như tăng huyết áp cấp tính.
- Thận trọng khi chỉ định liệu pháp ESA cho bệnh nhân BTM có tiền sử đột quỵ hoặc bệnh ác tính, đặc biệt ở bênh nhân bị bệnh ác tính đang điều trị. Nên theo dõi huyết áp ở tất cả bệnh nhân sử dụng ESA.
- Chẩn đoán bất sản riêng dòng hồng cầu do ESA (PRCA):
+ Chẩn đoán PRCA do ESA trên bệnh nhân được điều trị bằng ESA dài hạn (hơn 8 tuần) có tất cả các dấu hiệu sau:
● Giảm đột ngột nồng độ Hb với tốc độ 5 đến 10g/L mỗi tuần HOẶC yêu cầu truyền máu với tốc độ khoảng 1 đến 2 lần mỗi tuần,
● Số lượng tiểu cầu và bạch cầu bình thường,
● Số lượng hồng cầu lưới tuyệt đối nhỏ hơn 10.000/µl.
+ Nên ngừng thuốc ESA trên bệnh nhân PRCA do ESA, xét nghiệm kháng thể kháng EPO, sinh thiết tủy xương (có biểu hiện giảm các tế bào tiền thân sinh hồng cầu). Bệnh nhân nên được điều trị bằng thuốc ức chế miễn dịch tùy theo mức kháng thể kháng EPO. Khuyến cáo dùng Peginesatide để điều trị PRCA.
- Nên hạn chế truyền hồng cầu để giảm thiểu rủi ro liên quan truyền máu; nếu cần truyền khối hồng cầu nên truyền hồng cầu rửa qua phin lọc bạch cầu để giảm thiểu nguy cơ dị ứng và giảm nguy cơ tạo kháng thể - là điều gây cản trở cho bệnh nhân ghép thận về sau.
- Chỉ định truyền hồng cầu khi lợi ích lớn hơn rủi ro trong các trường hợp:
+ Điều trị ESA không hiệu quả (ví dụ: bệnh huyết sắc tố, suy tủy xương, kháng ESA)
+ Sử dụng ESA có nhiều nguy cơ (ví dụ: bệnh ác tính, đột quỵ trước đó)
+ Cần điều chỉnh nhanh tình trạng thiếu máu để ổn định tình trạng của bệnh nhân (ví dụ: xuất huyết cấp tính, bệnh động mạch vành không ổn định) hay khi cần điều chỉnh nhanh Hb trước phẫu thuật.
4.4.2.4. Thuốc ức chế Prolyl Hydroxylase của yếu tố cảm ứng khi thiếu oxy
Những năm gần đây, một nhóm thuốc mới đường uống đã được phát triển để điều trị thiếu máu do BTM, đó là chất ức chế HIF-prolyl-hydroxylase (HIF-PHIs). Nhóm thuốc này ức chế hoạt động của prolyl-hydroxylase, dẫn đến tăng nồng độ HIF, và do đó, làm tăng EPO nội sinh. Hiện có bốn thuốc HIF-PHI đã hoặc đang được thử nghiệm lâm sàng giai đoạn III: roxadustat, daprodustat, vadadustat và molidustat. Tuy nhiên, chúng có sự khác biệt về dược lực học và dược động học, dẫn đến sự khác biệt trong tương tác với hệ thống HIF và khác biệt về dữ liệu hiệu quả và an toàn.
Rối loạn đường máu với BTM bao gồm:
- Bệnh thận đái tháo đường: tổn thương thận do ĐTĐ gây ra. Xin tham khảo chương V - CHẨN ĐOÁN VÀ XỬ TRÍ MỘT SỐ BỆNH THẬN THƯỜNG GẶP phần Bệnh thận đái tháo đường.
- Rối loạn đường máu hoặc ĐTĐ trên BN bị BTM không do nguyên nhân ĐTĐ, hay BTM kèm ĐTĐ.
- Rối loạn đường máu trên BN bị BTM là yếu tố nguy cơ tiến triển BTM, làm giảm MLCT, tăng đáng kể nguy cơ tim mạch và chi phí chăm sóc sức khỏe.
4.5.2. Chẩn đoán ĐTĐ và theo dõi đường máu
4.5.2.1. Tiêu chuẩn chẩn đoán đái tháo đường: dựa vào 1 trong 4 tiêu chí
1) Glucose huyết tương lúc đói ≥ 126 mg/dL (hay 7 mmol/L) hoặc:
2) Glucose huyết tương ở thời điểm sau uống 75g glucose 2 giờ (nghiệm pháp dung nạp glucose) ≥ 200 mg/dL (hay 11,1 mmol/L); hoặc
3) HbA1c ≥ 6,5% (48 mmol/mol); hoặc
4) BN có triệu chứng kinh điển của tăng glucose máu hoặc của cơn tăng glucose máu cấp kèm mức glucose huyết tương bất kỳ ≥ 200 mg/dL (hay 11,1 mmol/L).
Chẩn đoán xác định nếu có 2 kết quả của cùng 1 mẫu máu xét nghiệm trên ngưỡng chẩn đoán hoặc ở 2 thời điểm khác nhau đối với tiêu chí 1, 2 hoặc 3; riêng tiêu chí 4 chỉ cần một lần xét nghiệm duy nhất.
4.5.2.2. Chẩn đoán tiền ĐTĐ: rối loạn glucose máu đói (100-125 mg/dL), hoặc rối loạn dung nạp glucose máu (140-199 mg/dL), hoặc HbA1c 5,7%-6,4%.
4.5.2.3. Theo dõi đường máu
- Khuyến cáo sử dụng HbA1c để theo dõi kiểm soát đường máu ở BN ĐTĐ và BTM
+ Theo dõi điều trị bằng HbA1C 2-4 lần /năm;
+ Bệnh thận mạn tiến triển giai đoạn 4-5(G4-G5) và giai đoạn lọc máu: giá trị HbA1C ít tin cậy.
Khuyến cáo mục tiêu HbA1C: cá thể hóa trong khoảng từ 6,5% - 8,0% ở BN ĐTĐ và BTM không lọc máu, thông thường mục tiêu < 7%
Bao gồm các liệu pháp thay đổi lối sống, chế độ ăn, luyện tập và:
- Điều trị đầu tay với metformin kết hợp thuốc ức chế kênh đồng vận chuyển natri- glucose-2 (SGLT2i) cho BN ĐTĐ týp 2 và BTM có MLCT ≥30 ml/phút/1,73 m2 da.
- Thuốc ức chế SGLT2 cho BN ĐTĐ týp 2 và BTM có MLCT ≥20 ml/phút/1,73m2 da.
- Thuốc đồng vận thụ thể peptide-1 giống glucagon (GLP-1 RA) được ưu tiên sử dụng khi không đạt được mục tiêu đường máu hoặc không dung nạp với metformin và ức chế SGLT2. Nên sử dụng loại GLP-1 RA tác dụng kéo dài. GLP-1 RA được ưu tiên vì có lợi ích tim mạch, đặc biệt ở BN mắc bệnh tim mạch do xơ vữa đã được xác lập ngay cả với MLCT <60 ml/phút/1,73m2, làm giảm albumin niệu và làm chậm quá trình giảm MLCT.
- Các nhóm thuốc hạ đường máu khác cũng có thể được sử dụng như thuốc ức chế DPP-4 với nguy cơ hạ đường máu thấp.
- Tất cả các loại thuốc hạ đường máu nên được lựa chọn và chỉnh liều theo MLCT.
4.5.3.3. Các nhóm thuốc kiểm soát đường máu
(1) Metformin
Khuyến cáo sử dụng metformin để điều trị ĐTĐ týp 2 khi MLCT >30 ml/phút/1,73m2
- Tăng cường theo dõi mức lọc cầu thận khi MLCT < 60 ml/phút/1,73 m2
- Cân nhắc liều khi MLCT từ 45-59 ml/phút/1,73m2
- Liều tối đa nên giảm một nửa khi MLCT giảm xuống còn 30-45 ml/phút/1,73 m2.
- Nên ngừng metformin khi MLCT giảm còn < 30 ml/phút/1,73 m2 hoặc khi bệnh nhân bắt đầu lọc máu.
- Nên theo dõi để phát hiện thiếu máu do thiếu vitamin B12 nếu bệnh nhân đã được điều trị bằng metformin từ 4 năm trở lên. Lưu ý các tác dụng phụ như tiêu chảy, hạ huyết áp, nôn mửa,… có thể gây suy giảm chức năng thận và các biến chứng do tích lũy metformin vì suy thận.
(2) Nhóm thuốc ức chế kênh đồng vận chuyển natri-glucose-2 (SGLT2i)
- Khuyến cáo sử dụng thuốc ức chế SGLT2 cho bệnh nhân ĐTĐ týp 2 có MLCT ≥20 ml/phút/1,73m2 da.
- Ngừng thuốc ức chế SGLT2 trong thời gian nhịn ăn kéo dài, phẫu thuật hoặc bệnh nặng (khi bệnh nhân có thể tăng nguy cơ nhiễm toan ceton).
- Có thể xảy ra tình trạng giảm MLCT có hồi phục khi bắt đầu điều trị thuốc ức chế SGLT2 và thường không phải là dấu hiệu để ngừng điều trị.
- Sau khi khởi trị, thuốc ức chế SGLT2i được tiếp tục sử dụng ngay khi MLCT giảm xuống dưới 20 ml/phút/1,73 m2, trừ khi bệnh nhân không dung nạp hoặc bắt đầu điều trị thay thế thận.
- Thuốc SGLT2i chưa được nghiên cứu đầy đủ ở bệnh nhân ghép thận hay lọc máu.
- Liều dùng:
+ Dapagliflozin 10mg/ngày
+ Empagliflozin 10mg/ngày (có thể tăng đến 25mg/ngày nếu cần kiểm soát đường máu)
+ Canagliflozin 100mg/ngày
(3) Thuốc đồng vận thụ thể GLP-1 (GLP-1 RA)
- Khuyến cáo sử dụng thuốc nhóm GLP-1 RA cho BN ĐTĐ týp 2 và BTM không đạt được mục tiêu đường máu hoặc không dung nạp với metformin và thuốc ức chế SGLT2.
- Để giảm tác dụng phụ của GLP-1 RA lên đường tiêu hóa, nên bắt đầu với liều thấp và chỉnh liều từ từ. Không nên phối hợp đồng thời thuốc ức chế DPP-4 và GLP-1 RA.
- GLP-1 RA có thể được ưu tiên sử dụng ở những bệnh nhân béo phì, ĐTĐ týp 2 và BTM để giảm cân có chủ ý.
- Nguy cơ hạ đường máu tăng lên nếu sử dụng đồng thời với các thuốc điều trị ĐTĐ khác, do đó khi sử dụng GLP-1 RA nên giảm liều sulfonylurea hoặc insulin.
- Liều lượng và cách sử dụng : xem phần bệnh thận Đái tháo đường. (4) Thuốc ức chế men Dipeptidyl peptidase 4 (DPP-4)
Bảng 17. Liều thuốc ức chế DPP-4 hàng ngày theo chức năng thận
| Liều thuốc ức chế DPP4 theo MLCT ước tính (ml/phút/1,73m2) | |||||
| Nhóm ức chế DPP4 | ≥ 60 | 45-59 | 30-44 | 15-29 | < 15 |
| Sitagliptin | 100 mg/ngày | 100 mg/ngày | 50 mg/ngày | 25 mg/ngày | 25 mg/ngày |
| Vildagligtin | 100 mg/ngày | 50 mg/ngày | 50 mg/ngày | 50 mg/ngày | 50 mg/ngày |
| Saxagliptin | 5 mg/ ngày | 5 mg/ngày | 2,5 mg/ngày | 2,5 mg/ngày | Không |
| Linagliptin | 5 mg/ ngày | 5 mg/ngày | 5 mg/ngày | 5 mg/ngày | 5 mg/ngày |
Các thuốc ức chế DPP-4 không gây hạ đường máu và được dung nạp rất tốt, có thể sử dụng đơn trị liệu hoặc kết hợp với bất kỳ loại thuốc nào khác, ngoại trừ GLP-1 RA. Hầu hết các thuốc ức chế DPP-4 cần chỉnh liều theo chức năng thận ngoại trừ linagliptin.
(5) Sulfonylurea (SU)
SU không phải là thuốc được ưu tiên trong BTM. Glipizide là SU duy nhất có thể dùng được cho bệnh nhân BTM vì được chuyển hóa thành các dẫn chất không hoạt tính, nhưng không dùng khi MLCT thấp <30 ml/phút/1,73 m2. Repaglinide được chuyển hóa ở gan với tỉ lệ thải trừ qua thận dưới 10%, nhưng nên bắt đầu với liều thấp 0,5 mg/ngày.
(6) Ức chế α-Glucosidase
Dữ liệu của các thuốc này ở BTM còn hạn chế. Các thuốc ức chế α-Glucosidase có hiệu lực thấp trong việc giảm đường máu, gây tác dụng phụ đáng kể trên đường tiêu hóa và có nguy cơ tích lũy ở bệnh nhân suy thận, vì vậy không khuyến cáo sử dụng.
(7) Glitazon
Có thể sử dụng ở người BTM mà không phải chỉnh liều do thuốc không được thải trừ qua thận. Các thuốc nhóm này làm tăng nhạy cảm với insulin và không gây hạ đường máu. Do thuốc gây giữ nước nên cần thận trọng khi sử dụng ở người bị phù và tăng cân, thuốc bị chống chỉ định ở người suy tim nặng. Thuốc cũng có thể gây mất xương và tăng nguy cơ gãy xương.
(8) Insulin
Nhu cầu insulin của mỗi BN rất khác nhau, do đó cần điều chỉnh phù hợp thông qua theo dõi đường máu và MLCT:
- MLCT > 50 ml/phút/1,73 m2: không cần điều chỉnh liều.
- MLCT 50-10 ml/phút/1,73 m2: giảm 25% liều insulin trước đó.
- MLCT < 10 ml/phút/1,73 m2: giảm 50% liều insulin trước đó.
Chế độ điều trị insulin sẽ được điều chỉnh phù hợp với mục tiêu kiểm soát đường, có thể là liệu pháp điều trị thông thường hoặc điều trị tích cực, trong đó chế độ điều trị “nền - nhanh” (basal-bolus) có tỷ lệ hạ đường máu thấp nhất.
Bệnh nhân BTM giai đoạn muộn (MLCT< 20 ml/phút/1,73 m2) kèm ĐTĐ týp 2 khi tiến triển đến giai đoạn cuối sẽ cần liều insulin thấp hơn hoặc không cần dùng thuốc kiểm soát đường máu.
4.5.3.4. Kiểm soát hạ đường máu
Nguy cơ hạ đường máu tăng lên ở bệnh nhân BTM tiến triển được điều trị bằng thuốc do nồng độ insulin máu, sulfonylurea, meglitinide… trong máu tăng. Nên sử dụng các thuốc ít gây nguy cơ hạ đường máu như metformin, thuốc ức chế SGLT2, thuốc đồng vận GLP-1, thuốc ức chế DPP-4.
Cần theo dõi sát đường máu và có thể dùng thiết bị theo dõi liên tục để cải thiện việc kiểm soát đường máu, đồng thời giảm nguy cơ gây hạ đường máu.
Bảng 18. Nguy cơ hạ đường máu của các thuốc điều trị ĐTĐ
| Thuốc điều trị ĐTĐ | Nguy cơ hạ đường máu |
| - Insulin - Sulfonylurea - Meglitinide | Cao |
| Thuốc điều trị ĐTĐ | Nguy cơ hạ đường máu |
| - Metformin - Ức chế SGLT2 - Đồng vận thụ thể GLP-1 - Ức chế DPP-4 | Thấp |
| DPP-4: dipeptidyl peptidase-4; GLP-1: glucagon-like peptide-1; SGLT2: sodium- glucose cotransporter-2 | |
4.6.1. Đại cương về rối loạn lipid máu và BTM
Bảng 19. Các rối loạn lipid máu ở các nhóm BTM
|
| HCTH | BTM gđ 1-2 | BTM gđ 3-4 | Lọc máu | Lọc màng bụng | Ghép thận |
| Cholesterol | ↑↑ | = | = | = hoặc ↓ | ↑ | ↑ |
| LDL | ↑↑ | = | = hoặc ↓ | = hoặc ↓ | ↑ | ↑ |
| HDL | ↓ | ↓ | ↓ | ↓ | ↓ | = hoặc ↓ |
| Triglycerides | ↑↑ | ↑↑ | ↑↑ | = hoặc ↑ | ↑↑ | ↑ hoặc ↑↑ |
*HCTH: hội chứng thận hư; BTM gđ: bệnh thận mạn giai đoạn;
4.6.2. Tầm soát rối loạn lipid máu
- Kiểm soát nguy cơ tim mạch là ưu tiên hàng đầu ở BN BTM ở tất cả các giai đoạn.
- Xét nghiệm lipid (bao gồm cholesterol toàn phần và HDL, triglyceride và LDL) là bắt buộc để đưa ra chiến lược điều trị tối ưu.
- Phân tầng nguy cơ tim mạch mức độ cao đối với BTM giai đoạn 3 tương ứng MLCT 30-59 ml/phút/1,73m2), mức độ rất cao đối với BTM giai đoạn 4-5 tương ứng MLCT < 30 ml/phút/1,73m2
BTM được công nhận là nguy cơ tương đương với bệnh động mạch vành (CAD).
4.6.3.1. Mục tiêu kiểm soát và khởi trị rối loạn lipid máu trên BTM
Mục tiêu kiểm soát
Đối với BTM không lọc máu, mục tiêu khuyến cáo là LDL < 70 mg/dL ở bệnh nhân nguy cơ cao và < 55 mg/dL ở những bệnh nhân có nguy cơ rất cao.
Khởi trị rối loạn lipid máu
Các BN bị BTM có nguy cơ cao hoặc rất cao, đã áp dụng các biện pháp thay đổi lối sống, chế độ ăn mà vẫn không đạt LDL mục tiêu cần được điều trị thuốc.
Khuyến cáo điều trị bằng statin hoặc statin/ezetimibe cho BN bị BTM giai đoạn 3-5; nên tiếp tục điều trị cho những BN đã bắt đầu dùng các thuốc này tại thời điểm bắt đầu lọc máu, đặc biệt ở BN có bệnh tim mạch do XVĐM.
Bệnh nhân lọc TNT và lọc màng bụng: không nên bắt đầu điều trị bằng statin hoặc statin/ezetimibe nếu không có bệnh tim mạch do XVĐM
Tiếp tục điều trị statin cho BN sau ghép thận.
4.6.3.2. Các nhóm thuốc
a. Statin
Bảng 20. Liều các thuốc statin sử dụng trong BTM
| Statin | BTM giai đoạn 1-2 | BTM giai đoạn 3a-5, Lọc máu, ghép thận (mg/ngày) |
| Lovastatin | Liều thông thường | Không có nghiên cứu |
| Fluvastatin | Liều thông thường | 80 (ALERT) |
| Atorvastatin | Liều thông thường | 20 (4D) |
| Rosuvastatin | Liều thông thường | 10 (AURORA) |
| Simvastatin/Ezetimibe | Liều thông thường | 20/10 (SHARP) |
| Pravastatin | Liều thông thường | 40 |
| Simvastatin | Liều thông thường | 40 |
| Pitavastatin | Liều thông thường | 2 |
- Chỉ định: tăng LDL, cholesterol toàn phần, triglyceride (TG)
- Tác dụng phụ: bệnh cơ (bao gồm viêm cơ), tiêu cơ vân kèm hoặc không kèm tổn thương thận cấp, đau cơ, chuột rút, suy nhược, viêm gan/vàng da; tăng men gan, phosphatase kiềm, CPK, HbA1c và đường máu lúc đói.
b. Nhóm thuốc Ezetimibe
- Chỉ định: tăng cholesterol toàn phần, tăng LDL
- Liều lượng:
+ Ezetimibe đơn trị liệu không được khuyến cáo, khuyến cáo điều trị bằng statin hoặc statin/ezetimibe. Ezetimibe liều kết hợp là 10mg
+ Bệnh nhân lọc màng bụng Ezetimibe 10 mg kết hợp simvastatin 10 - 20mg/ngày
+ Không có chỉ định chuyên biệt cho Ezetimibe trên ghép thận.
- Tác dụng phụ: Suy nhược, đau cơ, đau khớp, tăng men gan và creatine phosphokinase, tiêu chảy, khó tiêu, viêm dạ dày, đau đầu.
c. Nhóm Fibrate
- Tác dụng: giảm triglycerid (TG) từ 35-50%, tăng HDL-cholesterol (đơn trị liệu) từ 5 đến 20%. Bệnh nhân có TG huyết thanh > 500 mg/dL cần sử dụng nhóm Fibrate kết hợp thay đổi lối sống để giảm TG, do nguy cơ viêm tụy cấp cao, đặc biệt khi TG >1000 mg/dL.
- Khuyến cáo Fibrate có thể là nhóm thuốc hàng thứ hai để giảm TG trong HCTH. Nên tránh kết hợp fibrate và statin (làm tăng nguy cơ viêm cơ), nên tránh dùng Benzafibrate trong BTM do thuốc được bài tiết chủ yếu qua thận.
- Tác dụng phụ: mày đay, đau cơ (chủ yếu khi kết hợp với statin), tăng nhẹ transaminase và phosphatase kiềm, tăng sinh sỏi mật, các triệu chứng tiêu hóa.
- Tương tác thuốc: có thể làm tăng tác dụng của thuốc chống đông đường uống (warfarin), tăng độ thanh thải cyclosporine gây giảm nồng độ cyclosporine huyết thanh (ở bệnh nhân ghép tạng).
- Theo dõi: cần theo dõi chặt chẽ creatinine huyết thanh trong quá trình điều trị bằng fenofibrate, đặc biệt ở người cao tuổi, ĐTĐ, nên ngừng thuốc nếu creatinine tăng >30% giá trị nền. Fenofibrate nên được sử dụng thận trọng ở BN ghép thận đang dùng cyclosporine. Fibrate bị chống chỉ định ở BN có MLCT < 15 ml/phút/1,73 m2.
d. Nhóm ức chế Proprotein convertase subtilisin/kexin type 9
Proprotein convertase subtilisin/kexin type 9 (PCSK9) là một protease gây ra sự thoái giáng của thụ thể LDL. FDA đã phê duyệt một số kháng thể đơn dòng có tác dụng ức chế PCSK9, giúp giảm cholesterol huyết thanh một cách hiệu quả cho đến khi giá trị trung bình là 20-30 mg/dL ở người đã điều trị bằng statin liều tối đa. Các thuốc này được chỉ định cho những người có nguy cơ bệnh tim mạch cao và người trưởng thành bị tăng cholesterol máu có tính chất gia đình.
Bên cạnh đó, FDA và châu Ân cũng đã phê duyệt cho nhóm thuốc ức chế PCSK9 thông qua tác động đến mRNA của protein này.
e. Phối hợp với các biện pháp không dùng thuốc bao gồm chế độ ăn, thay đổi lối sống, luyện tập cho BN bị BTM
4.7. KIỂM SOÁT TĂNG ACID URIC MÁU
4.7.1. Lâm sàng của tăng acid uric
Tăng acid uric máu có thể không triệu chứng hoặc biểu hiện dưới dạng viêm khớp cấp do sự kết tủa của các tinh thể urat monosodium trong khớp, bệnh gút có hạt tophi do kết tủa các tinh thể trong da và mô tế bào dưới da, sỏi thận do urat, bệnh thận do acid uric cấp tính và mạn tính.
Hiện chưa có đủ bằng chứng để điều trị tăng acid uric máu không triệu chứng. Quyết định bắt đầu điều trị sẽ dựa trên nguy cơ phát triển lắng đọng tinh thể, bệnh gút hoặc bệnh thận do acid uric của mỗi BN, cũng như các tác dụng phụ liên quan đến điều trị và cần được cá thể hóa. Cần điều trị cho BN bị BTM và tăng acid uric máu có triệu chứng.
Thuốc hạ acid uric máu bao gồm:
a) Thuốc ức chế xanthine oxidase (XO) ngăn chặn quá trình chuyển hóa purine,
b) Uricosurics tác động lên nguyên nhân chính gây tăng acid uric máu, đó là khả năng bài tiết qua thận kém,
c) Điều trị bằng uricase giúp oxy hóa urat, thông qua một phản ứng enzym.
Nên bắt đầu điều trị bằng thuốc hạ acid uric sau khi xảy ra cơn gút đầu tiên ở bệnh nhân BTM từ giai đoạn 2 trở lên. Mục tiêu là giữ nồng độ acid uric dưới 6 mg/dL (5 mg/dL đối với bệnh gút có hạt tophi). Ưu tiên sử dụng thuốc ức chế XO hơn là uricosurics.
Bảng 21 trình bày danh sách các loại thuốc hạ acid uric, cơ chế hoạt động và liều lượng của chúng đối với các giai đoạn BTM khác nhau.
Quy tắc chung trong sử dụng thuốc hạ acid uric:
a) Luôn bắt đầu điều trị dự phòng
b) Bắt đầu với liều thấp nhất và theo dõi nồng độ acid uric cho đến khi đạt được mục tiêu
c) Không nên ngừng thuốc hoặc thay đổi liều lượng trong cơn gút cấp,
d) Khi khởi trị, nên dùng thuốc sau khi đã giải quyết xong cơn gút cấp
Khuyến cáo điều trị dự phòng cơn gút cấp trong ba hoặc sáu tháng khi bắt đầu dùng thuốc hạ acid uric máu ở những trường hợp bệnh gút có hạt tophi. Ưu tiên dùng colchicine liều thấp phối hợp glucocorticoid tiêm vào khớp hoặc uống để điều trị cơn gút cấp hơn là dùng NSAIDs. Colchicine chống chỉ định ở bệnh nhân có MLCT dưới 30 ml/phút/1,73 m2 và giảm liều 0,5 mg/ngày ở bệnh nhân BTM giai đoạn 3. Cần tư vấn thay đổi chế độ ăn uống như giảm thịt, hạn chế dùng đồ uống có cồn, sirô chứa nhiều fructose.
Bảng 21. Liều khuyến cáo cho các thuốc hạ acid uric máu ở BTM.
| Thuốc | Nhóm | Liều | Lưu ý ở BN CKD (G3-5) | Khuyến cáo (G5D) |
| Allopurinol | Ức chế XO (iXO) | Khởi đầu: 50-100 mg/ngày Tối đa: 800mg/ngày | MLCT ≥ 30 Khởi đầu 50-100 mg/ngày MLCT < 30 Khởi đầu 50 mg/ngày | HD: khởi đầu 100 mg sau lọc máu PD: khởi đầu 50 mg/ngày |
| Febuxostatb | Ức chế XO | Khởi đầu: 40mg/ngày Tối đa: 120mg/ngày | Chưa đủ dữ liệu ở bn với MLCT < 30 ml/phút | Chưa đủ dữ liệu |
| Các thuốc tăng đào thải acid uric qua nước tiểu | Chỉnh liều tùy theo MLCT, cần dùng phối hợp với iXO | Chống chỉ định | ||
HD: lọc máu chu kỳ, PD: lọc màng bụng
a: Có thể tăng liều Allopurinol sau mỗi 2-5 tuần cho đến khi đạt mục tiêu acid uric máu
b: Febuxostat không nên sử dụng ở những bệnh nhân có nguy cơ tim mạch cao.
Bảng 22. Thuốc chỉ định điều trị cơn gút cấp và chỉnh liều trong BTM
| Thuốc | Chức năng thận bình thường | BTM (G3-G5) | Lọc máu |
| Colchicine | 1-2 mg/ngày, tối đa 2 mg/ngày. Không vượt quá 6 mg trong 4 ngày | GĐ G3 giảm nửa liều và tăng khoảng cách | Chống chỉ định |
| NSAIDs | Bất cứ loại nào với liều thông thường | MLCT< 30: chống chỉ định GĐ G3 dùng thận trọng và giảm liều | Bất cứ loại nào với liều thông thường |
| Glucocorticoids (BN chống chỉ định colchicin, NSAIDs) | 0.5 mg/kg/ngày, giảm 5 mg mỗi 2 ngày | Giống trong chức năng thận bình thường | Giống trong chức năng thận bình thường |
| ACTH analog (tetracosactide depot) | 25-40 mg (TB/TDD) ở BN không đáp ứng điều trị khác | Không cần chỉnh liều | Không cần chỉnh liều |
| Ức chế IL-1 (gút kháng trị) | Anakinra liều 100 mg TDD/ngày* Canakinumab 150 mg, T D D một liều đơn | GĐ G4: Anakinra 100 mg/48h Canakinumab: không cần chỉnh liều | Anakinra 100 mg/48h Canakinumab: không chỉnh liều |
* Không có chỉ định trong bảng dữ liệu của thuốc, mặc dù có những nghiên cứu hỗ trợ việc sử dụng nó.
4.8. KIỂM SOÁT RỐI LOẠN CHUYỂN HÓA XƯƠNG VÀ KHOÁNG XƯƠNG
Rối loạn chuyển hóa xương và khoáng xương do BTM (Chronic kidney disease-Mineral bone disease, CKD-MBD) là “một rối loạn hệ thống” về chuyển hóa các chất khoáng xương và xương do BTM được biểu hiện bằng một hoặc kết hợp các rối loạn sau:
- Bất thường về chuyển hóa canxi, phốt pho, PTH hoặc vitamin D.
- Bất thường trong chuyển hóa xương, khoáng hóa, khối lượng hoặc độ bền.
- Vôi hóa mạch máu hoặc mô mềm.
Rối loạn về hóa sinh thông thường bao gồm bất thường của nồng độ canxi, phosphate và magie, hormone tuyến cận giáp (PTH), yếu tố tăng trưởng nguyên bào sợi-23 (FGF-23) và vitamin D.
CKD-MBD bao gồm những rối loạn sau đây:
- Viêm xương xơ: một biểu hiện của cường tuyến cận giáp, đặc trưng bởi tăng hoạt động của hủy cốt bào và nguyên bào xương, xơ hóa quanh bè xương và tăng chu chuyển xương.
- Nhuyễn xương: một biểu hiện của sự giảm khoáng hóa xương, trước đây thường do ứ đọng nhôm.
- Bệnh xương bất sản (ABD): đặc trưng bởi giảm chu chuyển xương.
- Thiểu xương và loãng xương.
- Loạn dưỡng xương hỗn hợp do thận: phối hợp của các bất thường trên.
- Các bất thường khác về xương trong BTM (ví dụ: nhiễm toan mạn tính, bệnh amyloidosis do β2-microglobulin).
Bảng 23. Các chỉ dấu của cường cận giáp thứ phát do thận
| XƯƠNG | NGOÀI XƯƠNG |
| Loãng xương | Canxi hóa mạch máu, mô mềm |
| Gãy xương | Loét da hoại tử do canxi (calciphylaxis) |
| Đau cơ, đau khớp | Ngứa |
| Biến dạng xương | Thiếu máu |
| Chậm phát triển ở trẻ nhỏ | Hội chứng mắt đỏ |
Bảng 24. Hệ thống TMV phân loại loạn dưỡng xương do thận
| Chu chuyển xương (T) | Khoáng hoá xương (M) | Thể tích xương (V) |
| Thấp | Bình thường | Thấp |
| Bình thường | Bất thường | Bình thường |
| Cao |
| Cao |
Sinh thiết xương được xem là tiêu chuẩn vàng để chẩn đoán loạn dưỡng xương do thận. Do chi phí cao và yêu cầu kỹ thuật chặt chẽ, thực tế hầu hết các trường hợp thường sử dụng các dấu ấn sinh học xương để đánh giá loạn dưỡng xương do thận.
4.8.2. Chẩn đoán và chẩn đoán phân biệt
4.8.2.1. Xét nghiệm
- Canxi máu: thường giảm từ giai đoạn 4, và tăng khi có cường cận giáp.
- Phosphate máu: thường tăng rõ từ giai đoạn 4 trở đi.
- Hormon cận giáp PTH: thường định lượng PTH nguyên vẹn (iPTH), giới hạn bình thường ở người lớn là ~60 pg/ml, chẩn đoán loạn dưỡng xương do thận bằng iPTH chỉ khi giá trị ở mức rất cao.
- Ở BN lọc máu, nồng độ iPTH trên 600 pg/ml là dấu hiệu của viêm xương xơ hóa. Ở các giai đoạn sớm của BTM, ngưỡng iPTH trong chẩn đoán chưa được xác định rõ.
- Vitamin D: định lượng nồng độ 25-hydroxyvitamin D3 huyết thanh.
- Phosphatase kiềm (ALP): tăng cao trong bệnh xương do cường cận giáp, là dấu hiệu của hủy xương. Chỉ số phosphatase kiềm đặc hiệu xương (b-ALP) có giá trị chẩn đoán cao hơn ALP.
- Osteocalcin: giúp đánh giá tốc độ chu chuyển xương.
- Phosphatase acid kháng tartrate và các sản phẩm thoái hóa collagen: đánh giá hoạt động của hủy cốt bào .
4.8.2.2. X quang xương
X quang xương có thể phát hiện các triệu chứng trong bệnh lý xương do thận ở giai đoạn muộn, do hậu quả của cường cận giáp thứ phát: xói mòn dưới màng xương ở tay, xương đòn, xương chậu, các ổ khuyết xương khu trú trên phim X quang sọ…
X quang xương ít có giá trị chẩn đoán do có thể bình thường ngay cả ở những bệnh nhân có rối loạn nặng trên sinh thiết xương.
4.8.2.3. Đo mật độ xương
Đo hấp phụ năng lượng tia X kép (Dual Energy X-ray Absorptiometry, DEXA) được sử dụng rộng rãi, mặc dù DEXA không xác định bản chất của loạn dưỡng xương hoặc giúp chẩn đoán phân biệt với loãng xương nguyên phát, nhưng giúp dự đoán nguy cơ gãy xương ở bệnh nhân BTM.
4.8.2.4. Sinh thiết xương
Không được ứng dụng nhiều trong lâm sàng, có thể cân nhắc chỉ định khi:
- Có sự khác biệt/không đồng bộ giữa các kết quả xét nghiệm
- Gãy xương hoặc đau xương không giải thích được.
- Canxi hoá mạch máu tiến triển nặng
- Tăng canxi máu không giải thích được
- Nghi ngờ có nhiễm độc nhôm
- Xem xét điều trị ở bệnh nhân BTM bị gãy xương.
4.8.3. Kiểm soát rối loạn xương và khoáng xương trong BTM
Mục tiêu chính là điều trị dự phòng sự xuất hiện các rối loạn xương và khoáng xương, cường cận giáp thứ phát.
Nên điều trị cường cận giáp ở bệnh nhân BTM từ giai đoạn 3, để ngăn ngừa tăng sản tuyến cận giáp.
4.8.3.1. Kiểm soát canxi, phosphate và PTH máu bằng phương pháp nội khoa
- Chế độ ăn hạn chế phosphate: hạn chế protein, tránh các sản phẩm từ sữa và một số loại hạt (như hạnh nhân), các thức ăn chế biến sẵn.
- Các thuốc gắn phosphate: gồm các muối nhôm, magiê, sắt, canxi và các polymer không hấp thu ở đường ruột. Các thuốc gắn phosphate chứa canxi và sevelamer được sử dụng nhiều nhất trên lâm sàng.
- Bổ sung canxi
- Bổ sung vitamin D: khi nồng độ 25-hydroxyvitamin D < 30 ng/ml, cường cận giáp và/hoặc hạ canxi máu kéo dài
- Calcitriol và các vitamin D 1α-hydroxyl hóa như 1α-hydroxyvitamin D3 (alfacalcidol), 1α-hydroxyvitamin D2 (doxercalciferol) và 19-nor-1α,25- dihydroxyvitamin D2 (paricalcitol) đều có hiệu quả kiểm soát cường cận giáp thứ phát.
- Cần xét nghiệm hormon cận giáp, điều chỉnh tình trạng thiếu 25-hydroxyvitamin D và kiểm soát phosphate huyết thanh trước khi khởi trị vitamin D.
Bảng 25. So sánh các nhóm thuốc gắn phosphate
| Thuốc | Ưu điểm | Nhược điểm |
| Chứa canxi | Hiệu quả, rẻ tiền | Có thể gây tăng canxi máu và/hoặc thúc đẩy canxi hoá mạch máu |
| Sevelamer | Hiệu quả, giảm tác dụng phụ trên tiêu hoá (buồn nôn, nôn, tiêu chảy, đầy bụng, đau bụng, canxi hoá mạch máu) do ít làm tăng canxi máu | Đắt tiền. |
| Chứa magiê | Hiệu quả, rẻ tiền | Tác dụng phụ trên đường tiêu hoá (tiêu chảy), suy hô hấp (hiếm gặp) |
| Chứa nhôm | Hiệu quả, rẻ tiền | Bệnh não, thiếu máu, nhuyễn xương. |
Bảng 26. Nồng độ mục tiêu của canxi, phosphate và PTH
|
| KDOQI | KDIGO | JSDT |
| Canxi |
|
|
|
| BTM 3-5 | Bình thường | Bình thường | - |
| BTM 5D | Bình thường | Bình thường (8,4-10 mg/dL) | 8,4 - 9,5 mg/dL |
| Phosphate |
|
|
|
| BTM 3-4 | 2,7-4,6 mg/dL | Bình thường | - |
| BTM 5 | 3,5-5,5 mg/dL | Bình thường | - |
| BTM 5D | < 5,5 mg/dL | Bình thường | 3,5-6,0 mg/dL |
| iPTH |
|
|
|
| BTM 3 | 35-70 pg/mL | - | - |
| BTM 4 | 70-110 pg/mL | - | - |
| BTM 5 | 200-300 pg/mL | - | - |
| BTM 5D | 200-300 pg/mL | 2-9 lần giới hạn bình thường trên | 60-180 pg/mL |
- Calcimimetics (thuốc bắt chước canxi): chế phẩm được sử dụng là Cinacalcet điều trị cường cận giáp và không làm tăng canxi máu. Chỉ định cho BN BTM giai đoạn cuối và BN lọc máu, khi iPTH huyết thanh > 300 pg/mL.
4.8.3.2. Phẫu thuật cắt bỏ tuyến cận giáp
Chỉ định phẫu thuật cắt tuyến cận giáp:
- Bệnh nhân BTM giai đoạn cuối, có cường cận giáp nặng (thường là PTH > 800 pg/mL và ALP tăng cao) và có thêm các triệu chứng:
+ Tăng canxi máu dai dẳng
+ Tăng phosphate máu dai dẳng
+ PTH tăng liên tục không đáp ứng điều trị nội khoa
+ Canxi hóa ngoài xương tiến triển, bao gồm calciphylaxis
+ Ngứa dai dẳng
- Bệnh nhân được ghép thận có:
+ PTH tăng kèm tăng canxi máu không kiểm soát được bằng nội khoa
+ PTH tăng kèm giảm chức năng thận ghép không giải thích được
Bảng 27. Kiểm soát CKD-MBD theo giai đoạn BTM
| GIAI ĐOẠN 3 | GIAI ĐOẠN 4 | GIAI ĐOẠN 5 | |
| Theo dõi nồng độ Ca/P/iPTH/ALP | XN Ca, P 3-6 tháng/lần ở gđ 4; 1-3 tháng/lần ở gđ 5 XN PTH 6-12 tháng/lần ở gđ 4; 3-6 tháng/lần ở gđ 5 XN ALP 12 tháng/lần
| ||
| Định lượng vitamin D và điều trị nếu cần |
| ||
| Chế độ ăn hạn chế Phosphate |
| ||
| Thuốc hạ phosphate máu |
| ||
|
| Vitamin D hoạt tính |
| |
| Cân nhắc hạn chế canxi |
| ||
|
| Cắt tuyến cận giáp |
| |
| Calcimimetics |
| ||
| Lọc máu phù hợp |
| ||
| Điều chỉnh nồng độ canxi dịch lọc |
| ||
4.8.4. Bệnh xương do thận có chu chuyển xương thấp
4.8.4.1. Chẩn đoán
- Nồng độ iPTH < 100 - 150 pg/mL ở bệnh nhân BTM giai đoạn lọc máu.
- Dựa vào kết quả sinh thiết xương.
4.8.4.2. Điều trị
- Duy trì PTH trong giới hạn khuyến cáo (ở bệnh nhân lọc máu, từ 2 đến 9 lần giới hạn bình thường trên).
- Phương pháp điều trị:
+ Tránh sử dụng các chế phẩm chứa canxi,
+ Giảm hoặc ngừng sử dụng các chế phẩm vitamin D,
+ Giảm hoặc ngừng các chất gắn phosphate có chứa canxi và giảm nồng độ canxi dịch lọc (thường xuống 1,25 mmol/L).
+ Không sử dụng các thuốc có chứa nhôm.
+ Theo dõi thường xuyên PTH, canxi, phosphate, phosphatase kiềm (đặc biệt là phosphatase kiềm đặc hiệu xương).
- Một số phương pháp điều trị khác có thể cân nhắc tùy theo từng trường hợp:
+ Tối ưu hoá kiểm soát bệnh đái tháo đường
+ Thay đổi từ lọc màng bụng sang thận nhân tạo để dễ điều chỉnh canxi dịch lọc.
+ Sử dụng PTH tái tổ hợp (ví dụ: sau phẫu thuật cắt bỏ toàn bộ tuyến cận giáp) và thuốc tiêu canxi (tác nhân đối kháng với thụ thể canxi và làm tăng PTH nội sinh).
- Cung cấp quá nhiều kali: hiếm khi xảy ra ở người khỏe; thường là do dùng kali liều cao qua đường uống hoặc đường tĩnh mạch, đặc biệt khi tốc độ truyền nhanh kèm bài tiết kali chậm (điều trị bằng thuốc lợi tiểu giữ kali, suy thận)
- Dịch chuyển quá mức từ nội bào ra ngoại bào: nhiễm toan chuyển hóa, tăng dị hóa tế bào khi có phá hủy mô cấp gây giải phóng kali (hủy/tiêu cơ vân, dập cơ vân; bỏng rộng; tan máu nội mạch; ly giải khối u; xuất huyết tiêu hóa; tái phân bổ mạch máu; tăng thân nhiệt); tăng áp lực thẩm thấu máu; hoạt động thể lực nặng; một số thuốc (chẹn β không chọn lọc, ức chế hệ renin-angiotensin-aldosterone, ngộ độc digitalis, đồng vận α adrenergic, succinylcholine…)
- Giảm khả năng bài tiết qua thận: suy thận, suy thượng thận, hội chứng giảm renin- giảm aldosterone; một số thuốc (NSAIDs, Cyclosporin, Tacrolimus, Heparin, thuốc ức chế men chuyển/ức chế thụ thể Angiotensin II, ức chế renin trực tiếp, kháng aldosterone, chẹn kênh natri biểu mô…)
4.9.2.1. Lâm sàng
a. Triệu chứng tim mạch
- Các biến đổi trên điện tâm đồ xuất hiện tăng dần liên tiếp và theo mức độ nặng:
+ Sóng T cao, nhọn, đối xứng có thể vượt quá đỉnh của sóng R, được thấy rõ ở các chuyển đạo trước tim (V2 đến V4) và sau (DII và DIII);
+ Bất thường dẫn truyền trong nhĩ (sóng P giảm sau đó biến mất), rối loạn dẫn truyền nhĩ-thất (bloc xoang-nhĩ và bloc nhĩ-thất);
+ Rối loạn dẫn truyền trong thất với QRS giãn rộng;
+ Nhịp tim chậm với QRS rộng trước khi vô tâm thu.
- Rối loạn nhịp thất (nhịp thất tự phát, nhịp nhanh thất, rung thất) có thể xảy ra nếu tăng kali máu kết hợp với thiếu máu cục bộ cơ tim, hạ canxi máu nặng, hạ thân nhiệt, nhiễm toan nặng, nhiễm độc digitalis hoặc kích thích thần kinh phế vị nặng.
b. Triệu chứng thần kinh cơ
Thường không đặc hiệu: rối loạn cảm giác nông như nóng rát hoặc dị cảm ở các chi, yếu cơ hoặc thậm chí liệt mềm từ chi dưới và tiến triển lên trên, có thể lan đến cơ cổ làm mất khả năng giữ đầu thẳng. Ở thể nặng có thể ảnh hưởng đến các cơ hô hấp dẫn đến suy hô hấp. Trên thực tế, liệt mềm do tăng kali máu luôn đi kèm với bất thường trên điện tâm đồ và thông báo sắp ngừng tim.
c. Triệu chứng huyết động
Ở thể nặng tăng kali máu có ảnh hưởng đến sự co bóp của tim dẫn đến hạ huyết áp - là một dấu hiệu của tình trạng nặng.
4.9.2.2. Chẩn đoán
Bất kỳ khi nào có nghi ngờ tăng kali máu phải làm ngay ECG, điện giải đồ, đánh giá mức độ nặng để quyết định điều trị khẩn cấp. Khi có các rối loạn dẫn truyền hoặc các triệu chứng thần kinh cơ thì cần được điều trị tối khẩn cấp.
Các bước chẩn đoán nguyên nhân gây tăng kali máu:
- Loại trừ tình trạng tăng kali máu giả;
- Đánh giá lượng kali đưa vào;
- Tìm nguyên nhân gây dịch chuyển kali từ nội bào ra ngoại bào;
- Đánh giá tình trạng ly giải tế bào;
- Đo kali niệu;
- Tìm các yếu tố thúc đẩy tăng kali máu.
- Tốc độ và phương thức điều trị phụ thuộc vào tốc độ và mức độ tăng kali máu; dấu hiệu trên điện tâm đồ; tình trạng lâm sàng của bệnh nhân (dấu hiệu thần kinh cơ)
- Cần điều trị tối khẩn cấp nếu tăng kali máu trên 7 mmol/L, hoặc đặc biệt là mất sóng P và/hoặc rối loạn dẫn truyền trong thất.
- Cần giảm liều hoặc ngừng các thuốc gây tăng kali máu. Điều chỉnh chế độ ăn, hạn chế các thực phẩm giàu kali và nên tư vấn chuyên gia dinh dưỡng.
- Tăng kali máu cấp mức độ nặng > 7 mmol/L hoặc đe dọa trên ECG và không ngộ độc digitalis:
+ Tiêm canxi tĩnh mạch (ưu tiên canxi gluconate) 1g trong 2-3 phút;
+ Truyền glucose 10% TM với 10-15 IU insulin, kết hợp khí dung salbutamol;
+ Truyền Bicarbonate TM nếu nhiễm toan tăng Cl- máu (và không có phù phổi cấp): dung dịch 1,4% truyền 44 mmol mỗi 5 phút, nếu bệnh nhân phù và THA cân nhắc dùng dung dịch kiềm ưu trương 4,2 % tiêm TM chậm.
+ Khi phù phổi cấp kết hợp: furosemide TM liều cao. Khi có tắc nghẽn đường tiết niệu hoặc không đáp ứng với lợi tiểu (do suy thận thực thể) cần chỉ định lọc máu. Chống chỉ định dùng các dung dịch có chứa natri.
- Tăng kali máu cấp mức độ trung bình (từ 6-7 mmol/L), không ảnh hưởng dẫn truyền tim:
+ Truyền glucose TM 10% với 10-15 IU insulin và/hoặc khí dung salbutamol;
+ Giảm cung cấp kali (qua thức ăn và tĩnh mạch);
+ Loại bỏ các thuốc làm tăng kali máu;
+ Điều chỉnh toan chuyển hóa trung bình (natri bicarbonate uống 2-4 g/ngày);
- Tăng kali máu mạn tính vừa phải, đặc biệt trong suy thận mạn: Resine trao đổi ion như sodium polystyrene sulfonate hoặc calcium polystyrene sulfonate trao đổi ion kali để lấy ion natri/canxi ở đại tràng không chọn lọc (1-2mmol K+ /g resine) 10-15g x 2 - 3 lần/ngày; hoặc các thuốc polymer gắn Kali đường uống thế hệ mới, như muối silicate của zirconium, có thể điều chỉnh liều để duy trì nồng độ K máu trong giới hạn an toàn).
- Trường hợp ngộ độc digitalis cần điều trị sớm bằng thuốc đối kháng đặc hiệu (DIGIDOT).
- Trường hợp tăng kali máu kèm giảm aldosteron (suy thượng thận):điều trị bằng 9- fluorohydrocortisone.
4.9.3.2. Điều chỉnh rối loạn dẫn truyền cơ tim
- Tiêm canxi TM 1g trong 2 đến 3 phút (1 ống canxi gluconate 10 ml 10% hoặc 2 ống canxi chlorid 5ml 10% cho phép cải thiện các bất thường dẫn truyền tim sau 1 đến 3 phút, thời gian tác dụng tối đa từ 30 đến 60 phút. Ưu tiên canxi gluconate).
- Tiêm lặp lại sau 5 phút nếu chưa đạt hiệu quả (theo dõi điện tâm đồ).
- Chống chỉ định sử dụng canxi khi điều trị bằng digitalis (có thể thay thế bằng magie chlorid); không được trộn lẫn hoặc pha vào natri bicarbonate.
4.9.3.3. Dịch chuyển kali vào trong tế bào
- Insulin 10-15 IU kết hợp dung dịch glucose 10% (500ml) để tránh hạ đường máu, truyền TM trong 15-30 phút. Hiệu quả: làm giảm kali máu từ 0,5 đến 1,2 mmol/L trong 1-2 giờ.
- Thuốc β-adrenergic, đặc biệt là salbutamol có tác dụng cộng thêm với insulin. Liều khuyến cáo về lý thuyết gấp 4 lần so với liều điều trị hen (20 mg trong 4 ml dung dịch muối đẳng trương 0,9%, khí dung trong 10 phút).
- Kiềm hóa máu chỉ được khuyến cáo trong trường hợp nhiễm toan chuyển hóa cấp với khoảng trống anion bình thường; hiệu quả không đáng kể ở BN bị suy thận mạn tiến triển. Natri bicarbonate 50mmol truyền TM (300ml dung dịch đẳng trương 1,4%); thời gian tác dụng 4-6 giờ. Có thể cân nhắc sử dụng dung dịch ưu trương 4,2% (100ml) hoặc 8,4% (50ml) tĩnh mạch nếu BN có nguy cơ quá tải dịch hoặc phù phổi nhưng dung dịch ưu trương có nguy cơ gây tổn thương tĩnh mạch. Không được truyền bicarbonate cùng lúc với tiêm canxi.
- Thuốc lợi tiểu quai: thời gian tác dụng từ 1 đến 4 giờ, hiệu quả không hằng định. Chống chỉ định trong trường hợp mất nước ngoại bào.
- Lọc thận nhân tạo: chỉ định bắt buộc khi suy thận vô niệu kèm tăng kali máu đe dọa tính mạng có dấu hiệu điện tâm đồ, khi không đáp ứng với thuốc lợi tiểu.
- Resine trao đổi ion: sodium polystyrene sulfonate hoặc calcium polystyrene sulfonate dạng uống (15 đến 30 g mỗi 4 đến 6 giờ, tác dụng trong vài giờ); dạng thụt (50-100 g). Thuốc có nguy cơ gây các biến chứng tiêu hóa như hoại tử và thủng ruột (hay gặp ở hậu phẫu, hạ huyết áp và giảm thể tích máu làm thay đổi huyết động đường tiêu hóa và ghép thận). Polymer gắn calcium trao đổi kali thế hệ mới hoặc muối silicate của nguyên tố zirconium cũng có vai trò cố định kali ở đường tiêu hóa, các chất này gắn kali chọn lọc tại niêm mạc ruột, có thể sử dụng kéo dài. Tác dụng phụ hay gặp là táo bón, giảm magnesium, hạ kali, triệu chứng phù (đối với muối silicate của zirconium) ít gặp.
4.10. KIỂM SOÁT TOAN CHUYỂN HÓA
4.10.1. Nguyên nhân nhiễm toan chuyển hóa
Bảng 28. Phân loại cơ chế gây toan chuyển hóa
| Cơ chế | Khoảng trống anion huyết tương tăng | Khoảng trống anion huyết tương bình thường |
| Tích tụ acid cấp | • Nhiễm toan lactic • Nhiễm toan ceton • Ngộ độc acid ngoại sinh (salicylat, etylen glycol, metanol) | • Ngộ độc Clorua amoni, HCl |
| Mất bicarbonate |
| • Bệnh tiêu chảy • Nối niệu quản-ruột • Nhiễm toan ống lượn gần (type 2) |
| Giảm bài tiết acid qua thận | • Suy thận | • Nhiễm toan ống lượn xa tăng kali máu (type 4) do rối loạn sản xuất NH4+ ( do giảm aldosteron); • Nhiễm toan ống lượn xa (type 1) do rối loạn bài tiết H+ đoạn xa |
4.10.2. Chẩn đoán nhiễm toan chuyển hóa
- Rà soát các tình huống lâm sàng gợi ý:
+ Suy thận nặng, tiêu chảy nhiều, cắt đoạn ruột v.v. ;
+ Giảm bicacbonat huyết tương; tăng clo máu…
- Biểu hiện lâm sàng (không đặc hiệu):
+ Nhiễm toan cấp tính nặng: thở nhanh nông (tăng thông khí bù), suy hô hấp, cung lượng tim thấp, hôn mê;
+ Nhiễm toan mạn tính: sỏi và canxi hóa thận, teo cơ, chậm lớn, nhuyễn xương, gãy xương bệnh lý
- Các bước chẩn đoán:
Bước 1: xác định toan chuyển hóa
+ Xét nghiệm khí máu: chẩn đoán nhiễm toan khi pH máu động mạch < 7,38 (hoặc tĩnh mạch < 7,32) và HCO3- < 22 mmol/L (giảm thứ phát PCO2 do thông khí bù)
+ Lưu ý: không cần pH máu bất thường để chẩn đoán rối loạn acid-bazơ.
+ Đáp ứng bù trừ có thể được dự đoán:
+ Trong nhiễm toan chuyển hóa đơn thuần, giảm [HCO3-] làm giảm PaCO2 dự kiến, được ước tính theo công thức Winter:
PaCO2 (mmHg) dự kiến = 1,5 x [HCO3-] + 8 ± 2
Trường hợp nhiễm toan chuyển hóa kèm nhiễm toan máu, giá trị PCO2 kỳ vọng gần với giá trị của phần trăm pH (ví dụ pH là 7,32 thì PCO2 là 32mmHg).
+ Nếu PaCO2 thấp hơn hoặc cao hơn giá trị ước tính thì cần nghĩ đến rối loạn acid- bazơ hỗn hợp (nhiễm kiềm hô hấp hoặc nhiễm toan hô hấp phối hợp)
Bước 2: xác định khoảng trống anion huyết tương
+ Khoảng trống anion (TA) là chênh lệch nồng độ giữa tổng nồng độ của các cation Na+ và K+ và tổng các anion HCO3- và Cl-
TA = [Na+] - [Cl- + HCO3-] = 12 ± 4 mmol/L (hoặc 16 ± 4 nếu có tính K+)
TA > 16 mmol/L (>20mmol/L nếu có tính K+) được xem là cao.
Sự thay đổi khoảng trống anion sẽ giúp đánh giá anion Cl- hoặc các anion không định lượng được (protein huyết tương, phốt phát, sunfat và các anion hữu cơ khác) có tăng hay không, tức có mất HCO3- không.
+ Nhiễm toan với khoảng trống anion bình thường (tăng HCl): mất HCO3- qua thận hoặc tiêu hóa; giảm HCO3- được bù lại bằng tăng Cl- (tăng HCl) dẫn đến toan chuyển hóa có tăng Cl-.
+ Nhiễm toan với khoảng trống anion tăng: tăng H+ kèm với một anion không định lượng, giảm [HCO3-] được thay bằng 1 anion không định lượng được (ví dụ: lactat).
Bước 3a: Chẩn đoán nhiễm toan chuyển hóa có tăng khoảng trống anion
+ Định lượng lactate để chẩn đoán nhiễm toan tăng acid lactic. Nguyên nhân do sốc kèm thiếu oxy mô, ngộ độc thuốc biguanide.
+ Định lượng ceton máu, thử ceton niệu để chẩn đoán nhiễm toan cetone. Nguyên nhân do đái tháo đường và hiếm gặp hơn do rượu, thuốc.
+ Đánh giá chức năng thận để phát hiện nhiễm toan thứ phát do suy thận nặng (cấp hoặc mạn). Đặc điểm là khoảng trống anion tăng ít (< 26 mmol/L). Nguyên nhân do giảm thải ion H+ ở thận và tích tụ các anion không được thải qua thận (các acid hữu cơ, phosphate, sulfate…).
+ Tìm bằng chứng của ngộ độc các acid ngoại sinh: salicylate, ethylene glycol, methanol.
Bước 3b. Chẩn đoán nhiễm toan chuyển hóa có khoảng trống anion bình thường (tăng Cl-)
Nguyên nhân thường gặp là ỉa chảy, cắt đoạn ruột non… gây mất bicarbonate qua đường tiêu hóa và nhiễm toan ống thận
Chẩn đoán nhiễm toan ống thận
+ Tính khoảng trống anion niệu: TAniệu = UNa + UK - UCl
Bình thường khoảng trống anion niệu dương nhẹ.
Nếu TAniệu < 0 (nghĩa là nồng độ NH4+ niệu tăng, đáp ứng thận tốt)→nhiễm toan nguồn gốc ngoài thận (mất bicarbonate qua đường tiêu hóa).
Nếu TAniệu > 0 (nghĩa là nồng độ NH4+ niệu thấp, đáp ứng thận không phù hợp)→nhiễm toan nguồn gốc ống thận.
Bảng 29. Phân loại toan chuyển hóa với khoảng trống anion bình thường
|
| Ỉa chảy | Nhiễm toan do ống thận | ||
| Ống lượn gần (type 2) | Ống lượn xa (type 1) | Ống lượn xa có tăng kali máu | ||
| Cơ chế và khiếm khuyết | Mất HCO3- qua đường tiêu hóa | Mất HCO3- do khiếm khuyết tái hấp thu ở ống lượn gần | Rối loạn sự toan hóa ở ống lượn xa do tiết H+ bởi bơm proton bất thường (rối loạn bài tiết) hoặc bởi tái phân bố H+ (rối loạn chênh lệch áp lực) | Rối loạn sản xuất NH4+ do giảm aldosterone là hay gặp nhất |
| NH+ niệu | ↑↑↑ | ↓ | ↓↓↓ | ↓↓↓ |
| TA niệu | << 0 | Ít thay đổi hoặc dương nhẹ | > 0 | >> 0 |
| Các dấu hiệu đi kèm |
| - Hội chứng Fanconi - Thiểu xương | - Nhiễm canxi nhu mô thận - Thiểu xương kèm sỏi thận, rối loạn gen (điếc) | Các dấu hiệu giảm mineralocorticoid |
| Nguyên nhân |
| - Đa u tủy xương - Bệnh lý lắng đọng Cystin - Acetazolamide - Ifosfamide - Tenofovir | Rối loạn bài tiết: - Sjögren, lupus. - Tăng canxi niệu - Bệnh hồng cầu hình liềm. Rối loạn chênh lệch áp lực: - Amphotericin B | - Bệnh thận tắc nghẽn - Giảm renin, giảm aldosterone (ĐTĐ) - ƯCMC/ức chế thụ thể, NSAIDs. - Spironolactone, amiloride - Suy thượng thận - Heparine - Thuốc CNI - Trimethoprime - Pentamidine |
|
| Ỉa chảy | Nhiễm toan do ống thận | ||
|
|
| Ống lượn gần (type 2) | Ống lượn xa (type 1) | Ống lượn xa có tăng kali máu |
| Tần suất (người | Hay gặp | Hiếm | Hiếm | Hay gặp |
| Kali máu | Thấp | Thấp, nặng hơn khi bù kiềm | Thấp cải thiện khi bù kiềm | Tăng |
| pH niệu | < 5,5 | Thay đổi, < 5,5 trong tình trạng ổn định | > 5,5 | < 5,5 (thấp theo từng cá nhân) |
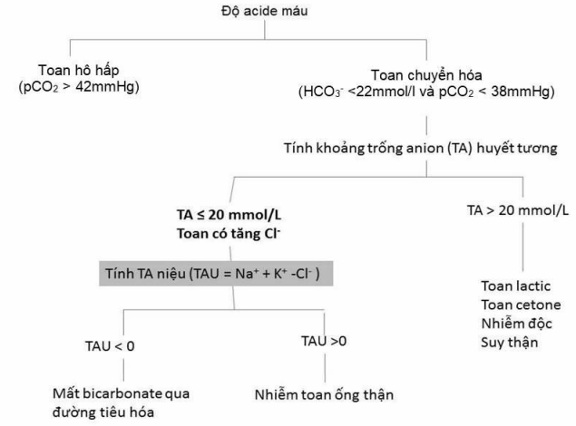
Hình 2. Sơ đồ chẩn đoán nhiễm toan máu
4.10.3. Điều trị toan chuyển hóa
4.10.3.1. Toan chuyển hóa cấp tính
Xử trí cấp cứu nếu pH < 7,10 hoặc bicarbonate < 8 mmol/L.
- Điều trị nguyên nhân, đặc biệt là với nhiễm toan lactic trước tiên cần cải thiện tình trạng tưới máu mô, phối hợp giải quyết tốt nguyên nhân.
- Loại bỏ CO2 bằng thông khí nhân tạo, điều chỉnh lưu lượng thấp.
- Kiềm hóa:
+ Nhiễm toan tăng Cl- hoặc nhiễm toan liên quan đến một số ngộ độc: truyền TM natri bicarbonate để nhanh chóng tăng độ pH > 7,20 và bicarbonate > 10 mmol/L:
● lượng HCO3- (mmol) = {[ HCO3-]mong muốn - [HCO3-]đo được} x 0,5 x trọng lượng (tính bằng kg);
● tránh kiềm hóa trong trường hợp quá tải muối nước và/hoặc hạ kali máu.
+ Nhiễm toan ceton: phối hợp insulin và bù đủ dịch muối sinh lý,
- Lọc máu ngoài thận nếu có suy thận thực thể kèm theo để tránh quá tải muối nước
4.10.3.2. Nhiễm toan mạn tính có nguồn gốc từ thận
- Nhiễm toan ống lượn gần và nhiễm toan ống lượn xa type 1: muối kiềm (dưới dạng citrate natri hoặc citrate kali tùy theo dạng bất thường chiếm ưu thế) để ngăn tạo sỏi.
- Nhiễm toan ống thận tăng kali máu: resine trao đổi ion (sodium polystyrene sulfonate hoặc calcium polystyrene sulfonate, các thuốc gắn kali mới), furosemide và fludrocortisone khi suy thượng thận.
- Suy thận: duy trì nồng độ bicarbonate huyết tương > 22 mmol/L bằng cách uống natri bicarbonate (1 đến 6 g mỗi ngày)
4.11. KIỂM SOÁT TỔN THƯƠNG THẬN CẤP TRONG BTM
Bệnh nhân BTM có nguy cơ bị tổn thương thận cấp (TTTC) cao (đợt cấp của BTM). TTTC xảy ra trên BN bị BTM sẽ làm tăng tốc độ tiến triển của BTM.
Tiêu chuẩn chẩn đoán TTTC trên BN bị BTM: có ít nhất 1 trong 3 điều kiện sau:
- Tăng Creatinine máu trên 0,3 mg/dL (26,5 μmol/L) so với nồng độ creatinine nền trong vòng 2 ngày (48 giờ);
- Tăng Creatinine máu trên 50% so với nồng độ creatinine nền trong vòng 7 ngày;
- Lưu lượng nước tiểu < 0,5 ml/kg/h trong 6 giờ.
4.11.2.1. Nguyên nhân trước thận:
- Mất nước ngoại bào (mất qua da ví dụ mất mồ hôi, bỏng rộng; mất qua đường tiêu hoá ví dụ nôn, tiêu chảy, lỗ rò; mất qua thận);
- Giảm thể tích máu (trong HCTH nặng, xơ gan mất bù, suy tim xung huyết);
- Tụt huyết áp trong các tình trạng sốc (sốc tim, nhiễm trùng, phản vệ, xuất huyết);
- Tình trạng rối loạn cơ chế tự điều hòa huyết động tại thận do thuốc (ƯCMC, ƯCTT angiotensin II, các NSAID, CNI).
4.11.2.2. Nguyên nhân tại thận
- Viêm/hoại tử ống thận cấp (chiếm 80% các trường hợp suy thận cấp thực thể) và thường là chuyển từ suy thận cấp chức năng; ngoài ra có thể do sốt rét đái huyết sắc tố, ngộ độc mật cá trắm, ngộ độc muối kim loại nặng (As, Pb, Hg), tan máu trong lòng mạch do truyền nhầm nhóm máu, nhiễm độc quinine, nấm, 1 số loại thuốc (kháng sinh Aminosides, kháng nấm Amphotericine B), thuốc cản quang.
- Viêm cầu thận cấp thể tiến triển nhanh, VCT hoại tử và ngoại mạch trong bệnh cảnh viêm mạch hoại tử, VCT tăng sinh nội mạch và ngoại mạch trong bệnh cảnh lupus, ban xuất huyết dạng thấp, VCT thể tiến triển nhanh trong hội chứng Goodpasture.
- Viêm kẽ thận cấp do vi khuẩn (viêm thận bể thận cấp), ngộ độc thuốc (bệnh cảnh miễn dịch-dị ứng).
4.11.2.3. Nguyên nhân sau thận
- Sỏi
- Khối u chèn ép hoặc xâm lấn (u lành tính hoặc ác tính, trong đường tiết niệu hoặc từ ngoài đường tiết niệu): phì đại tuyến tiền liệt, ung thư tuyến tiền liệt; u đường bài xuất, bàng quang, tử cung, cổ tử cung, đại trực tràng; u lympho
- Dải xơ sau phúc mạc
- Lao
- Một số nguyên nhân khác: tắc ống thận, máu cục, thắt nhầm niệu quản, dị vật, bàng quang thần kinh, sa cơ quan sinh dục…
Diễn biến lâm sàng điển hình của TTTC gồm 4 giai đoạn:
Giai đoạn khởi đầu diễn tiến tùy theo nguyên nhân, cần chủ động rà soát các yếu tố nguy cơ (ngộ độc, thuốc, nhiễm trùng…).
Giai đoạn thiểu niệu, vô niệu
Thiểu niệu khi lượng nước tiểu < 500ml/24 giờ (hoặc dưới 20ml / giờ, hoặc < 0,5ml/kg/h), vô niệu khi lượng nước tiểu < 100ml/24 giờ.
Giai đoạn này kéo dài trung bình 1-2 tuần. Nếu thiểu niệu kéo dài trên 4 tuần cần tìm tình trạng hoại tử vỏ thận, viêm cầu thận cấp thể tiến triển nhanh, viêm quanh tiểu động mạch thận, sỏi gây tắc niệu quản.
Biểu hiện trong giai đoạn này chủ yếu là hội chứng ngộ độc urê cấp; thừa dịch gây THA, phù và nguy cơ phù phổi cấp; rối loạn điện giải đặc biệt là tăng Kali máu; rối loạn thăng bằng kiềm toan; đi kèm triệu chứng của bệnh lý nguyên nhân.
Giai đoạn có lại nước tiểu/tiểu nhiều
Nước tiểu xuất hiện lại và tăng dần. Tiểu nhiều dễ gây rối loạn nước-điện giải, trụy tim mạch, nhiễm trùng, viêm tắc tĩnh mạch, nhất là dị hoá gây mất cơ, và có thể tử vong. Trong những ngày đầu urê, creatinine máu có thể tiếp tục tăng và một số BN có thể vẫn cần được lọc máu hỗ trợ; urê, creatinine niệu vẫn thấp; tỷ trọng nước tiểu thấp, thường dưới 1,005. Sau vài ngày tiểu nhiều các chỉ số sinh hoá máu mới bắt đầu giảm dần. Cần xét nghiệm điện giải hằng ngày để điều chỉnh kịp thời.
Giai đoạn phục hồi
Urê, creatinine máu giảm dần, khả năng cô đặc nước tiểu tăng dần, lâm sàng tốt lên. Chức năng thận có thể phục hồi chậm, khả năng cô đặc có khi phải hàng năm mới hồi phục. Mức lọc cầu thận phục hồi nhanh hơn.
Nếu được phát hiện ở giai đoạn sớm và/hoặc nếu mức độ tổn thương không quá nặng, tổn thương thận cấp có thể không biểu hiện dưới dạng điển hình qua 4 giai đoạn mô tả ở trên. Tổn thương thận cấp xuất hiện trên nền BTM cũng có đặc điểm lâm sàng tương tự, nhưng các tình trạng toan máu, tăng kali máu, quá tải thể tích, hạ canxi máu/tăng photphat máu, hạ natri máu, hội chứng ngộ độc urê thường xuất hiện sớm hơn và có mức độ nặng hơn.
Xét nghiệm máu
- Các BN có yếu tố nguy cơ cần chủ động xét nghiệm urê và creatinin máu 2 ngày 1 lần hoặc ít nhất 2 lần trong vòng 7 ngày, tính tỷ lệ ure máu/creatinin máu, tỷ lệ > 20/1 chỉ điểm tình trạng tăng tái hấp thu urê (thường do giảm thể tích máu).
- Tìm nguyên nhân gây TTTC:
+ Công thức máu, phiến đồ máu ngoại vi: tìm nhiễm trùng, mất máu cấp/mạn, bệnh lý vi mạch huyết khối… Mảnh vỡ hồng cầu trong máu ngoại vi gợi ý hội chứng tan máu do urê máu hay ban xuất huyết giảm tiểu cầu huyết khối.
+ Tìm các chỉ dấu của nhiễm trùng, Lupus, viêm mạch, viêm cầu thận cấp tiến triển nhanh: định lượng bổ thể, kháng thể Lupus, ANCA, kháng thể kháng màng đáy, PLAR2, bệnh tự miễn khác, CRP, procalcitonin, xét nghiệm huyết thanh học ký sinh trùng, virus…
- Đánh giá mức độ tổn thương: dựa vào tốc độ tăng của urê/creatinine, kali máu; các rối loạn điện giải và thăng bằng kiềm toan kèm theo.
Xét nghiệm nước tiểu
- Tế bào và cặn lắng nước tiểu giúp chẩn đoán tổn thương thận.
- Tính phân suất bài tiết Na và Ure: Phân suất bài tiết Na < 1% giúp chẩn đoán phân biệt suy thận cấp trước thận hay tại thận, nhưng bị ảnh hưởng bởi thuốc lợi tiểu. Phân suất bài tiết urê <35% gợi ý suy thận trước thận và không bị ảnh hưởng bởi thuốc lợi tiểu.
- Một số chỉ dấu sinh học nước tiểu để phát hiện tổn thương ống thận sớm hoặc đánh giá nguy cơ tiến triển TTTC như NGAL, KIM-1, L-FABP, insulin-like growth factor binding protein 7, ức chế metalloproteinase có thể được cân nhắc nếu sẵn có.
Chẩn đoán hình ảnh
- Siêu âm bụng: tìm tắc nghẽn đường tiết niệu và gợi ý bệnh thận mạn.
- Siêu âm Doppler động mạch thận
- hụp mạch thận để chẩn đoán bệnh mạch máu thận.
Sinh thiết thận: xác định nguyên nhân tổn thương tại thận trong tổn thương thận cấp/đợt cấp trên BTM và đánh giá đáp ứng điều trị khi có chỉ định.
Test Furosemide áp lực (furosemide stress test): Tiêm tĩnh mạch furosemide 1-1,5mg/kg và theo dõi lượng nước tiểu sau đó 2h. Nếu lượng nước tiểu <200ml thì bệnh nhân có nguy cơ tiến triển thành tổn thương thận cấp giai đoạn 3. Áp dụng cho BN có TTTC giai đoạn sớm và có thể tích máu ổn định. Đáp ứng với test có thể giúp xác định thời điểm cần điều trị thay thế thận suy
Hiện nay, tiêu chuẩn chẩn đoán và phân độ/giai đoạn cập nhật nhất và thường được áp dụng nhất là của KDIGO năm 2012. Một số tiêu chuẩn khác có thể được tham khảo như RIFLE và AKIN (hay còn gọi là tiêu chuẩn RIFLE điều chỉnh).
Tiêu chuẩn chẩn đoán TTTC của KDIGO 2012:
Tổn thương thận cấp được chẩn đoán xác định khi bệnh nhân có ít nhất một trong các biểu hiện sau:
Bảng 30. Tiêu chuẩn tổn thương thận cấp theo KDIGO 2012
| Phân độ KDIGO | Tiêu chuẩn tăng creatinin máu | Tiêu chuẩn về lưu lượng nước tiểu |
| Giai đoạn 1 | ↑ Creatinin máu ≥ 0,3 mg/dL (≥ 26,5 μmol/L) trong vòng 48 giờ hoặc ↑ Creatinin máu gấp 1,5-1,9 giá trị nền trong vòng 7 ngày | < 0,5 ml/kg/giờ trong 6 - 12 giờ liên tục |
| Giai đoạn 2 | ↑ Creatinin máu gấp 2 – 2,9 lần | < 0,5 ml/kg/giờ trong ≥ 12 giờ |
| Giai đoạn 3 | ↑ Creatinin máu gấp ≥ 3 lần hoặc ↑ Creatinin máu đến mức ≥ 4mg/dL (≥ 353,6 μmol/L) hoặc BN phải điều trị thay thế thận hoặc ↓ MLCT tới < 35mL/ph/1,73m2 ở BN < 18 tuổi | < 0,3 ml/kg/giờ trong ≥ 24 giờ hoặc vô niệu trong ≥ 12 giờ |
4.11.6.1. Nguyên tắc kiểm soát TTTC ở bệnh nhân BTM
- Xác định nguyên nhân gây TTTC ở BN BTM và điều trị sớm nguyên nhân.
- Ngừng tất cả các thuốc gây độc cho thận hoặc điều chỉnh liều phù hợp với chức năng thận trong trường hợp sống còn. Cân nhắc ngừng các loại thuốc ức chế hệ RAA (thuốc ức chế men chuyển và thuốc ức chế thụ thể angiotensin II)
- Đảm bảo huyết động ổn định, đủ dịch.
- Xử lý kịp thời và đầy đủ các biến chứng của TTTC (tăng kali máu, toan máu, quá tải thể tích).
- Nhanh chóng xem xét lọc máu nếu điều trị nội khoa không hiệu quả.
Điều trị TTTC ở bệnh nhân BTM cũng giống như điều trị TTTC nói chung, cần lưu ý đặc biệt các rối loạn cấp tính gồm: Toan máu; Tăng kali máu; Quá tải thể tích; Hạ canxi máu; Hạ natri máu; Hội chứng tăng Urê máu.
4.11.6.2. Điều trị cụ thể tổn thương thận cấp
a. Tổn thương thận cấp chức năng
- Khôi phục thể tích tuần hoàn bằng dung dịch điện giải, máu, huyết tương cho phần lớn các nguyên nhân trước thận, thường dùng dung dịch tinh thể (như muối đẳng trương 0,9%); chỉ truyền máu khi mất máu cấp gây TTTC chức năng.
- Cân nhắc dùng thuốc vận mạch nếu tụt HA cho các trường hợp TTTC chức năng.
- Không khuyến cáo sử dụng Dopamin liều thấp với mục đích giãn mạch tạng để dự phòng và điều trị TTTC.
b. Tổn thương thận cấp thực thể
- Khi vô niệu cần ăn nhạt hoàn toàn, kiểm soát lượng dịch vào (cả dịch truyền và uống) mỗi ngày không quá 700ml ở người trung bình 50kg, không để tăng cân.
- Khi thừa dịch và không tắc nghẽn đường tiết niệu: tiêm TM Furosemid liều 120-160mg mỗi 3 - 4 giờ, liều tối đa có thể đến 1000mg-1500 mg/24h. Nếu dùng đủ liều tối đa trong ngày mà vẫn không có nước tiểu thì ngừng. Không khuyến cáo dùng Furosemid để điều trị dự phòng TTTC.
- Khi có tăng K máu: tham khảo hướng dẫn cụ thể ở phần “Tăng Kali máu”
- Khi có toan chuyển hoá: tham khảo hướng dẫn cụ thể ở phần “Toan chuyển hóa”.
- Điều trị lọc máu ngoài thận khi điều trị nội khoa không hiệu quả
- Theo dõi sát lưu lượng nước tiểu và tình trạng bệnh nhân ở giai đoạn tiểu nhiều để bù dịch và điện giải.
c. Tổn thương thận cấp sau thận
TTTC sau thận còn gọi là TTTC do tắc nghẽn. Điều quan trọng nhất là loại bỏ yếu tố gây tắc nghẽn.
d. Điều trị nguyên nhân
Tùy từng nguyên nhân để có điều trị phù hợp, ví dụ điều trị sốt rét trong suy thận cấp sau sốt rét đái Hemoglobin; mổ lấy sỏi trong suy thận cấp do sỏi gây tắc nghẽn...
4.12. KIỂM SOÁT VIÊM GAN VIRUS B, C Ở BỆNH NHÂN BTM
4.12.1.1. Sàng lọc viêm gan virus B
Khuyến cáo sàng lọc virus viêm gan B cho mọi BN bị BTM không biết tình trạng nhiễm, chưa được xét nghiệm trước đó, chưa được tiêm vaccin khi còn nhỏ với các test HBsAg, anti-HBc, anti-HBs.
Bảng 31. Ý nghĩa các xét nghiệm sàng lọc nhiễm virus viêm gan B
| Xét nghiệm sàng lọc | Giải nghĩa | Xử trí | Quyết định tiêm vaccin | ||
| HBsAg | Anti- HBc | Anti- HBs | |||
| + | + | - | Viêm gan B mạn | Cần XN thêm và cần xử trí | Không |
| - | + | + | Nhiễm viêm gan B cũ, đã khỏi | Không cần xử trí thêm trừ người suy giảm miễn dịch, đang phải điều trị hóa chất hay thuốc ức chế miễn dịch | Không |
| - | + | - | Nhiễm viêm gan B cũ, đã khỏi hoặc dương tính giả | XN HBV-DNA nếu BN suy giảm miễn dịch | Có, nếu không đến từ vùng dịch tễ trung bình hoặc cao |
| - | - | + | Người có miễn dịch | Không cần XN thêm | Không |
| - | - | - | Người chưa nhiễm hoặc không có miễn dịch | Không cần XN thêm | Có |
Bảng 32. Tiêu chuẩn chẩn đoán các thể bệnh nhiễm viêm gan virus B mạn
| Thể bệnh | HBsAg | HBV-DNA | HBeAg | AST, ALT | Sinh thiết gan |
| Viêm gan B mạn | (+) ≥ 6 tháng | (+/-) | (+/-) | Bình thường hoặc tăng | Viêm gan mạn kèm viêm hoại tử và xơ hóa |
| Viêm gan B mạn dung nạp miễn dịch | (+) ≥ 6 tháng | (++) | (+) | Bình thường hoặc tăng | Viêm tối thiểu, xơ hóa ít |
| Viêm gan B mạn hoạt động miễn dịch | (+) ≥ 6 tháng | >20.000UI/ml | (+) | Tăng | Viêm gan mạn kèm viêm hoại tử vừa hoặc nặng Xơ hóa (+/-) |
| >2.000UI/ml | (-) | ||||
| Viêm gan B mạn không hoạt động | (+) ≥ 6 tháng | <2.000UI/ml | (-) Anti Hbe (+) | Bình thường | Viêm hoại tử (-) Xơ hóa (+/-) |
- Các tình trạng khác:
+ Tái hoạt HBV: mất kiểm soát miễn dịch kháng HBV ở người có HBsAg (+), anti- HBc (+) hoặc HBsAg (-), anti-HBc (+) đang điều trị thuốc ức chế miễn dịch; tăng HBV-DNA so với chỉ số nền (hoặc phát hiện được HBV-DNA ở người trước đó dưới ngưỡng phát hiện); chuyển đổi huyết thanh từ HBsAg (-) sang (+) đối với người có HBsAg (-) và anti-HBc (+)
+ Cơn viêm gan cấp: tăng ALT gấp ≥ 3 lần so với chỉ số nền và > 100UI/l
+ Viêm gan kèm HBV: tái hoạt HBV và cơn viêm gan cấp
+ Mất HBeAg: không còn HBeAg ở người trước đó có HBeAg (+)
+ Chuyển đổi huyết thanh HBeAg: mất HBeAg và xuất hiện anti-HBe ở người trước đó có HBeAg (+) và anti-HBe (-)
+ Đảo ngược huyết thanh HBeAg: HBeAg (+) lại ở người trước đó có HBeAg (-)
+ Viêm gan virus B đã khỏi: mất HBsAg bền vững ở người trước đó có HBsAg (+), HBV-DNA dưới ngưỡng phát hiện, không có bằng chứng lâm sàng và mô học về nhiễm virus hoạt động
+ Virus đột phá: tăng HBV-DNA >1 log10 (10 lần) từ chỉ số thấp nhất trong quá trình điều trị ở người đã có đáp ứng virus học với điều trị lúc khởi đầu và tuân thủ điều trị tốt.
4.12.1.2. Tư vấn cho người có HBsAg dương tính
- Tiêm vaccin cho những người trong gia đình và bạn tình của họ;
- Sử dụng các biện pháp tình dục an toàn khi quan hệ tình dục với người chưa tiêm vaccin hay chưa có miễn dịch tự nhiên;
- Không dùng chung các vật dụng cá nhân như bàn chải răng, dao cạo râu,…
- Không dùng chung bơm kim tiêm, thiết bị thử đường máu;
- Băng kín các vết cắt hay sước da;
- Làm sạch các vết máu bằng dung dịch khử trùng
- Không hiến máu, tinh trùng
- Người đã nhiễm virus viêm gan B có HBsAg âm tính và anti-HBc dương tính không mang nguy cơ truyền bệnh
- Phụ nữ mang thai có viêm gan B mạn cần được tư vấn các biện pháp phòng ngừa lây truyền từ mẹ sang con, nhất là người có tải lượng HBV-DNA cao (≥ 7 log phiên bản/ml). Khi có HBV-DNA > 200.000UI/ml ở giai đoạn 3 tháng thứ hai cần xem xét chỉ định điều trị. Những người chưa được điều trị bao giờ hoặc ngừng điều trị ở thời điểm sinh hay ngay sau sinh cần được theo dõi sát trong vòng 6 tháng sau sinh để phát hiện đợt viêm gan cấp và chuyển đổi huyết thanh. Cần theo dõi định kỳ dài hạn sau đó để đánh giá thời điểm cần điều trị sau này. Bạn tình của những phụ nữ nhiễm HBV khi mang thai cần được dánh giá tình trạng nhiễm hoặc miễn dịch chống lại HBV, và cần được tiêm vaccin nếu phù hợp. Việc nuôi con bằng sữa mẹ không bị cấm.
4.12.1.3. Điều trị viêm gan B cho người BTM
Các thuốc Nucleotide/Nucleoside analog (NA) là nền tảng để điều trị viêm gan virus B.
- Chỉ định điều trị cho viêm gan virus B đơn độc:
+ Khi có biểu hiện viêm gan cấp có triệu chứng hoặc nguy cơ nặng, với bilirubin toàn phần >3mg/dL; bilirubin trực tiếp >1,5mg/dL, INR >1,5, bệnh não gan, hoặc cổ trướng;
+ Viêm gan virus B mạn hoạt động miễn dịch với ALT ≥ 2 lần ngưỡng trên của bình thường hoặc có bằng chứng bệnh rõ rệt trên mô học và tăng HBV-DNA trên 2.000UI/ml với HBeAg (-) hoặc trên 20.000UI/ml với HBeAg (+);
+ Khi có tổn thương nặng trên sinh thiết hoặc test không xâm lấn, có xơ gan với HBV-DNA >2.000UI/ml và ALT bất kỳ
+ Cân nhắc cho người tuổi >40, có ALT<2 lần ngưỡng trên của bình thường và HBV-DNA ≤2.000UI/ml nếu HBeAg (-) hoặc HBV-DNA ≤ 20.000UI/ml nếu HBeAg (+), có tiền sử gia đình bị xơ gan hoặc ung thư tế bào gan (HCC), tiền sử điều trị trước đây với peg-IFN có đáp ứng sau khi ngừng điều trị (đáp ứng trễ), có tiền sử phơi nhiễm với NA là nguy cơ kháng thuốc, có tổn thương ngoài gan (chỉ định điều trị không phụ thuộc mức độ nặng của tổn thương gan), có xơ gan.
+ Cho người >40 tuổi có ALT bình thường và tăng HBV-DNA (1.000.000UI/ml), tiêu bản sinh thiết gan cho thấy tổn thương mô học là viêm hoại tử và xơ hóa đáng kể.
+ Người có tải lượng HBV-DNA thấp (<2.000UI/ml) dưới tác dụng của entecavir hoặc tenofovir cần tiếp tục điều trị một thuốc với bất kỳ ALT nào. Nếu có tình trạng virus đột phá, có thể chọn lựa hoặc đổi sang một thuốc khác có hàng rào kháng thuốc cao, hoặc bổ sung thuốc kháng virus thứ hai không bị kháng chéo.
Thuốc ưu tiên lựa chọn là entecavir, TDF hoặc TAF, điều trị đến khi HBsAg (-), hoặc vô thời hạn nếu BN được ghép gan. Tất cả các thuốc NA trừ TAF đều phải chỉnh liều khi MLCT <50ml/phút. Các hội chuyên ngành gan mật và truyền nhiễm đều khuyến cáo điều trị vô thời hạn trừ khi có lý lẽ đủ mạnh để ngừng điều trị.
- Viêm gan virus B và D đồng thời: tùy theo tải lượng HBV-DNA và HDV-RNA để quyết định điều trị bằng NA đơn độc, peg-IFN đơn độc hay phối hợp cả hai.
Điều trị viêm gan virus D mạn bằng interferon alfa (IFN-α). Peg- IFN-α-2a liều 180µg/tuần hoặc -2b liều 1,5 µg/kg/tuần trong 12 tháng được phê duyệt, thuốc nào có hiệu quả hơn còn chưa rõ. Điều trị thành công là khi tải lượng HDV-RNA dưới ngưỡng phát hiện ở thời điểm 24 tuần sau hoàn tất liệu trình. Khi có tăng tải lượng HBV-DNA, có thể phối hợp với thuốc NA (entecavir, tenofovir TDF hay TAF). Cần lưu ý viêm gan virus D hay tái phát nên cần theo đếm lại tải lượng virus khi có tăng men gan.
- Viêm gan virus B và C đồng thời: đo tải lượng HBV-DNA và HCV-RNA. Chỉ định điều trị viêm gan virus C nếu phát hiện HCV-RNA. Chỉ định điều trị viêm gan virus B phụ thuộc tải lượng HBV-DNA và ALT. Những bệnh nhân bị viêm gan virus B đáp ứng tiêu chuẩn điều trị cần được điều trị đồng thời với thuốc kháng virus tác động trực tiếp (DAA). Thuốc được ưu tiên lựa chọn là entecavir, TDF hoặc TAF. Bệnh nhân cũng cần được điều trị khi có tái hoạt HBV. Điều trị loại virus này sẽ thay đổi sự hoạt động của loại virus kia, nên cần theo dõi HBV-DNA trong và sau điều trị viêm gan virus C (mỗi 4-8 tuần trong khi điều trị cho đến hết 3 tháng sau kết thúc liệu trình) để đánh giá sự hoạt động của virus. Cần theo dõi HBV-DNA cho cả những người có ALT không giảm về bình thường trong và sau điều trị.
- Viêm gan virus B ở người suy giảm miễn dịch: khuyến cáo bắt đầu điều trị dự phòng viêm gan virus B cho người có HBsAg (+) trước khi bắt đầu (thông thường 1 tuần) điều trị thuốc ức chế miễn dịch hoặc hóa chất độc tế bào. Người có HBsAg (-) và anti-HBc (+) có nguy cơ thấp hơn nên có thể lựa chọn hoặc điều trị dự phòng hoặc theo dõi (đo tải lượng HBV-DNA mỗi 1-3 tháng) rồi khi có dấu hiệu tái hoạt HBV đầu tiên mới điều trị. Khi đó, sau khi kết thúc liệu trình điều trị HBV BN cần được theo dõi tiếp thêm 12 tháng. Tuy nhiên, những người sẽ được dùng thuốc nhắm đích vào tế bào lympho B nên được điều trị dự phòng. Thuốc được ưu tiên sử dụng là entecavir hoặc tenofovir. Thời gian điều trị dự phòng là 6-12 tháng cho những người sử dụng thuốc ức chế miễn dịch có thời hạn. Chưa rõ thời gian điều trị dự phòng tối ưu cho người cần điều trị ức chế miễn dịch dài hạn.
- Bệnh nhân viêm gan virus B kháng thuốc: virus đột phá có thể do sự không tuân thủ điều trị. Virus có thể có tình trạng kháng chéo với các thuốc NA khác. Để phòng ngừa tình trạng kháng thuốc, cần chọn lựa các thuốc có hàng rào cao với kháng thuốc và tăng cường sự tuân thủ của BN.
- Bệnh nhân có xơ gan: người xơ gan có HBV-DNA thấp (<2.000UI/ml) cần được điều trị thuốc kháng virus bất kể chỉ số ALT nào. Thuốc được ưu tiên là Tenofovir và entecavir, thời gian điều trị suốt đời. Bệnh nhân xơ gan mất bù cần được điều trị không phụ thuộc vào tải lượng HBV-DNA, tình trạng HBeAg hay nồng độ ALT với thuốc khuyến cáo là entecavir và tenofovir. Peg-IFN không được sử dụng cho người có xơ gan mất bù.
- Bệnh nhân ghép tạng (không phải gan): người có HBsAg (+) được ghép tạng (không phải gan) cần được điều trị thuốc kháng virus dự phòng suốt đời hoặc phải điều trị tình trạng tái hoạt HBV sau ghép. Tenofovir (TAF, TDF) và entecavir là thuốc được ưu tiên do có tỷ lệ kháng thuốc thấp khi sử dụng dài hạn. Cần theo dõi sự tái hoạt của HBV nếu không có điều trị dự phòng. Ngoài ra, nên cân nhắc điều trị kháng virus trong 6-12 tháng đầu tiên sau ghép do đây là giai đoạn ức chế miễn dịch mạnh nhất. Người có HBsAg(-), anti-HBc (+) nhận tạng (khác gan) từ người hiến có anti-HBc (+) cần được theo dõi nhiễm HBV mà không phải điều trị dự phòng. Người nhận tạng (khác gan) không được điều trị và chỉ được theo dõi sự tái hoạt của virus cần phải xét nghiệm ALT và HBV-DNA 3 tháng 1 lần trong năm đầu sau ghép hay sau điều trị triệt tiêu tế bào T (ví dụ globulin antithymocyte-ATG).
- Phụ nữ mang thai có HBsAg (+) và HBV-DNA >200.000UI/ml nên được điều trị bằng thuốc kháng virus để giảm nguy cơ truyền bệnh cho con khi sinh. TDF là thuốc được ưu tiên lựa chọn. Bắt đầu ở tuần thai 28-32, ngừng điều trị trong khoảng từ khi sinh đến 3 tháng sau sinh. Sau khi ngừng điều trị cần theo dõi ALT 3-6 tháng 1 lần.
Bảng 33. Lựa chọn thuốc kháng virus trong điều trị VGB kháng thuốc
| Kháng thuốc phát hiện bằng test định týp gen | Chiến lược đổi thuốc (được ưu tiên) | Chiến lược bổ sung: 2 thuốc không có kháng chéo |
| Kháng lamivudine | Tenofovir* (TDF hoặc TAF) | Tiếp tục lamivudin, thêm tenofovir (TDF hoặc TAF) (hoặc thay bằng emtricitabine-tenofovir) |
| Kháng telbivudine | Tenofovir* (TDF hoặc TAF) | Tiếp tục telbivudine, thêm tenofovir (TDF hoặc TAF) |
| Kháng adefovir | Entecavir hoặc Tenofovir* (TDF hoặc TAF) | Tiếp tục adefovir, thêm entecavir |
| Kháng entecavir | Tenofovir* (TDF hoặc TAF) | Tiếp tục entecavir, thêm tenofovir (TDF hoặc TAF) hoặc thay bằng emtricitabine-tenofovir |
| Kháng tenofovir | Entecavir* | Tiếp tục tenofovir (TDF hoặc TAF), thêm entecavir |
| Đa kháng | Tenofovir | Phối hợp tenofovir (TDF hoặc TAF) và entecavir* |
* Hiệu quả của việc đổi sang thuốc kháng virus có hàng rào di truyền cao với kháng thuốc so với bổ sung 2 thuốc không có kháng chéo là tương tự trong thời gian theo dõi tới 5 năm. Do đó, đổi thuốc là chiến lược được ưu tiên trừ khi HBV là đa kháng.
Bảng 34. Liều thuốc nucleoside analogues (NA) điều trị viêm gan B mạn
| Thuốc | MLCT (ml/phút) | |||
| ≥ 50 | 30-49 | 10-29 | <10, lọc máu | |
| Entecavir | Không cần chỉnh liều; 0,5mg/ngày | 0,5mg/2 ngày | 0,5mg/3 ngày | 0,5mg/7 ngày |
| Tenofovir | Không cần chỉnh liều |
|
| BN chưa lọc máu: thiếu dữ liệu |
| TDF | 300mg/ngày | 300mg/2 ngày | 300mg/3-4 ngày | Chỉ cho BN TNT: 300mg/7 ngày |
| TAF | 25mg/ngày | 25mg/ngày | 25mg/ngày | 25mg/ngày |
* Cần cân nhắc nguy cơ và lợi ích cho BN có rối loạn chức năng thận ngay cả khi có chỉnh liều theo khuyến cáo.
Cần theo dõi creatinine máu, phospho, đường niệu, protein niệu định kỳ (tối thiểu hàng năm và dày hơn nếu BN có nguy cơ bị rối loạn chức năng thận cao hơn hoặc đã có tổn thương thận từ trước). Người dùng TAF có tỷ lệ biến chứng xương và chức năng thận thấp hơn so với TDF.
- Người mắc viêm gan virus B mạn không điều trị cần được theo dõi và đánh giá định kỳ. Người có HBeAg (+) và ALT bình thường: cần làm xét nghiệm ALT mỗi 3-6 tháng; nếu ALT tăng cần làm thêm HBV-DNA thường xuyên hơn. Kiểm tra HBeAg mỗi 6-12 tháng. Người có HBeAg (+), HBV-DNA >20.000UI/ml và ALT <2 lần ngưỡng trên của bình thường: cần đánh giá mức độ tổn thương mô học, nhất là người >40 tuổi nhiễm HBV từ tuổi trẻ. Có thể sinh thiết gan hoặc làm test không xâm lấn đo độ đàn hồi gan, hoặc chỉ dấu về tình trạng xơ hóa gan (như FIB-4, FibroTest). Người có HBeAg (-), HBV-DNA >2.000UI/ml và ALT tăng dưới 2 lần ngưỡng trên của bình thường: cần đánh giá mức độ nặng bệnh, nhất là người >40 tuổi và nhiễm HBV từ tuổi trẻ bằng sinh thiết hoặc các phương pháp không xâm lấn. Người có HBeAg (-), HBV-DNA <2.000UI/ml và ALT bình thường cần kiểm tra ALT và HBV-DNA mỗi 3 tháng trong năm đầu và sau đó mỗi 6-12 tháng. Khi ALT tăng cần làm thường xuyên hơn (mỗi 3-6 tháng). Người có viêm gan virus B không hoạt động cần đánh giá HBsAg hàng năm.
- Theo dõi virus kháng thuốc: kháng thuốc ở người chưa điều trị bao giờ rất hiếm gặp và không khuyến cáo xét nghiệm. Đối với người đang được điều trị, biểu hiện đầu tiên của kháng thuốc là virus đột phá.
- Theo dõi ung thư tế bào gan bằng siêu âm có hoặc không có xét nghiệm AFP phối hợp 6 tháng 1 lần cho tất cả người có HBsAg (+), cho người có thành viên gia đình có tiền sử ung thư gan, hoặc có đồng nhiễm virus viêm gan D (HDV). Nếu không có siêu âm cần xét nghiệm AFP 6 tháng 1 lần.
Tỉ lệ nhiễm virus viêm gan C ở BN bị BTM cao hơn so với quần thể dân số chung. Nhiễm HCV làm tăng nguy cơ tiến triển nhanh BTM.
Nhiễm virus HCV trong BTM gây ra một số thách thức cho việc điều trị và quản lý BTM: lây truyền trong các đơn vị lọc máu dẫn đến tỷ lệ lưu hành cao ở BN chạy TNT, ảnh hưởng kết cục mảnh ghép, tăng nguy cơ mắc bệnh gan tiến triển ở những BN bị BTM tất cả các giai đoạn kéo theo tiến triển bệnh lý tim mạch và tăng nguy cơ tử vong.
- Tất cả BN BTM có yếu tố nguy cơ nhiễm HCV cần được sàng lọc:
+ Tất cả BN phát hiện BTM
+ Khi bắt đầu thực hiện phương pháp thay thế thận hoặc khi được chuyển đến từ một cơ sở hoặc phương thức lọc máu khác
+ Bệnh nhân chạy TNT, nên được xét nghiệm HCV mỗi 6 tháng
+ Bệnh nhân BTM tại thời điểm đánh giá ghép thận
- Các xét nghiệm cần làm:
+ Anti HCV, HCV-RNA (nếu kháng thể (+), hoặc có bằng chứng tổn thương gan)
+ ALT, AST, GGT
+ Xét nghiệm đồng nhiễm viêm gan B
- Đối với những BN bị BTM đã nhiễm HCV: Đánh giá thêm mức độ xơ hóa gan, đánh giá tăng áp lực tĩnh mạch cửa ở BN bị BTM nghi ngờ xơ hóa tiến triển (F3-4).
- Điều trị bệnh thận do HCV (xem bài bệnh cầu thận thứ phát sau viêm gan virus)
- Điều trị bệnh nhân BTM nhiễm HCV
- Điều trị nhiễm HCV sau ghép thận
a. Điều trị nhiễm HCV ở bệnh nhân BTM
Các thuốc kháng virus tác động trực tiếp (DAA) đường uống hiện có mang lại hiệu quả cao, dung nạp tốt, cho phép điều trị bệnh nhân HCV ở tất cả các giai đoạn BTM. Các phác đồ DAA hiện tại luôn kết hợp 2 loại thuốc trở lên với các cơ chế hoạt động khác nhau để phá vỡ sự nhân lên của HCV và có thể chỉ định cho BN bị BTM ở mọi giai đoạn, nhưng một số thuốc cần chỉnh liều dựa vào MLCT ước tính.
Tỷ lệ đáp ứng virus bền vững ở thời điểm 12 tuần sau khi hoàn tất điều trị (SVR12) của nhiều phác đồ DAA nằm trong khoảng từ 92%-100%. Tỷ lệ tác dụng phụ nghiêm trọng do DAA thường được báo cáo ở mức dưới 1% BN được điều trị.
BTM giai đoạn tiền lọc máu (G1-5 điều trị bảo tồn): Không cần điều chỉnh liều DAA. Thời gian điều trị thay đổi tùy theo phác đồ, có xơ gan hay không, và liệu pháp DAA trước đó (hiện tại thường là 12 tuần).
Hiện có phác đồ điều trị DAA dành cho từng kiểu gen hoặc dành cho mọi kiểu gen, các BN bị BTM đều dung nạp tốt và đạt hiệu quả cao.
Việc lựa chọn thuốc điều trị cụ thể dựa trên tiền sử điều trị, tương tác thuốc- thuốc, MLCT, giai đoạn xơ hóa gan, khả năng ghép thận và gan, và các bệnh kèm theo.
Bảng 35. Các phác đồ thuốc DAA điều trị viêm gan C theo giai đoạn BTM
| Giai đoạn BTM | Phác đồ DAA | Kiểu gen HCV | Mức độ chứng cứ |
| G1-G3b | Phác đồ bất kì được cấp phép | Tất cả | Không phân loại |
| G4-G5 chưa lọc máu, bao gồn cả bệnh nhân ghép thận | Sofosbuvir / Daclatasvir, 12 - 24 tuần Grazoprevir / Elbasvir, 12 tuần Sofosbuvir / Velpatasvir, 12 tuần Sofosbuvir / Ledipasvir, 12 tuần | Tất cả 1a, 1b, 4 Tất cả Tất cả | Cao Cao Thấp Rất thấp |
| G5 lọc máu | Sofosbuvir / Velpatasvir, 12 tuần Sofosbuvir / Daclatasvir, 12 - 24 tuần Sofosbuvir/Ledipasvir, 12 tuần Grazoprevir/Elbasvir, 12 tuần | Tất cả Tất cả Tất cả 1a, 1b, 4 | Cao Trung bình Trung bình Trung bình |
| Ghép thận, G1-G3b | Sofosbuvir / Ledipasvir, 12 - 24 tuần Sofosbuvir / Daclatasvir, 12 - 24 tuần Grazoprevir / Elbasvir, 12 tuần | Tất cả Tất cả 1a, 1b, 4 | Cao Cao Rất thấp |
- Lưu ý: Bệnh nhân BTM các giai đoạn 1-5D hay chuẩn bị ghép thận có nhiễm HCV nên được xét nghiệm sàng lọc đồng nhiễm Viêm gan B trước khi bắt đầu điều trị với DAA (xem phần điều trị Viêm gan B ở BTM)
b. Quản lý bệnh nhân nhiễm HCV trước và sau ghép thận
Trước ghép thận
- Nhiễm HCV làm giảm tỷ lệ sống của BN và thận ghép sau ghép thận nếu không được điều trị, nhưng BN bị BTM G5- 5D nhiễm HCV vẫn có khả năng sống sót sau ghép thận cao hơn so với tiếp tục lọc máu chu kỳ. Liệu pháp DAA cũng có hiệu quả và được dung nạp tốt ở những BN được ghép thận. Vì vậy ghép thận vẫn là lựa chọn điều trị tốt nhất cho BN bị BTM G5 bất kể có nhiễm HCV hay không.
- Nên đánh giá mức độ tổn thương gan và tình trạng tăng áp lực tĩnh mạch cửa trước khi quyết định ghép thận:
+ Những BN có HCV, xơ gan còn bù và không có tăng áp lực tĩnh mạch cửa có thể được ghép thận đơn độc
+ Những BN bị xơ gan mất bù hoặc tăng áp lực tĩnh mạch cửa đáng kể về mặt lâm sàng (nghĩa là chênh lệch áp lực tĩnh mạch gan # 10 mmHg hoặc bằng chứng tăng áp lực tĩnh mạch cửa trên hình ảnh hoặc xét nghiệm) nên được ghép gan-thận đồng thời. Điều trị cho những người bị tăng áp lực tĩnh mạch cửa từ nhẹ đến trung bình theo từng trường hợp cụ thể.
+ Tất cả BN bị HCV chờ ghép thận nên được điều trị bằng DAA, trước hoặc sau khi ghép.
- Thời điểm điều trị thuốc kháng virus: BN xơ gan còn bù hoặc không xơ gan mà thời gian chờ ghép kéo dài hơn 24 tuần, nên bắt đầu DAA trước ghép để hoàn thành 12 tuần điều trị và xác nhận đáp ứng virus bền vững sau khi hoàn tất điều trị 12 tuần.
Sau ghép thận
- Bệnh nhân ghép thận đang được điều trị bằng DAA cần được theo dõi nồng độ thuốc ƯCMD (CNI, ức chế mTOR) để điều chỉnh liều phù hợp
- Bệnh nhân trước đây bị nhiễm HCV đã đạt được đáp ứng virus bền vững trước ghép nên được xét nghiệm lại 3 tháng sau ghép hoặc khi có rối loạn chức năng gan.
- Bệnh nhân sau ghép thận bị nhiễm HCV nên được xét nghiệm protein niệu, hồng cầu niệu và MLCT ít nhất 6 tháng một lần, nếu protein niệu 24 giờ > 1g 2 lần trở lên phải xem xét sinh thiết thận ghép để chẩn đoán. Nếu có bằng chứng viêm cầu thận liên quan đến HCV sau ghép phải xem xét điều trị lại liệu pháp DAA.
- Các cơ sở chạy TNT cần tuân thủ nghiêm ngặt các biện pháp phòng ngừa chuẩn bao gồm các biện pháp kiểm soát nhiễm trùng hiệu quả để ngăn chặn việc máu và chất lỏng bị nhiễm máu lây lan giữa các BN.
- Không cần sử dụng máy lọc máu riêng biệt cho BN nhiễm HCV, không cần cách ly BN chạy TNT bị nhiễm HCV, có thể sử dụng chung các máy lọc máu của BN nhiễm HCV nếu tuân thủ các biện pháp phòng ngừa chuẩn.
- Thực hiện các biện pháp tích cực để cải thiện vệ sinh tay (và sử dụng găng tay đúng cách), tiêm an toàn, vệ sinh và khử trùng môi trường khi xác định được một trường hợp nhiễm mới HCV có khả năng lây nhiễm liên quan đến lọc máu.
5. ĐIỀU TRỊ GIAI ĐOẠN TIỀN LỌC MÁU
5.1.1. Một số định nghĩa
Giai đoạn tiền lọc máu là giai đoạn ngay trước khi bắt đầu điều trị thay thế thận để chuẩn bị cho BN. Nên bắt đầu chuẩn bị điều trị thay thế thận từ giai đoạn 4 (khi MLCT từ < 30ml/phút/1,73 m2 , cũng là giai đoạn BN BTM phải được chuyển cho BSCK Thận quản lý. Phải bắt đầu chuẩn bị từ giai đoạn 5, khi MLCT <15ml/phút/1,73 m2.
Điều trị thay thế thận là điều trị thay thế cho những chức năng đã mất đi ở BN suy thận (giai đoạn cuối), khi điều trị nội khoa và tiết chế không còn đủ hiệu quả và tính mạng BN bị đe dọa. Điều trị thay thế thận bao gồm 3 biện pháp: lọc TNT, lọc màng bụng và ghép thận.
Lọc máu cấp cứu là lọc máu phải được bắt đầu ngay lập tức hoặc trong vòng 48 giờ sau khi xuất hiện triệu chứng để điều chỉnh các tình trạng đe dọa tính mạng.
Lọc máu không cấp cứu là lọc máu có thể bắt đầu sau 48 giờ xuất hiện các triệu chứng nặng cần can thiệp.
Lọc máu có kế hoạch là bệnh nhân đã được tư vấn chọn phương thức lọc máu và chuẩn bị sẵn đường vào mạch máu để sử dụng được ngay khi bắt đầu lọc máu.
Lọc máu không kế hoạch là bắt đầu lọc máu khi chưa có sẵn đường vào mạch máu để sử dụng khi cần lọc máu, cần nhập viện hoặc phải bắt đầu bằng phương thức không phải là lựa chọn của bệnh nhân.
5.1.2. Thời điểm khởi đầu điều trị thay thế thận
Thời điểm khởi đầu điều trị thay thế cần được cá thể hóa, tùy thuộc vào MLCT, tốc độ suy giảm MLCT, biểu hiện lâm sàng và xét nghiệm, nguyện vọng và hoàn cảnh của BN. Cần một giai đoạn chuyển tiếp từ thời điểm BTM giai đoạn 5 đến thời điểm bắt đầu điều trị thay thế thận suy để giảm tỷ lệ biến chứng và tử vong ở giai đoạn đầu tiên của điều trị thay thế.
Thông thường các BN được chỉ định điều trị thay thế thận suy khi MLCT giảm tới 5-7ml/phút/1,73m2 ngay cả khi chưa có triệu chứng lâm sàng.
Cân nhắc bắt đầu lọc máu khi có triệu chứng hoặc dấu hiệu suy thận nặng: hội chứng urê máu cao, viêm màng ngoài tim, rối loạn toan kiềm hoặc điện giải không đáp ứng với điều trị nội khoa, quá tải thể tích tuần hoàn hoặc THA khó kiểm soát; ngứa, khuynh hướng dễ chảy máu; chán ăn, giảm cân và tình trạng dinh dưỡng xấu đi.
Cần thảo luận với BN về các lựa chọn điều trị, cả điều trị nội khoa và thay thế thận, điều trị tốt các nguy cơ TTTC hoặc tránh làm nặng thêm các bệnh lý khác.
Cần có sự phối hợp giữa người bệnh, cơ sở y tế, và bảo hiểm y tế. Cần xây dựng chương trình tư vấn chuẩn bị tiền lọc máu, lựa chọn phương pháp lọc máu và cá thể hoá với từng bệnh nhân.
5.1.3. Thời điểm chuyển chuyên khoa thận theo dõi
Tham khảo các chỉ định chuyển BN BTM đến khám chuyên khoa Thận tại mục 3.4.2.
Thời điểm tối thiểu cần chuyển chuyên khoa Thận là 1 năm trước khi phải lọc máu để đảm bảo BN có thời gian tìm hiểu rõ và đồng thuận trong chọn biện pháp điều trị thay thế thận, đồng thời đã được tư vấn, huấn luyện đầy đủ. Trong thời gian này BN cần được khám các chuyên khoa liên quan như phẫu thuật mạch máu nếu chọn lọc máu, ghép thận... BN ĐTĐ phải được chuyển BSCK Thận sớm hơn người không bị ĐTĐ do có tốc độ giảm chức năng thận nhanh hơn. Tham khảo bảng 9 (Phân tầng nguy cơ tiến triển của BTM đến giai đoạn cuối)
5.2.1. Vai trò và lợi ích của giai đoạn tiền lọc máu
Giai đoạn tiền lọc máu mang lại nhiều lợi ích vì làm giảm được hậu quả của việc khởi đầu điều trị thay thế thận suy quá muộn. Giai đoạn này giúp:
- Tạo điều kiện để BN được khởi đầu lọc máu trong điều kiện sức khỏe tối ưu
- Giảm số BN nhập viện cần lọc máu cấp cứu
- Giảm số BN lọc máu cấp cứu vì tăng quá cao urê, creatinine huyết thanh
- Giảm số BN dùng đường vào mạch máu tạm thời (làm tăng nguy cơ tử vong)
5.2.2. Mục tiêu của giai đoạn tiền lọc máu
- Điều trị các biến chứng liên quan suy thận mạn
- Bảo tồn chức năng thận và thể tích nước tiểu tồn dư cho BN
- Giáo dục hướng dẫn BN chọn lựa phương pháp điều trị thay thế thận thích hợp
- Chuẩn bị tạo đường vào mạch máu dài hạn cho BN chọn TNT
- Huấn luyện thao tác lọc màng bụng, nếu BN chọn lọc màng bụng
- Tiêm phòng viêm gan virus B
Để thực hiện các mục tiêu này, cần đảm bảo:
- Mọi BN BTM giai đoạn cuối cần được 1 nhóm nhiều chuyên khoa chăm sóc
- Nhóm nhiều chuyên khoa cần tư vấn cả về thay đổi lối sống (chế độ dinh dưỡng, vận động hợp lý, bỏ hút thuốc), giáo dục và tư vấn về các phương pháp điều trị thay thế thận, tạo đường vào mạch máu dài hạn để lọc máu, chăm sóc và điều trị các rối loạn tâm thần kinh, trầm cảm, lo âu.
- Các BN được lên lịch tái khám định kỳ, theo dõi lâm sàng và xét nghiệm, tầm soát và điều trị các bệnh lý tim mạch đi kèm và những bệnh lý khác như thiếu máu.
5.3.1. Những việc cần làm trong giai đoạn tiền lọc máu
Công tác chuẩn bị tối ưu cho điều trị thay thế thận gồm 5 bước, trong đó các bước 2,3 có thể tiến hành đồng thời.
Bước 1: Xác định BN BTM sẽ tiến triển đến giai đoạn cuối
Không phải mọi BN BTM giai đoạn 4 (MLCT 15-29ml/phút/1,73 m2) đều tiến triển đến giai đoạn cuối và phải lọc máu. Bên cạnh đó, có một tỷ lệ BN trong số này sẽ tử vong ở giai đoạn trước khi bắt đầu lọc máu. Vì vậy, chuẩn bị điều trị thay thế thận cho mọi BN bị BTM mà chỉ dựa vào MLCT < 30ml/phút/1,73 m2 là không phù hợp. Ngoài MLCT < 30ml/phút/1,73 m2 BN cần có thêm ít nhất 1 yếu tố trong bảng 37.
Bảng 36. Các yếu tố nguy cơ tiến triển suy thận giai đoạn cuối
| 1- Trẻ tuổi 2- Giảm chức năng thận theo thời gian 3- Có albumin niệu 4- Có bệnh cầu thận (nguyên phát hoặc thứ phát do đái tháo đường, bệnh mạch thận) 5- Tăng huyết áp 6- Có biến chứng của BTM (như tăng phosphate máu và/ hoặc thiếu máu) |
Trên thực tế, không thể chỉ dựa vào 1 yếu tố để xác định BN BTM giai đoạn 4-5 sẽ tiến triển đến BTGĐC. Cần cân nhắc từng BN BTM giai đoạn 4-5 dựa vào các dữ kiện về nhân trắc, lâm sàng, cận lâm sàng để đảm bảo chuẩn bị tối ưu cho BN đến giai đoạn lọc máu
Bước 2: Bảo vệ các mạch máu chi trên. Chuẩn bị đường vào mạch máu sớm để tránh việc phải lọc máu cấp cứu qua catheter TM trung tâm
Bắt đầu bước 2 khi MLCT 20-30ml/phút/1,73 m2.
Bắt đầu chuẩn bị điều trị thay thế thận ngay sau khi BN đã chọn lựa phương thức điều trị thay thế thận phù hợp tối ưu. Khi MLCT <15-20ml/phút/1,73m2 hoặc nguy cơ phải điều trị thay thế tính được là >40% trong vòng 2 năm cần lập kế hoạch ghép thận đón đầu (preemptive kidney transplantation) nếu BN có người hiến tạng sống sẵn sàng, hoặc xếp lịch tạo đường vào lọc máu.
Thường cần khoảng 3 tháng để tư vấn và giáo dục cho BN về chỉ định lọc máu, suy nghĩ và quyết định chọn phương thức điều trị tối ưu phù hợp. Thời gian để thông động tĩnh mạch trưởng thành cũng khoảng 2-3 tháng. Cần dự trữ đủ thời gian để tạo đường vào, chờ mạch trưởng thành và để sửa chữa nếu cần thiết.
Đối với BN chọn TNT phải hạn chế tối đa tiêm truyền ở các tĩnh mạch từ cổ tay trở lên ở chi trên. Không xẻ tĩnh mạch và đặt catheter vào các tĩnh mạch ở tay. Hạn chế đặt catheter TM trung tâm vì có thể gây huyết khối và chít hẹp tĩnh mạch trung tâm.
Bước 3: Tư vấn, giáo dục và hỗ trợ BN chọn lựa phương pháp điều trị thay thế thận thích hợp
Giáo dục, tư vấn cho BN BTM mang lại hiệu quả nâng cao sức khỏe, giảm số lần nhập viện, giảm tử vong và biến chứng.
Bảng 37. Tiếp cận phát triển chương trình tư vấn và giáo dục cho BN mắc BTM
| Mục tiêu | Cụ thể |
| Khởi đầu chương trình giáo dục | Khởi đầu khi MLCT<30ml/phút/1,73 m2. Cần bao gồm cả những BN được chuyển muộn, BN đã khởi đầu chạy TNT mà chưa có BSCK Thận chăm sóc |
| Người dẫn chương trình | Người giáo dục về BTM (BSCK Thận, Điều dưỡng), chuyên gia dinh dưỡng và nhân viên y xã hội |
| Thính giả | Bệnh nhân và người nhà và/ hoặc người chăm sóc BN, trao đổi 1-1 hoặc trong 1 lớp học |
| Nội dung giáo dục | Thảo luận về BTM, giải thích về các xét nghiệm đánh giá chức năng thận, biến chứng của BTM, các can thiệp để làm chậm tốc độ giảm chức năng thận, tầm quan trọng của việc bảo vệ mạch máu chi trên cho lọc máu, những phương thức lọc máu và ảnh hưởng của từng phương thức lên đời sống, ghép thận; thay đổi chế độ ăn theo giai đoạn của BTM; thời điểm tạo đường vào, mức chi trả của bảo hiểm y tế và các vấn đề cần quan tâm trong chi phí, các hướng dẫn khác |
| Số lần tập huấn/đối tượng | Thường 3-6 lần |
| Sử dụng nguồn lực xã hội minh họa | Chia sẻ thông tin từ các BN đang lọc máu hoặc đã từng lọc máu, ghép thận; tham quan đơn vị lọc máu |
| Hỗ trợ cho việc ra quyết định | Hỗ trợ BN chọn phương thức lọc máu thích hợp nhất với cuộc sống và vượt qua những lo lắng của lọc máu; Thảo luận về các chọn lựa bao gồm lọc máu, ghép thận, và điều trị bảo tồn nội khoa tối ưu không lọc máu |
Tiêm phòng viêm gan virus B
Cần hướng dẫn BN tiêm vaccin phòng viêm gan virus B trước khi phải bắt đầu lọc máu để tăng đáp ứng sinh miễn dịch. Tỷ lệ có đáp ứng với vaccin ở BN BTGĐC thấp hơn so với người không suy thận, với hiệu giá kháng thể thấp hơn và thời gian duy trì kháng thể ở mức bảo vệ ngắn hơn. Cần đánh giá và duy trì kháng thể anti-HBs >10IU/L. Xem thêm Phác đồ tiêm vaccin và đánh giá đáp ứng cụ thể ở “Dự phòng nhiễm trùng ở BN có BTM” mục 4.1.
Bước 4: Tạo đường lọc máu
Thận nhân tạo
Thông động tĩnh mạch (AVF) là đường vào tối ưu và nên là lựa chọn đầu tay nhưng tỷ lệ thành công và trưởng thành không đạt 100%, thời gian chờ mạch trưởng thành dài (tối thiểu 4-6 tuần). Cầu nối động tĩnh mạch bằng đoạn mạch nhân tạo (AVG), tự thân hoặc đồng loài có tỷ lệ thành công cao hơn, thời gian chờ để sử dụng ngắn hơn (2-3 tuần) nhưng đời sống ngắn hơn và chi phí cao hơn nhiều. Cần chủ động tạo đường vào mạch máu dài hạn cho BN chọn TNT để giảm thiểu việc phải đặt catheter tĩnh mạch trung tâm (CVC).
Trước khi tạo đường vào mạch máu cần khảo sát mạch chi bằng siêu âm và vẽ sơ đồ mạch máu, đo kích thước mạch và lưu lượng máu trước phẫu thuật để tăng tỷ lệ thành công. Catheter tĩnh mạch trung tâm có thể là đường vào mạch máu tạm thời dùng trong giai đoạn chờ mạch máu trưởng thành hoặc khi bị tắc và cũng có thể là đường vào dài hạn khi không tạo được hoặc chống chỉ định tạo đường vào mạch máu ngoại vi.
Lọc màng bụng
Đặt catheter lọc màng bụng trước khi khởi đầu điều trị ít nhất 2-4 tuần để có đủ thời gian lành vết thương giúp hạn chế rò dịch lọc và có thời gian huấn luyện BN. Trong thời gian chờ đợi, nếu cần lọc máu khẩn cấp, có thể đặt catheter đường hầm để lọc TNT. Trường hợp kỹ thuật lọc màng bụng thất bại, BN thường chuyển sang lọc TNT nhưng chưa có sẵn đường vào. Cần tạo AVF/AVG sớm nhất và đặt catheter đường hầm để lọc máu trong thời gian chờ.
Bước 5: Khởi đầu lọc máu (xem thêm phần thời điểm khởi đầu lọc máu)
Khi điều trị nội khoa và chế độ ăn kiêng không còn hiệu quả, tính mạng BN bị đe dọa, cần bắt đầu điều trị thay thế thận. Thời điểm bắt đầu điều trị thay thế thận cần cân bằng giữa việc kéo dài thời gian chưa lọc máu và sự xuất hiện các biến chứng của hội chứng urê máu cao, nhằm tối ưu hóa chất lượng cuộc sống của BN.
5.3.2. Điều trị bảo tồn nội khoa tích cực và chăm sóc hỗ trợ
Chỉ định điều trị bảo tồn nội khoa tích cực và chăm sóc hỗ trợ cho các BN từ chối điều trị thay thế thận, hoặc điều trị thay thế không khả thi hoặc không phù hợp.
Cần tìm hiểu lý do từ chối điều trị thay thế thận và tìm kiếm các giải pháp trước khi quyết định không lọc máu. Những BN chọn điều trị bảo tồn thường là người lớn tuổi, có nhiều bệnh đồng mắc, có khả năng hoạt động chức năng kém, hoặc không thể tiếp cận dịch vụ y tế tại các nước có thu nhập thấp và trung bình.
Cân nhắc hài hòa giữa việc kéo dài thời gian sống thêm với việc giảm chất lượng cuộc sống khi lọc máu, đặc biệt ở người cao tuổi hoặc rất cao tuổi.
Chăm sóc hỗ trợ thận bao gồm các dịch vụ nhằm cải thiện chất lượng cuộc sống cho BN bị BTM, ở mọi lứa tuổi, trong suốt thời gian mắc bệnh, bất kể tuổi thọ thế nào.
Những đối tượng ưu tiên chọn điều trị bảo tồn thay cho điều trị thay thế thận
Điều trị bảo tồn thích hợp cho những BN có nguy cơ cần nhập viện hoặc tử vong cao khi khởi đầu điều trị lọc máu.
- BN có 1 hoặc nhiều bệnh đồng mắc với nguy cơ tử vong cao (như suy tim, suy gan giai đoạn cuối hoặc bệnh lý ác tính tiển triển lan rộng).
- BN suy kiệt nặng kèm suy giảm khả năng nhận thức hoặc suy giảm chức năng vận động.
- BN đang điều trị lâu ngày tại các đơn vị chăm sóc điều dưỡng.
- BN có các triệu chứng tâm thần hoặc bệnh về thể chất nặng, không hồi phục.
- BN có rối loạn tâm thần không hồi phục, ảnh hưởng đến hiểu biết và hợp tác trong quá trình lọc máu, khiến lọc máu trở nên không an toàn cho BN và ảnh hưởng đến môi trường lọc máu, nhất là khi BN cần dùng các thuốc tâm thần khi lọc máu.
- BN sống đời sống thực vật.
Nguyên tắc y đức căn bản khi đánh giá và can thiệp chăm sóc hỗ trợ thận
- Mọi hoạt động vì lợi ích của BN, bảo vệ quyền lợi cho BN, ngăn chặn những tác hại ảnh hưởng lên BN, không làm hại BN.
- Theo Ý nguyện của BN, dựa trên châm ngôn “Mỗi con người trưởng thành và tâm trí lành mạnh có quyền quyết định điều gì sẽ xảy ra và được thực hiện với cơ thể của chính mình”.
- Không làm hại BN: chọn lựa phương pháp điều trị tối ưu, tránh những can thiệp không cần thiết hoặc làm nặng nề thêm tình trạng bệnh tật của BN.
- Đảm bảo tính công bằng trong chăm sóc BN.
BS điều trị phải giải thích và thảo luận với BN và gia đình, người giám hộ, và những thành viên quan trọng trong nhóm chăm sóc như BSCK Thận, điều dưỡng, nhân viên Y Xã hội, và chuyên viên chăm sóc giảm nhẹ.
Thời điểm thảo luận là thời điểm chọn để chuẩn bị lọc máu, hầu hết khi MLCT <20-30ml/phút/1,73 m2
Quyết định từ chối lọc máu và chọn điều trị bảo tồn dựa vào (1) ý nguyện của BN và gia đình, trên cơ sở chủ động tìm hiểu về cả 2 liệu pháp lọc máu và điều trị bảo tồn, (2) tiên lượng về lâm sàng của các chuyên gia liên quan, dựa theo các thang điểm để ước đoán nguy cơ tử vong của BN từ các nghiên cứu nếu từ chối lọc máu.
Các bước tiến hành trong thảo luận cùng với BN và gia đình BN
- Cung cấp thông tin: về tình hình sức khỏe hiện tại của BN, về các phương thức điều trị và những gì BN cần quyết định.
- So sánh các phương thức: Cung cấp thông tin chính xác về ưu nhược điểm, sự giống và khác nhau giữa các phương thức điều trị.
- Quan đểm cá nhân: Xây dựng quan điểm của từng cá nhân về từng phương thức theo từng trường hợp cụ thể.
- Đánh đổi: Hỗ trợ BN suy nghĩ về những gì cần đánh đổi dựa vào ưu và nhược điểm của từng phương thức.
- Quyết định: Hỗ trợ BN chọn lựa phương thức mà BS nghĩ là tốt nhất cho họ
Nội dung nguyên tắc của điều trị hỗ trợ thận ở BN BTGĐC: có thể thay đổi tùy theo từng BN nhằm đảm bảo chất lượng sống ở BN BTGĐC trong thời gian sống còn lại.
- Với BN tiên lượng sống tốt và chất lượng sống có thể chấp nhận được: Thường là BN khỏe hơn và ít có bệnh nền. Điều trị bao gồm thuốc làm chậm tốc độ tiến triển bệnh thận và thuốc điều trị các biến chứng của bệnh thận.
- Với BN tiên lượng và chất lượng cuộc sống kém: chủ yếu điều trị triệu chứng (mà BN than phiền) và chuẩn bị chấm dứt cuộc sống.
- Với BN không thể tiên lượng và không rõ về chất lượng cuộc sống: Chủ yếu điều trị kéo dài thời gian sống còn lại và điều trị triệu chứng.
Đánh giá toàn diện BN về bệnh lý thận và bệnh đồng mắc trước mọi can thiệp dựa vào lâm sàng, cận lâm sàng, có thể sử dụng thêm các thang điểm đánh giá được dùng cho giai đoạn này (như thang điểm ESAS-r:renal (Edmonton Symptom Assessment System- Revised- Renal): đánh giá mức độ 12 triệu chứng bao gồm đau, khả năng hoạt động, buồn nôn, trầm cảm, lo lắng, ngủ gà, sự thèm ăn, cảm giảc khỏe khoắn, khó thở, ngứa, ngủ, và hội chứng chân không yên theo thang điểm từ 0-10).
Nội dung cụ thể của chăm sóc hỗ trợ thận
- Làm chậm quá trình mất chức năng thận: Cân nhắc liều và có thể ngừng các thuốc ức chế hệ RAA (thuốc ƯCMC hoặc ƯCTT angiotensin II) để giảm nguy cơ tăng kali máu và làm tăng MLCT ở BN BTGĐC. Nếu đã bắt đầu dùng thuốc ức chế SGLT2 từ khi MLCT≥20ml/phút/1,73m2, tiếp tục dùng cho đến giai đoạn cuối.
- Kiểm soát huyết áp: Tránh bất lợi do HA tăng cao (như tai biến mạch máu não, nhồi máu cơ tim) và bảo tồn chức năng thể chất và nhận thức cũng như chất lượng cuộc sống. Tránh gây hạ HA dẫn đến té ngã, chóng mặt, mệt, rối loạn nhận thức. Nên duy trì HA ≤150/90 mmHg
- Điều trị thiếu máu để cải thiện tình trạng mệt, giảm suy tim, hạn chế truyền máu: Dùng erythropoietin, sắt. Hb mục tiêu 11g/dL.
- Điều trị tăng phosphate máu: dùng thuốc gắn phosphate và hạn chế thực phẩm chứa nhiều phosphate. Dùng Vitamin D dạng hoạt tính liều thấp để điều trị mệt, yếu cơ, mất cơ, và giảm nguy cơ gãy xương.
- Hạn chế Protein đưa vào (0,8g/Kg/ngày trở xuống ở BTM G3-5, khuyến cáo mức 2C). Bổ sung thêm keto-analog, nếu lượng protein đưa vào rất thấp (<0,4g/Kg/ngày).Việc hạn chế protein quá mức có thể không cần thiết ở những BN được chăm sóc giảm nhẹ vì hầu hết đã suy kiệt nặng. Hạn chế thực phẩm làm tăng Kali máu, giảm NaCl xuống <5g/ngày. Chế độ ăn kiêng tùy thuộc vào triệu chứng liên quan như hạn chế phosphor khi BN có hội chứng chân không yên, ngứa do urê máu cao, tăng lắng đọng Canxi và phospho ở BN đau cơ, giả gout.
- Điều chỉnh toan chuyển hóa: Điều trị bằng bicarbonate uống, chỉnh liều để đạt mục tiêu HCO3 ≥ 23mmol/L.
- Điều trị tăng kali máu: Giảm liều hoặc ngừng các thuốc có thể gây tăng kali như nhóm ức chế hệ RAA. Nếu tăng kali máu kéo dài, cần thay đổi chế độ ăn, dùng thuốc trao đổi cation đường uống như sodium polystyrene sulfonate, calcium polystyrene sulfonate, polymer gắn calcium trao đổi kali thế hệ mới hoặc muối silicate của nguyên tố zirconium cũng có vai trò cố định kali ở đường tiêu hóa
- Lợi tiểu và hạn chế nước để kiểm soát tình trạng quá tải dịch (tùy theo lượng nước tiểu).
- Điều trị triệu chứng: giảm đau, ngứa, nôn và buồn nôn, khó thở, co giật…
6.1. ĐIỀU TRỊ THAY THẾ THẬN BẰNG THẬN NHÂN TẠO
Thận nhân tạo dựa vào 2 nguyên lý cơ bản là khuếch tán và siêu lọc.
- Lọc máu đủ liều: dựa vào chỉ số Kt/V, tối thiểu phải đạt 1,2 - 1,4 mỗi lần lọc.
- Kiểm soát trọng lượng khô
- Kiểm soát huyết áp ≤ 140/90 mm Hg.
- Kiểm soát thiếu máu.
- Kiểm soát các biến chứng xảy ra trong lọc máu và biến chứng lọc máu dài ngày.
- Nâng cao chất lượng sống cho BN và cải thiện thời gian sống.
6.1.3.1. Lọc máu đủ
Liều lọc máu tiêu chuẩn: Bệnh nhân phải được lọc tối thiểu 3 lần/tuần, mỗi lần trung bình 4 giờ. Việc thay đổi liều chuẩn phải dựa trên từng trường hợp cụ thể.
Các chỉ tiêu lâm sàng:
- Bệnh nhân cảm thấy khỏe, ăn uống, sinh hoạt tương đối bình thường.
- Không bị suy dinh dưỡng.
- Huyết áp ở mức bình thường hoặc trong giới hạn 140/80 - 160/90 mmHg.
- Hb đạt mục tiêu (10-11,5g/dL).
- Không phù.
- Bệnh nhân không có các triệu chứng của hội chứng nhiễm độc urê máu như chán ăn, rối loạn vị giác, nôn, buồn nôn, mất ngủ, ngủ gà, suy nhược cơ thể.
- Các chỉ tiêu xét nghiệm:
- Chỉ số Kt/V ≥ 1,2 - 1,4 hoặc tỉ lệ giảm urê (URR) ≥ 65 - 70%.
Kt/V = -ln (R - 0.008 x t) + (4 - 3.5x R) x 0.55 x UF/V, trong đó
+ R = 1- URR
+ t: Thời gian lọc (giờ)
+ UF: Lượng dịch rút (kg)
+ V: Thể tích phân bố urê trong cơ thể dựa theo cân nặng, chiều cao (Lít).
- Một số chỉ số sinh hóa khác (trước lọc máu): Bicarbonate: 18-22 mEq/L; K máu: 4-6 mEq/L, Canxi: 2,2-2,4 mmol/L, Phosphate: 1,1-1,75 mmol/L, PTH: 150-300 pg/mL, 25(OH)D3 > 30 ng/mL, CRP < 8 mg/L.
6.1.3.2. Kiểm soát dịch và trọng lượng khô
Cần xác định và duy trì trọng lượng khô, dựa vào:
- Các dấu hiệu lâm sàng: phù, cân nặng trước đó, HA;
- Các chỉ số xét nghiệm: peptid thải Na tâm nhĩ (ANP), tuy nhiên khó phiên giải chính xác kết quả ở người suy thận;
- Các thăm dò: chụp phim XQ phổi đo chỉ số tim-ngực, tìm dịch màng phổi; siêu âm tim đánh giá áp lực động mạch phổi, dịch màng ngoài tim, chức năng tim; đo đường kính tĩnh mạch chủ; đo độ kháng trở xác định các thành phần cơ thể.
6.1.3.3. Kiểm soát huyết áp
Ngoài các biện pháp kiểm soát HA áp dụng cho BN BTM (tham khảo mục “Kiểm soát huyết áp”), các biện pháp kiểm soát HA riêng cho BN lọc máu bao gồm:
- Kiểm soát trọng lượng khô
- Sử dụng các thuốc hạ áp ít bị lọc qua màng
- Thay đổi một số thông số dịch lọc
- Lựa chọn liều và đường dùng thuốc kích thích sinh hồng cầu
6.1.3.4. Kiểm soát thiếu máu (tham khảo nội dung “Kiểm soát thiếu máu”).
6.1.4. Biến chứng của thận nhân tạo và xử trí
6.1.4.1. Biến chứng cấp tính trong lọc máu
a. Hạ huyết áp: thường do rút nước quá nhanh hoặc quá mức. Có thể do nguyên nhân tim mạch. Tình trạng hạ HA phải được phát hiện sớm để xử trí kịp thời và phải tìm nguyên nhân. Quy trình xử lý biến chứng hạ HA chi tiết xin tham khảo tài liệu “Hướng dẫn Quy trình kỹ thuật thận nhân tạo".
b. Tăng huyết áp: Các cách xử trí
- Dùng thuốc hạ áp trước lúc lọc máu, nên chọn thuốc ức chế men chuyển và/hoặc ức chế kênh canxi.
- Dùng dịch lọc có nồng độ ion canxi, natri thấp hơn.
- Điều chỉnh nồng độ bicarbonat dịch lọc.
- Chuyển sang lọc máu kết hợp siêu lọc, lọc màng bụng, ghép thận;
- Cân nhắc dùng dịch lọc acetat trong một số rất ít trường hợp
c. Sốt, rét run: Do dịch lọc bị nhiễm bẩn và có chứa chí nhiệt tố; nhiễm khuẩn từ đường vào mạch máu (nhất là catheter tĩnh mạch trung tâm); nhiễm bẩn hệ thống nước cho TNT; nước không siêu tinh khiết khi sử dụng màng lọc có tính thấm cao; nhiễm bẩn khi xử lý và bảo quản vật tư dùng lại. Đôi khi do phản ứng truyền máu/chế phẩm máu trong lúc lọc máu. Phải rà soát ngay và điều chỉnh các quy trình thao tác, làm sạch, khử khuẩn, tiệt khuẩn đồng thời tăng cường giám sát quá trình thực hiện.
d. Phản ứng phản vệ: Tác nhân gây phản ứng phản vệ có thể từ màng lọc, dây lọc, dịch lọc và thuốc sử dụng trong lọc máu, thường gặp nhất là màng lọc.
- Phản ứng týp A: xảy ra ngay sau bắt đầu lọc 5-10 phút đầu, tối đa sau 20 phút, biểu hiện rầm rộ như phản ứng quá mẫn do IgE (khó thở, phù mặt, nổi mề đay, nôn ói, tiêu chảy, ngừng tim và có thể tử vong. Nguyên nhân: do tồn dư hóa chất rửa màng & dây, chất tiệt trùng, hóa chất tiệt khuẩn. Xử trí: ngừng lọc máu, vứt bỏ toàn bộ dây và màng lọc, kháng histamin, glucocorticoids tĩnh mạch, nếu nặng dùng adrenalin, hồi sức. Phòng ngừa: thực hiện test kiểm tra hóa chất tồn dư trước khi kết nối BN.
- Phản ứng týp B: xảy ra muộn hơn, 20-40 phút sau khi bắt đầu lọc máu, biểu hiện nhẹ hơn, ví dụ chỉ đau ngực, đau lưng. Xử trí: kháng histamin, glucocorticoids uống hoặc tĩnh mạch.
e. Hội chứng mất cân bằng: Biểu hiện qua các triệu chứng rối loạn toàn thân và thần kinh trong hoặc sau lọc máu ở các mức độ từ nhẹ đến nặng, gồm buồn nôn, nôn, co giật, ngủ gà, hôn mê. Xử trí:
- Ngừng lọc máu;
- Điều trị triệu chứng;
- Điều trị phù não bằng mannitol
6.1.4.2. Biến chứng lọc máu dài ngày
a. Biến chứng tim mạch
Là nguyên nhân hàng đầu gây tử vong ở BN TNT. Thường gặp rối loạn chức năng thất trái và phì đại thất trái, suy tim, đột quỵ não. Cần kiểm soát tốt HA và tình trạng dịch (trọng lượng khô); duy trì Hb đạt mục tiêu ổn định; điều trị bệnh cơ tim thiếu máu, suy tim; duy trì Ca-P-PTH đạt mục tiêu; chọn đường vào phù hợp với chức năng tim.
b. Rối loạn chuyển hóa xương: Ngoài các biện pháp kiểm soát rối loạn Ca-P-PTH cho BN BTM được mô tả trong nội dung “Kiểm soát rối loạn chuyển hóa xương và chất khoáng ở bệnh nhân bệnh thận mạn”, các BN TNT chu kỳ cần có chế độ ăn hạn chế phosphate và được lọc đủ giờ.
b. Suy dinh dưỡng: Đánh giá định kỳ tình trạng dinh dưỡng và phân loại mức độ dinh dưỡng cho BN TNT để có can thiệp kịp thời, phù hợp.
Bổ sung dinh dưỡng cho BN ăn kém ngon miệng, không đảm bảo đưa vào đủ lượng protein và năng lượng, có các chỉ số dinh dưỡng xấu dần. Dùng các chế phẩm đường miệng (acid amin, sữa dành riêng cho người lọc TNT) cho BN suy dinh dưỡng nhẹ. Cân nhắc dùng chế phẩm dinh dưỡng tĩnh mạch một phần, ngắt quãng trong ca lọc máu phối hợp đường miệng, hoặc toàn bộ qua tĩnh mạch nếu thất bại qua đường tiêu hóa.
Bổ sung đủ vitamin, khoáng chất và nguyên tố vi lượng.
Phối hợp điều trị toan chuyển hóa, thiếu máu, lọc máu đầy đủ, ưu tiên màng lọc có tính hòa hợp sinh học cao, sử dụng nước siêu tinh khiết. Kiểm soát các bệnh lý đi kèm.
6.1.5. Quản lý bệnh nhân thận nhân tạo
Đảm bảo đủ nhân lực đã qua đào tạo tại cơ sở lọc máu; hoạt động phối hợp với các chuyên ngành khác. Kiểm tra, giám sát, kiểm chuẩn định kỳ hệ thống máy và trang thiết bị, chất lượng nước để duy trì đạt tiêu chuẩn theo quy định hiện hành và luôn ổn định. Khuyến cáo có bộ phận kiểm tra chất lượng độc lập hoạt động thường xuyên.
BN phải được BSCK Thận quản lý từ giai đoạn tiền lọc máu để có sự chuẩn bị tinh thần, được tạo sẵn đường vào mạch máu, được tiêm phòng đầy đủ trước khi bắt đầu lọc máu. (Tham khảo nội dung “Giai đoạn tiền lọc máu”)
Lập hồ sơ quản lý ngoại trú cho BN TNT; khám và xét nghiệm định kỳ cho BN ổn định; điều chỉnh lịch khám, xét nghiệm cho BN chưa ổn định tùy tình trạng. Điều chỉnh chế độ ăn, thuốc, các thông số điều trị TNT dựa vào kết quả khám và xét nghiệm.
Xét nghiệm cần thực hiện định kỳ gồm: tổng phân tích tế bào máu ngoại vi, urê, creatinin, điện giải đồ 1-2 tháng 1 lần; định lượng protid, albumin, acid uric, men gan, canxi, phosphat, tình trạng sắt (sắt huyết thanh, ferritin, transferrin/độ bão hòa transferrin), mỡ máu 3-6 tháng 1 lần; PTH, dấu ấn viêm gan virus B, C, X Quang ngực, siêu âm tim, điện tim 6-12 tháng 1 lần; siêu âm ổ bụng 12 tháng 1 lần.
Tuân thủ các biện pháp phòng ngừa chuẩn để kiểm soát nhiễm khuẩn; tiêm phòng chủ động với các bệnh có thể phòng ngừa.
Bảo vệ đường vào mạch máu cho BN TNT bằng cách thay đổi điểm chọc kim, cầm máu đúng, thao tác vô khuẩn, đặc biệt là với catheter tĩnh mạch trung tâm. Khám lâm sàng đường vào trước mỗi lần kết nối, kiểm tra định kỳ bằng siêu âm nếu sẵn có. Hướng dẫn BN các biện pháp giữ vệ sinh cá nhân.
Dự phòng và điều trị các biến chứng trong ca lọc máu và biến chứng của lọc máu dài hạn. Điều trị các tình trạng bệnh đi kèm.
Tham khảo thêm nội dung “Dự phòng nhiễm trùng ở bệnh nhân có bệnh thận mạn” và tài liệu “Hướng dẫn Quy trình kỹ thuật thận nhân tạo”.
6.2. ĐIỀU TRỊ THAY THẾ THẬN BẰNG LỌC MÀNG BỤNG
Có 2 nguyên lý chính là thẩm tách và siêu lọc. Màng bụng có diện tích lớn gồm nhiều mạng lưới mao mạch, được xem là một màng lọc bán thấm. Khoang ổ bụng có thể chứa một lượng lớn dịch lọc có áp lực thẩm thấu cao, được xem là khoang dịch lọc. Mạng lưới mao mạch ổ bụng được xem là khoang máu.
Lợi ích của lọc màng bụng (LMB) là siêu lọc thấp, chậm, liên tục nên được dung nạp tốt, giúp huyết động ổn định, ít bị hạ huyết áp. Thời gian sống thêm, chất lượng sống của bệnh nhân LMB tương đương với lọc TNT.
6.2.2. Mục tiêu điều trị lọc màng bụng
- Lọc màng bụng đủ liều: xác định dựa vào chỉ số Kt/V tuần.
- Kiểm soát dịch siêu lọc và đạt cân bằng dịch vào-ra.
- Kiểm soát biến chứng nhiễm trùng đặc biệt là viêm phúc mạc, nhiễm trùng đường hầm và chân catheter.
- Phòng chống suy dinh dưỡng và kiểm soát các biến chứng chuyển hóa.
- Nâng cao chất lượng sống và cải thiện thời gian sống còn.
6.2.3.1. Kê đơn lọc màng bụng
- Công thức thông thường: 1 túi dịch lọc 2 lít có Glucose 1,5% /lần x 4 lần/ngày. Có thể điều chỉnh tùy theo tình trạng bệnh nhân.
- Điều chỉnh số lần thay dịch mỗi ngày theo chức năng thận tồn dư.
- Làm test đánh giá phân loại màng bụng trước khi lựa chọn chế độ lọc. Số lần thay dịch và/hoặc thời gian ngâm dịch được điều chỉnh tùy theo loại màng bụng.
- Điều chỉnh thể tích dịch lọc đưa vào khoang bụng theo kích thước BN.
- Bổ sung dịch lọc có Glucose 2,5% hoặc 4,25% nếu không đạt thể tích siêu lọc và/hoặc BN quá tải dịch, tuy nhiên cần lưu ý nguy cơ làm tổn thương màng bụng.
6.2.3.2. Lọc màng bụng đủ liều
Đánh giá dựa vào chỉ số Kt/V tuần, cần đạt Kt/V tuần = 2,0-2,25
Kt/V tuần = 7 x [ Kt/V LMB/ngày + Kt/V chức năng thận/ngày].
Trong đó: Kt LMB/ngày = tỉ số nồng độ urê trong dịch thẩm tách trong 24 giờ /nồng độ urê trong máu. Kt chức năng thận/ngày (chức năng thận tồn dư) = tỉ số urê trong nước tiểu/ urê trong máu. V (đối với nam) = 2,447 - 0,09516 (A) + 0,1704 (H) + 0,3362 (W); V (đối với nữ) = 2,097 - 0,1069 (H) + 0,62466 (W). A: tuổi (năm), H: chiều cao (cm), W: cân (kg).
Khuyến cáo Kt/Vurê tối thiểu là 1,7/tuần; độ thanh thải creatinin 50L/tuần/1,73m2 cho người lớn (1A)
Nếu BN đã đạt Kt/V mức tối thiểu nhưng vẫn có triệu chứng do tăng urê máu cần tăng liều LMB (1B)
Bệnh nhân vô niệu nên LMB liên tục 24h hơn là ngắt quãng (1B)
6.2.3.3. Kiểm soát siêu lọc và cân bằng dịch
Theo dõi chức năng màng bụng định kỳ (6 tuần sau khi bắt đầu điều trị và ít nhất là hàng năm hoặc khi có chỉ định lâm sàng) bằng test cân bằng màng bụng (PET). Theo dõi lượng nước tiểu hàng ngày và thể tích siêu lọc màng bụng để điều chỉnh thích hợp khi có tràn dịch (1C).
- Cân nhắc dùng máy và icodextrin (nếu có) để tránh tái hấp thu dịch đối với màng bụng có tính thấm cao hoặc trung bình cao (1A).
- Không sử dụng thường xuyên dịch lọc có glucose ưu trương (2,5%; 4,25%) để kiểm soát dịch mà nên sử dụng icodextrin (nếu có) hoặc thuốc lợi tiểu (1B).
- Áp dụng các chiến lược điều trị có lợi cho việc bảo tồn chức năng hoặc thể tích thận (sử dụng ACEi, ARB, thuốc lợi tiểu, và tránh mất nước) (1B).
- Theo dõi chặt chẽ và điều chỉnh chế độ lọc hoặc chuyển đổi phương thức lọc máu cho BN vô niệu, thừa nước và chỉ đạt siêu lọc <750 ml/ngày kéo dài (1B).
- Điều trị quá tải dịch tùy theo nguyên nhân (liều lọc, chế độ lọc, và chương trình lọc chưa phù hợp; BN không tuân thủ chế độ ăn uống; mất chức năng thận tồn dư; catheter màng bụng di lệch; rò dịch lọc; suy màng lọc).
6.2.3.4. Kiểm soát đường máu
Tham khảo nội dung “Kiểm soát đường máu”
6.2.4. Biến chứng lọc màng bụng và xử trí
6.2.4.1. Biến chứng về kỹ thuật
Các biến chứng kỹ thuật phần lớn cần can thiệp ngoại khoa, tùy nguyên nhân.
6.2.4.2. Viêm phúc mạc
Chẩn đoán viêm phúc mạc ở BN LMB: BN có 2 trong 3 tiêu chuẩn sau
- Đau bụng và/hoặc dịch xả đục
- Trong dịch xả có bạch cầu >100/μL hay >0.1 x 109/L (sau thời gian lưu dịch ít nhất 2 giờ), với >50% là bạch cầu đa nhân, hoặc nấm
- Kết quả cấy dịch lọc dương tính
Ở những cơ sở có nguồn lực có thể phát hiện sớm viêm phúc mạc bằng que nhúng có chứa esterase bạch cầu, MMP8 và 9, NGAL, procalcitonin, các mảnh DNA của vi khuẩn, giải trình tự gen qua rRNA…
Chẩn đoán nhanh viêm phúc mạc do nấm dựa vào chỉ số galactomannan dịch màng bụng và trong máu.
Điều trị viêm phúc mạc ở BN LMB bằng kháng sinh tại chỗ (ngâm trong ổ bụng) +/- kháng sinh toàn thân.
Các phác đồ điều trị cụ thể tùy theo hướng dẫn thực hành lâm sàng của từng khu vực hay trung tâm, dựa vào thông tin về chủng vi trùng thường lưu hành, kháng sinh đồ, và cần bao phủ cả vi khuẩn Gram âm và Gram dương. Cần lưu ý về sự thay đổi nồng độ kháng sinh với các chế độ điều trị LMB khác nhau để điều chỉnh liều hoặc thay đổi chương trình lọc phù hợp.
Cân nhắc rút catheter LMB vĩnh viễn hay có thể đặt lại sau khi kiểm soát được viêm phúc mạc cho các BN không đáp ứng điều trị, tình trạng màng bụng hoặc BN không cải thiện, viêm phúc mạc tái đi tái lại, viêm phúc mạc do nấm, viêm phúc mạc đồng thời với nhiễm trùng đường hầm và/hoặc chân catheter.
Viêm phúc mạc tái nhiễm: khi có một đợt khác xảy ra trong vòng 4 tuần sau khi kết thúc đợt điều trị trước với tác nhân gây bệnh khác.
Viêm phúc mạc tái phát: khi có một đợt khác xảy ra trong vòng 4 tuần sau khi kết thúc đợt điều trị trước với cùng tác nhân gây bệnh hoặc cấy âm tính
Viêm phúc mạc lặp lại: khi có một đợt khác xảy ra ngoài 4 tuần sau khi kết thúc đợt điều trị trước với cùng tác nhân gây bệnh
Viêm phúc mạc kháng trị: khi vẫn có dịch đục hoặc BC > 100x 109/L sau 5 ngày điều trị kháng sinh.
Viêm phúc mạc liên quan catheter: Viêm phúc mạc kèm nhiễm trùng chân catheter hay đường hầm với cùng tác nhân gây bệnh hoặc một đợt vô trùng.
Kết quả LMB cũng được đánh giá dựa trên tỷ lệ viêm phúc mạc, lượng giá bằng 1 đợt/số BN-tháng, hoặc số đợt/BN-năm.
6.2.4.3. Quá tải dịch
Cần chẩn đoán và điều trị hệ thống tình trạng thừa dịch cho BN LMB theo nguyên nhân.
- Theo dõi lượng dịch vào-ra, cân nặng hằng ngày.
- Hướng dẫn chế độ ăn giảm muối và nước phù hợp.
- Bảo vệ chức năng thận tồn dư.
- Dùng lợi tiểu quai nếu còn chức năng thận tồn dư.
- Giáo dục BN tuân thủ điều trị, cách sử dụng dịch LMB linh hoạt.
- Kiểm soát đường máu.
- Bảo tồn chức năng phúc mạc.
- Xử trí rò dịch lọc.
- Xử trí rối loạn chức năng catheter.
6.2.4.4. Suy dinh dưỡng
Nguyên nhân suy dinh dưỡng ở BN LMB:
- Nhiễm độc urê (lọc máu chưa đủ) gây chán ăn
- Trầm cảm
- Bệnh lý căn nguyên: ĐTĐ có liệt dạ dày…
- Mất protein qua màng bụng: mất khoảng > 0,5g/l dịch lọc, chủ yếu là albumin và 15% là IgG, lượng mất nhiều hơn ở người có tính thấm màng bụng trung bình và cao. BN mất khoảng 2-3g acid amin/ngày; 8,8±0,5g protein/ngày; 5,7±0,4g albumin/ngày và vitamin tan trong nước. Lượng mất nhiều hơn khi viêm phúc mạc.
Tiến hành can thiệp cho BN suy dinh dưỡng tùy theo sự sẵn có ở cơ sở:
- Tư vấn dinh dưỡng.
- Can thiệp dinh dưỡng đường tiêu hoá: Bổ sung đạm qua thức ăn, sonde dạ dày.
- Truyền đạm.
- Sử dụng dịch lọc có acid amin.
- Tăng liều lọc máu.
- Thuốc kích thích ăn ngon miệng, vitamin.
6.2.4.5. Biến chứng liên quan đến chuyển hóa
- Rối loạn chuyển hóa đường: nguyên nhân do ĐTĐ có từ trước, sử dụng dịch lọc có glucose, tuổi cao và ít vận động. Glucose dễ bị hấp thu qua màng bụng và thay đổi tuỳ thuộc tính thấm màng bụng của từng BN. Thời gian ngâm dịch càng dài thì lượng glucose hấp thu càng lớn và ngược lại. Trung bình khoảng 100-150g glucose được hấp thu mỗi ngày, cung cấp thêm cho cơ thể 500-800 Kcal/ngày. BN tăng bài tiết insulin kèm tăng đề kháng insulin, dẫn đến xơ vữa động mạch. Phải dùng thuốc hạ đường máu hoặc insulin cho BN LMB bị tăng đường máu.
- Rối loạn chuyển hóa lipid máu: tăng cholesterol, triglyceride, giảm HDL. Tham khảo điều trị ở nội dung “Kiểm soát Lipid máu”.
- Rối loạn Ca-P-PTH điều chỉnh bằng các phương pháp như đối với BN BTM phối hợp chế độ ăn và dùng dịch lọc có nồng độ canxi chuẩn.
- Các rối loạn điện giải: giảm natri máu, tăng natri máu, hạ kali máu... điều chỉnh bằng chế độ ăn, tốc độ siêu lọc và giải quyết nguyên nhân.
Để điều trị các biến chứng chuyển hóa cần kiểm soát tốt đường máu, dùng dịch lọc có nồng độ glucose thấp hoặc không chứa glucose (icodextrin, acid amin) (1B). Điều chỉnh liều lọc và/hoặc nồng độ dung dịch lọc để duy trì bicarbonate huyết tương trong giới hạn bình thường (1B). Hạn chế sử dụng dịch lọc có glucose ưu trương (2C).
6.2.4.6. Lọc màng bụng không đủ
Nguyên nhân: lượng dịch lọc hàng ngày không đủ, thời gian ngâm-xả dịch không đạt, tính thấm màng bụng, kích thước/trọng lượng cơ thể, BN vô niệu và xơ màng bụng. Điều trị theo nguyên nhân.
6.2.4.7. Suy siêu lọc
Là tình trạng BN vẫn quá tải dịch khi đã dùng 3-4 túi dịch lọc có nồng độ glucose 4,25%/ngày. Suy siêu lọc được xác định khi lượng dịch siêu lọc chỉ đạt <400 ml sau 4 giờ ngâm 2 lít dịch lọc có glucose 4,25%.
Phải chẩn đoán phân biệt với các nguyên nhân gây giảm siêu lọc khác: BN không tuân thủ đúng chương trình điều trị đã kê, dịch không thích hợp, kê đơn không đúng, biến chứng cơ học, tắc catheter do mạc nối hoặc di lệch catheter, tăng đường máu.
Phân loại và xử trí suy siêu lọc
- Type 1 (tính thấm cao): Thường gặp sau 3-4 năm LMB. Nồng độ Glucose dịch lọc giảm nhanh sau khi cho dịch vào ổ bụng và không rút được nước. Nguyên nhân: xơ hóa mô kẽ, dày màng bụng. Điều trị: ngâm ngắn bằng máy (1-1,5 giờ) hoặc dùng dịch icodextrin hoặc tạm ngừng LMB một thời gian.
- Type 2 (tính thấm thấp): Ít gặp hơn. Màng bụng giảm khả năng thải chất hòa tan, rút dịch. Nguyên nhân: giảm diện tích bề mặt bởi sẹo cũ, dính do VPM hoặc do bệnh lý khác. Điều trị: chuyển thận nhân tạo.
Xơ hóa màng bụng:
Chẩn đoán xơ hóa màng bụng bằng lâm sàng kết hợp X quang (dấu hiệu tắc ruột và tạo vỏ bọc), CT scan ổ bụng (1B)
Nên chuyển BN sang chuyên khoa dinh dưỡng để theo dõi tình trạng dinh dưỡng, hỗ trợ dinh dưỡng đường uống, hoặc bổ sung thường xuyên qua đường tĩnh mạch (1C).
Điều trị thử bằng glucocorticoids, thuốc ức chế miễn dịch, tamoxifen (2C).
Cân nhắc chuyển TNT dựa vào nguyện vọng của bệnh nhân, tuổi thọ và chất lượng cuộc sống (2C).
Dùng loại dịch LMB có tính tương thích sinh học (có độ pH bình thường và/hoặc chứa các sản phẩm thoái hóa glucose nồng độ thấp) cho BN bị đau khi vào dịch (2B).
6.2.5. Quản lý bệnh nhân lọc màng bụng
Đảm bảo đủ nhân lực đã qua đào tạo tại cơ sở lọc máu; hoạt động phối hợp với các chuyên ngành khác.
BN phải được BS Thận quản lý từ giai đoạn tiền lọc máu để có sự chuẩn bị tinh thần, đặt catheter, tiêm phòng đầy đủ trước khi bắt đầu LMB. (Tham khảo nội dung “Giai đoạn tiền lọc máu”). Dự trù đủ thời gian tập huấn, định kỳ đào tạo lại cho BN.
Chuẩn bị bệnh nhân vào chương trình lọc màng bụng: tham khảo nội dung “Giai đoạn tiền lọc máu”.
Lập hồ sơ quản lý LMB ngoại trú; khám và xét nghiệm định kỳ cho BN ổn định; điều chỉnh lịch khám, xét nghiệm cho BN chưa ổn định theo tình trạng BN. Điều chỉnh chế độ ăn, thuốc, các thông số điều trị LMB dựa vào kết quả khám, xét nghiệm.
Các xét nghiệm cơ bản cần thực hiện định kỳ cho BN LMB ổn định gồm: tổng phân tích tế bào máu ngoại vi, urê, creatinin, điện giải đồ 1-2 tháng 1 lần; định lượng protid, albumin, acid uric, men gan, canxi, phosphat, tình trạng sắt (sắt huyết thanh, ferritin, transferrin/độ bão hòa transferrin), mỡ máu 3-6 tháng 1 lần; PTH, X Quang ngực, siêu âm tim, điện tim 6-12 tháng 1 lần; siêu âm ổ bụng 12 tháng 1 lần. Cần kiểm tra đường máu hàng tháng. Lập kế hoạch tái khám định kỳ (theo quy định hiện hành).
Kiểm tra thao tác của BN, đánh giá thông tin quá trình lọc tại nhà của BN, nhận định ý thức tuân thủ; khám tình trạng đường hầm và chân catheter; đánh giá tình trạng dịch; tư vấn định kỳ về chế độ ăn; rà soát và điều chỉnh các thông số lọc và đơn thuốc.
6.2.6.1. Dự phòng viêm phúc mạc
- Chọn lựa và tập huấn kỹ cho BN. Kiểm tra các điều kiện vệ sinh môi trường và nơi cư trú trước khi quyết định chọn LMB; Rà soát các yếu tố kinh tế, xã hội, trình độ, ý thức, sự ưa thích và tính tuân thủ của BN.
- Phòng ngừa rối loạn tiêu hóa (táo bón hay tiêu chảy), dự phòng khi nhổ răng, điều trị dứt điểm viêm họng.
- Huấn luyện kỹ cho BN và người nhà trợ giúp, thực hiện lặp lại định kỳ, thường xuyên, liên tục, hướng dẫn BN cách phát hiện và báo cáo biến cố, nhân viên liên lạc, cách lấy mẫu dịch lọc mang đến bệnh viện làm XN, cách vệ sinh bàn tay đúng, các thao tác vô khuẩn khi thay dịch và cách chăm sóc catheter. Phải thông báo cho các BS chăm sóc mọi biến cố xảy ra, nhu cầu được trợ giúp v.v…
6.2.6.2. Dự phòng suy siêu lọc
Kiểm soát tốt đường máu, không lạm dụng dịch ưu trương để cải thiện siêu lọc. Ưu tiên dùng dịch lọc có glucose 1,5%. Bảo tồn chức năng thận tồn dư.
6.2.6.3. Dự phòng xơ hóa màng bụng (bảo vệ phúc mạc)
- Tập huấn cho BN và người trợ giúp, cung cấp các phương tiện hỗ trợ để cải thiện sự tuân thủ quy tắc vô khuẩn khi thao tác. Nếu viêm phúc mạc phải tích cực điều trị.
- Hạn chế dùng dịch lọc ưu trương (glucose 4,25%), kiểm soát lượng nước nhập vào; dùng dịch lọc hòa hợp sinh học; nên dùng Icodextrin nếu sẵn có.
- Xét nghiệm đánh giá tính thấm màng bụng để kê đơn hợp lý.
6.2.6.4. Dự phòng mất chức năng thận tồn dư
- Tránh dùng các thuốc gây độc thận, như aminoglycosides, thuốc cản quang, NSAID.
- Cân nhắc dùng lợi tiểu quai liều cao để tăng lượng nước tiểu.
6.3.1. Chỉ định và chống chỉ định
6.3.1.1. Người nhận thận
Chỉ định cho tất cả bệnh nhân BTM giai đoạn cuối không có chống chỉ định ghép thận.
Chống chỉ định có thể là tuyệt đối (rất ít) hoặc tương đối
- Bệnh lý ác tính đang tiến triển.
- Nhiễm trùng không kiểm soát được do vi khuẩn, virus, nấm và ký sinh trùng.
- Bệnh mạch vành có chỉ định can thiệp nhưng chưa can thiệp, suy tim không hồi phục, suy hô hấp mạn tính nặng, bệnh gan đang tiến triển hoặc không hồi phục (viêm gan, xơ gan), rối loạn đông máu.
- Rối loạn tâm thần và không có khả năng tuân thủ điều trị.
- Lạm dụng thuốc gây nghiện, nghiện rượu.
- Kỳ vọng sống ngắn, nguy cơ phẫu thuật cao hơn lợi ích do ghép thận mang lại, không có khả năng hồi phục các chức năng của cơ thể sau ghép.
- Suy thận do 1 số bệnh di truyền (ví dụ tăng oxalate nguyên phát), có nguy cơ tái phát rất cao và nhanh sau ghép.
6.3.1.2. Người hiến thận
Nguồn thận để ghép có thể là
- Từ người sống: cùng huyết thống hoặc không cùng huyết thống.
- Từ người chết: chết não hoặc ngừng tuần hoàn.
Chỉ định
- Nguyên tắc: an toàn cho người hiến sống là ưu tiên cao nhất, cần tạo điều kiện tối ưu để chăm sóc sức khỏe dài hạn cho người hiến sống sau hiến thận. Không gây áp lực tài chính lên người hiến.
- Áp dụng giới hạn tuổi theo quy định hiện hành cho người hiến sống. Giới hạn tuổi được mở rộng hơn cho người hiến chết.
- Các chi tiết về chỉ định, chống chỉ định cho người hiến thận được cơ quan quản lý (Bộ Y tế) ban hành và theo sự đồng thuận của các chuyên gia y tế trong 1 số trường hợp.
6.3.2. Miễn dịch trong ghép thận
Hiện tại thận được ghép đồng loài. Các hàng rào miễn dịch truyền thống bao gồm kháng nguyên nhóm máu ABO và kháng nguyên hòa hợp mô chính (ở người là HLA).
Thông thường lựa chọn nhóm máu của người nhận và người hiến cần tuân theo quy luật truyền máu. Trường hợp khác nhóm máu phải tuân theo quy trình xử lý riêng.
Các kháng nguyên HLA quan trọng là A, B (lớp I) và DR (lớp II). Quy tắc lựa chọn người nhận và người hiến là càng ít bất tương hợp kháng nguyên HLA càng tốt.
Yếu tố nguy cơ miễn dịch trước ghép tăng lên khi người nhận có tiền sử truyền máu, phụ nữ đã mang thai hoặc người đã được ghép mô tạng trước đó. Người nhận được coi là có yếu tố nguy cơ miễn dịch cao trước ghép khi có sẵn kháng thể kháng HLA của người hiến.
Trước phẫu thuật ghép thận phải đánh giá nguy cơ miễn dịch và phân tầng mức độ nguy cơ để chọn phác đồ điều trị ức chế miễn dịch phù hợp trong và sau ghép thận.
Phải thực hiện test đọ chéo trước ghép và chỉ tiến hành ghép nếu test âm tính. Nếu test dương tính cần tuân thủ quy trình xử lý riêng.
Thải thận ghép là phản ứng tự nhiên của hệ thống miễn dịch người nhận, do thận ghép là mô lạ. Thải ghép có thể được phân loại thành: thải ghép tối cấp, thải ghép cấp tính nhanh, thải ghép cấp tính, và thải ghép mạn tính, dựa trên bệnh nguyên, bệnh sinh và lâm sàng. Người nhận thận cần phòng ngừa thải ghép bằng thuốc ức chế miễn dịch.
Liệu pháp ức chế miễn dịch được chia làm hai giai đoạn: điều trị khởi đầu và điều trị duy trì. Điều trị khởi đầu nhằm đạt hiệu quả ức chế miễn dịch hoàn toàn và nhanh chóng, tiến hành trước và trong tuần đầu sau ghép. Điều trị duy trì sử dụng thuốc phối hợp nhằm duy trì hiệu quả ức chế miễn dịch và làm giảm tối đa tác dụng phụ. Tham khảo các phác đồ cụ thể trong Hướng dẫn điều trị sau ghép thận.
6.3.3. Theo dõi bệnh nhân sau ghép thận
Giai đoạn sau phẫu thuật cần theo dõi chức năng thận ghép thông qua lưu lượng nước tiểu và tốc độ giảm urê, creatinine máu; tình trạng huyết động, cân bằng dịch, điện giải; tình trạng chảy máu, nhiễm trùng.
Giai đoạn ổn định cần duy trì được cân bằng giữa ức chế miễn dịch và khả năng tự vệ của cơ thể. Cần điều trị dự phòng hoặc tiêm vaccin chủ động các bệnh lý có thể phòng ngừa được.
Cần điều chỉnh liều thuốc ức chế miễn dịch và duy trì được nồng độ thuốc mục tiêu trong máu.
Điều trị các bệnh lý đi kèm; đặc biệt chú ý tầm soát chủ động bệnh lý ác tính, phát hiện sớm tổn thương thận ghép và xử trí theo nguyên nhân.
Luôn luôn giám sát và giáo dục BN sự tuân thủ điều trị, cung cấp đầy đủ thông tin cho nhân viên y tế về mọi vấn đề sức khỏe, hết sức cẩn trọng với sự tương tác thuốc.
6.3.4. Một số biến chứng sau ghép thận
Biến chứng ngoại khoa thường xảy ra ở giai đoạn sớm sau ghép, hay gặp chảy máu sau mổ, tắc mạch thận ghép, hẹp động mạch thận, rò nước tiểu, nhiễm khuẩn tại vùng mổ, tổn thương hệ bạch mạch, hẹp niệu quản ghép. Xử trí thường bằng ngoại khoa.
Thải ghép có thể xảy ra ở mọi giai đoạn sau ghép. Cần chẩn đoán và xử trí kịp thời để hạn chế tổn thương và mất chức năng thận ghép. Khi có thể, cần sinh thiết thận ghép để xác chẩn và theo dõi hiệu quả điều trị.
Nhiễm trùng thường gặp hơn ở BN sau ghép thận và có mức độ nặng hơn. Ngoài các nhiễm trùng thông thường, BN còn có nguy cơ mắc các bệnh nhiễm trùng cơ hội. Nguyên tắc điều trị là điều chỉnh mức độ ức chế miễn dịch để lập lại tình trạng cân bằng phối hợp sử dụng thuốc diệt vi trùng đặc hiệu phù hợp.
Bệnh lý tim mạch cần được chủ động phòng ngừa và/hoặc phát hiện; đây là nguyên nhân gây mất thận ghép và tử vong hàng đầu ở BN sau ghép thận. THA, vữa xơ mạch máu, các yếu tố nguy cơ gây bệnh tim mạch còn liên quan đến một số thuốc ức chế miễn dịch. Ngoài các chiến lược quản lý thông thường còn cần tránh ức chế miễn dịch quá mức hoặc lựa chọn phác đồ điều trị phù hợp với mỗi cá thể để giảm thiểu nguy cơ.
Một số biến chứng khác có thể gặp gồm: thiếu máu hoặc đa hồng cầu, giảm bạch cầu, giảm tiểu cầu, rối loạn chuyển hóa, bệnh lý ác tính v.v...
Quy trình tầm soát, chẩn đoán và xử trí các biến chứng, theo dõi BN dài hạn xin tham khảo hướng dẫn điều trị sau ghép thận
7. ĐIỀU TRỊ MỘT SỐ VẤN ĐỀ KHÁC Ở BTM
7.1. ĐIỀU TRỊ SUY TIM Ở BỆNH NHÂN BỆNH THẬN MẠN
Suy tim và BTM có mối quan hệ mật thiết và nhân quả, làm tăng nguy cơ nhập viện, tỉ lệ cần chăm sóc đặc biệt, điều trị thay thế và tỉ lệ tử vong. Yếu tố nguy cơ của suy tim ở BTM là:
- Tăng HA kéo dài và kiểm soát HA tồi
- Chế độ ăn quá tải muối và nước
- Phì đại và xơ hóa thất trái
- Nối thông động tĩnh mạch
- Bệnh động mạch vành
- Thiếu máu không kiểm soát tốt
7.1.2.1. Các bước chẩn đoán
- Chẩn đoán bằng siêu âm tim, đánh giá chức năng tâm thu bằng thang điểm của Hiệp hội siêu âm tim Hoa Kỳ từ 1 đến 4.
- Các marker sinh học BNP hoặc NT-proBNP: có giá trị dự báo âm tính nhiều hơn là chẩn đoán xác định, do khó phiên giải kết quả ở người mắc BTM
- Các thăm dò xâm lấn: thường dùng để chẩn đoán phân biệt suy tim với các tình trạng bệnh khác
7.1.2.2. Phân loại
- Suy tim có phân suất tống máu bảo tồn (EF ≥ 50%)
- Suy tim có phân suất tống máu giảm nhẹ (EF từ 41 - 49%)
- Suy tim có phân suất tống máu giảm (EF < 40%)
7.1.3.1. Dự phòng
- Kiểm soát chặt chẽ HA và đường máu: HA tâm thu mục tiêu nên <120mmHg; khuyến cáo sử dụng thuốc ức chế hệ RAA (ƯCMC hoặc ƯCTT angiotensin).
- Khuyến cáo sử dụng nhóm thuốc SGLT2i (Empagliflozin 10mg/ngày, Dapagliflozin 10mg/ngày) khi MLCT > 20ml/phút/1,73m2.
7.1.3.2. Điều trị suy tim
a. Thuốc ức chế hệ renin-angiotensin-aldosterone (RAASi)
- Sử dụng thuốc ƯCMC hoặc ƯCTT hoặc ức chế kép neprilysin và angiotensin cho BN suy tim EF giảm.
- Cân nhắc chỉ định cho BN suy tim EF giảm nhẹ và EF bảo tồn phù hợp.
- Các thuốc đối kháng thụ thể corticoid chuyển hóa muối khoáng (MRA) có hiệu quả tương đương ở 2 nhóm BN suy tim mắc BTM giai đoạn 3a-3b và suy tim không có BTM. Chưa có dữ liệu đáng tin cậy về hiệu quả sử dụng MRA để điều trị suy tim (EF bảo tồn/giảm) ở BN BTM giai đoạn 4-5.
b. Thuốc chẹn beta
Thuốc chẹn beta giao cảm gồm 3 nhóm:
- Thế hệ I: ức chế beta không chọn lọc (propranolol) có tác dụng hạ áp trung bình và không làm chậm nhịp tim mạnh như ức chế chọn lọc beta1 nhưng gây nhiều tác dụng phụ lên các hệ cơ quan khác (phổi, tiêu hóa)
- Thế hệ II: ức chế chọn lọc beta1 (metoprolol, bisoprolol, atenolol) có tác dụng chọn lọc lên tim, hạ áp nhanh, mạnh và giảm nhịp tim mạnh, không có lợi cho BN nhịp chậm
- Thế hệ III: ức chế chọn lọc beta1 và có tác dụng giãn mạch (nebivolol)
- Cần thận trọng khi sử dụng các thuốc chẹn beta đào thải phần lớn qua thận và có nguy cơ tích lũy như atenolol, nadolol, sotalol. Cần điều chỉnh liều cho BN lọc máu (ví dụ atenolol uống 3 lần/tuần để điều trị THA và bệnh lý mạch vành cho BN lọc máu).
c. Thuốc ức chế đồng vận chuyển Natri-Glucose 2 (SGLT2i)
Liều dùng cố định: Empagliflozin 10mg, Dapagliflozin 10mg
- Sử dụng SGLT2i (Dapagliflozin, Empagliflozin) cho BN suy tim EF giảm bất kể BN có ĐTĐ hay không và có MLCT ≥ 20ml/phút/1,73m2, đặc biệt những BN có uACR ≥ 25mg/mmol, loại trừ BN có bệnh thận đa nang hoặc đang sử dụng liệu pháp ƯCMD điều trị bệnh thận (1A)
- Khuyến cáo sử dụng SGLT2i ở BN suy tim có triệu chứng (không phân biệt phân suất tống máu) (1A)
- Nên chỉ định SGLT2i (Empagliflozin, Dapagliflozin) cho BN suy tim EF giảm nhẹ hoặc EF bảo tồn để giảm nhập viện do suy tim, tử vong tim mạch và tử vong chung.
d. Thuốc lợi tiểu
- Sử dụng lợi tiểu thiazide hoặc lợi tiểu quai giúp tăng thải muối nước, giảm triệu chứng ứ huyết do suy tim. Có thể tăng liều dần hoặc truyền tĩnh mạch liên tục lợi tiểu quai tùy theo tình trạng thừa dịch cho BN suy tim nặng hoặc phù phổi cấp.
- Thuốc đối vận thụ thể V2 chọn lọc của Vasopressin (Tolvaptan) có thể giúp giảm liều lợi tiểu quai, bảo vệ tổn thương thận, đặc biệt đối với BN suy tim cấp mất bù.
7.2. ĐIỀU TRỊ BỆNH MẠCH VÀNH Ở BỆNH NHÂN BỆNH THẬN MẠN
Bệnh nhân BTM có nguy cơ bệnh mạch vành cao hơn bởi tình trạng tăng urê máu, quá trình viêm, stress oxy hoá và rối loạn chuyển hoá khoáng xương. Triệu chứng lâm sàng của nhồi máu cơ tim cấp là đau ngực diển hình chỉ gặp ở 44% BN bị BTM giai đoạn từ 3a trở lên, so với 72% ở BN có chức năng thận bảo tồn.
Bệnh lý mạch vành chiếm 40-50% số tử vong ở BN lọc máu chu kì, trong đó 10-20% do nhồi máu cơ tim cấp, tỉ lệ tử vong là 29% trong năm đầu tiên và 52% trong năm thứ hai kể từ khi bắt đầu lọc máu.
7.2.2.1. Triệu chứng lâm sàng
Triệu chứng đau ngực thường không điển hình. Khó thở cũng không đặc hiệu bởi tình trạng thiếu máu, quá tải dịch hoặc toan chuyển hoá thường có ở những BN này.
7.2.2.2. Điện tâm đồ
Các biểu hiện gợi ý bệnh lý mạch vành trên điện tâm đồ như: sóng Q hoại tử, ST chênh bất thường, sóng T âm,…có giá trị chẩn đoán hạn chế vì những thay đổi không đặc hiệu của thất trái và sự rối loạn điện giải. Điện tâm đồ gắng sức có giá trị trong chẩn đoán bệnh mạch vành nhưng chưa đến 50% BN lọc máu chu kì hoàn thành được mục tiêu về nhịp tim do không đủ tình trạng thể lực để hoàn thành bài tập.
7.2.2.3. Các dấu ấn sinh học về tìm mạch
CK, CK-MB và troponin T có giá trị nền luôn tăng ở nhóm BN bị BTM. Nhiều nghiên cứu thống kê cho thấy 8-21% BN bị BTM có men CK và CK-MB bất thường, 10-30% có troponin T tăng nhưng không có bằng chứng tổn thương cơ tim. Việc theo dõi động học theo thời gian các dấu ấn sinh học này đóng vai trò quan trọng.
7.2.2.4. Cắt lớp vi tính (CT)
Chụp CT là công cụ có giá trị để đánh giá sự xuất hiện và tiến triển của tổn thương mạch vành, nhưng do thuốc cản quang có nguy cơ gây TTTC ở BN bị BTM, đây không phải là biện pháp chẩn đoán bệnh lý mạch vành tối ưu nhất ở bệnh nhân BTM giai đoạn nặng.
7.2.2.5. Siêu âm tim và test gắng sức sử dụng đồng vị phóng xạ
Đối với BN lọc máu, siêu âm tim gắng sức sử dụng dobutamine (DSE) có độ nhạy từ 75% đến 95%, độ đặc hiệu từ 76% đến 94% và độ chính xác là 90% để phát hiện tổn thương mạch vành. Đối với BN bị BTM giai đoạn cuối, giá trị bình thường của siêu âm tim gắng sức sử dụng dobutamine có giá trị dự báo âm tính biến cố mạch vành hoặc tử vong do bệnh mạch vành 97% khi theo dõi 12 ± 6 tháng. Đối với BN bị BTM giai đoạn cuối, test gắng sức bằng đồng vị phóng xạ dipyridamole có độ nhạy từ 80% đến 86%, độ đặc hiệu từ 73% đến 79% và giá trị dự báo âm tính 83% cho bệnh lý mạch vành.
7.2.2.6. Chụp mạch vành có xâm lấn
Chụp mạch vành là tiêu chuẩn vàng trong chẩn đoán bệnh mạch vành nhưng là phương pháp chẩn đoán xâm lấn, làm tăng nguy cơ xuất hiện TTTC do thuốc cản quang và làm tăng tỉ lệ BN phải lọc máu. Chụp mạch vành nên được chỉ định cho BN có nguy cơ cao, khi có triệu chứng gợi ý bệnh mạch vành, các test gắng sức dương tính hoặc tỉ lệ hồi phục cao từ việc tái thông mạch máu. Nên sử dụng thuốc cản quang có áp lực thẩm thấu bình thường để làm giảm nguy cơ TTTC do thuốc cản quang.
Aspirin, clopidogrel, chẹn beta giao cảm, ƯCMC, ƯCTT tỏ ra có hiệu quả tương đương giữa nhóm BN bị BTM và không bị BTM trong điều trị nhồi máu cơ tim. Cần chỉnh liều theo chức năng thận một số thuốc chống ngưng tập tiểu cầu và chống đông chuyển hoá qua thận. Không khuyến cáo sử dụng heparin trọng lượng phân tử thấp và eptifibatide ở BN bị BTM giai đoạn cuối.
7.2.3.1. Điều chỉnh rối loạn lipid máu
Chỉ định statin cho BTM giai đoạn sớm và chưa phải lọc máu. Cân nhắc ở BN có BTM tiến triển và/hoặc BTM giai đoạn cuối do chưa thấy mang lại lợi ích rõ rệt. Ưu tiên dùng atorvastatin và fluvastatin để giảm tác dụng không mong muốn (tiêu cơ vân, đỏ da, phát ban, giảm trí nhớ, tăng men gan,..) và giảm tỉ lệ TTTC do thuốc.
7.2.3.2. Điều trị tái tưới thông mạch máu
Chỉ định can thiệp tái thông mạch máu cho BN bị BTM có biểu hiện nhồi máu cơ tim cấp ST chênh lên tương tự như BN không bị BTM.
Chỉ định tái thông mạch máu ở BN bệnh mạch vành ổn định khi:
- Đau ngực dai dẳng mặc dù đã điều trị nội khoa tối ưu
- Tổn thương thân chung mạch vành trái, tổn thương 3 nhánh hoặc 2 nhánh bao gồm cả đoạn gần LAD
- Chỉ định tái thông mạch trong nhồi máu cơ tim cấp ST không chênh (NSTEMI):
- Chiến lược can thiệp sớm nếu đau ngực kháng trị, huyết động không ổn định, không có bệnh đồng mắc như BTM (mức độ chứng cứ A)
- Chiến lược can thiệp sớm không được khuyến cáo nếu có suy thận (IIIc)
- Chiến lược can thiệp có thể cân nhắc ở nhóm BTM giai đoạn từ 2 đến 3b
- So sánh lợi ích và nguy cơ giữa chụp mạch vành qua da (PCI) với bắc cầu nối chủ vành (CABG):
- Ở BN bị BTM không phải lọc máu:
+ Ngắn hạn: nguy cơ tử vong, đột quỵ, TTTC ở nhóm CABG cao hơn so với PCI
+ Dài hạn: nguy cơ tử vong tương tự nhưng tổn thương cơ tim và tỉ lệ cần tái thông lặp lại ở nhóm PCI cao hơn so với CABG
- Ở BN lọc máu chu kì:
+ Ngắn hạn: nguy cơ tử vong, đột quỵ ở nhóm CABG cao hơn so với PCI
+ Dài hạn: nguy cơ tử vong, tổn thương cơ tim và tỉ lệ cần tái thông lặp lại ở nhóm PCI cao hơn so với CABG
7.2.3.3. Sử dụng kháng tiểu cầu kép ở BN bị BTM
- Bệnh nhân bị BTM tiến triển có nguy cơ chảy máu và huyết khối cao hơn.
- Stent phủ thuốc mới (DES) có tỉ lệ tắc stent thấp hơn so với thế hệ cũ.
- Thời gian điều trị tối thiểu kháng tiểu cầu kép ở BN bệnh mạch vành ổn định hiện nay giảm xuống 6 tháng (3 tháng đối với nhóm nguy cơ chảy máu cao).
- Hiện có ít dữ liệu ủng hộ P2Y12 so với clopidogrel ở BN bị BTM.
- Giảm liều DOAC + P2Y12 so với liệu pháp 3 thuốc làm giảm nguy cơ chảy máu ở BN rung nhĩ cần can thiệp PCI
7.3. ĐIỀU TRỊ BỆNH ĐỘNG MẠCH NGOẠI VI Ở BỆNH NHÂN BTM
Bệnh động mạch ngoại vi (PAD) là tình trạng hẹp hoặc tắc nghẽn động mạch ngoại vi, căn nguyên chủ yếu do xơ vữa và huyết khối. Bệnh nhân BTM có nguy cơ mắc PAD cao hơn người có chức năng thận bình thường. Bên cạnh các yếu tố nguy cơ kinh điển của xơ vữa mạch máu như: tuổi, giới, hút thuốc lá, THA và rối loạn chuyển hóa lipid máu thì BN bị BTM còn có thêm các yếu tố khác thúc đẩy tiến triển PAD nhanh hơn như: quá trình viêm mạn tính, giảm albumin máu,…
7.3.2.1. Lâm sàng
Triệu chứng điển hình: đau chân cách hồi do thiếu máu chi (đau, nhức, chuột rút ở hai chi dưới xảy ra khi đi bộ, thuyên giảm khi nghỉ ngơi), thường xảy ra ở bắp chân nhưng có thể cả ở bàn chân, bắp đùi, hông, mông; hiếm gặp ở cánh tay.
7.3.2.2. Chỉ số ABI và TBI
Tỉ số huyết áp động mạch cổ chân/cánh tay (ABI) <0,9 khẳng định chẩn đoán PAD, ABI từ 0,9 đến 1,0 được coi là bất thường, gợi ý nguy cơ tình trạng thiếu máu bàn chân và tăng nguy cơ xảy ra biến cố thiếu máu ngoại vi. Chỉ số này không hoàn toàn đáng tin cậy ở BN bị BTM do tình trạng canxi hoá động mạch. Nếu lâm sàng có triệu chứng gợi ý PAD nên tiến hành các chẩn đoán hình ảnh khảo sát mạch máu.
Nếu ABI tăng (>1,3) thì đo HA tâm thu ở ngón chân và có thể sử dụng chỉ số HA động mạch ngón chân/cánh tay (TBI) để đánh giá mức độ và tình trạng nặng của PAD và dự đoán khả năng liền vết thương ở BN bị BTM có nghi ngờ thiếu máu chi.
7.3.2.3. Ghi thể tích mạch (Pulse volume recording)
Chỉ định khi BN có đau cách hồi. Có giá trị giúp định khu tổn thương, dự đoán hậu quả thiếu máu đoạn chi, theo dõi tưới máu chi; tuy nhiên có hạn chế trong việc định tính tưới máu, đặc biệt ở đoạn xa, có thể bất thường ở BN cung lượng tim thấp.
7.3.2.4. Siêu âm Doppler
Chỉ định cho bệnh nhân có biểu hiện đau cách hồi sau tái thông mạch máu
Giúp định vị giải phẫu chi dưới, đánh giá mức độ tiến triển của tình trạng thiếu máu thậm chí với tình trạng mạch máu khó đè xẹp.
7.3.2.5. Siêu âm Duplex
Chỉ định khi BN bị đau cách hồi, theo dõi tĩnh mạch ghép hậu phẫu, giả phình động mạch chày, động mạch khoeo và chậu.
Ưu điểm: khảo sát được hình thái, cấu trúc mạch máu và đánh giá được dòng chảy, giúp định vị vị trí tổn thương, ước tính mức độ hẹp.
Nhược điểm: độ chính xác bị giới hạn bởi tình trạng vôi hoá và độ nhạy thấp với chỗ hẹp ở đoạn gần.
7.3.2.6. Cộng hưởng từ mạch máu
Chỉ định khi nghi ngờ phình động mạch chủ hoặc theo dõi tiến triển, xem xét can thiệp động mạch.
Giá trị trong đánh giá giải phẫu và mức độ nặng của bệnh động mạch ngoại vi. Tuy nhiên không chính xác khi đoạn động mạch đã đặt stent kim loại
7.3.2.7. Cắt lớp vi tính mạch máu và DSA
Ưu điểm: giúp định vị chỗ hẹp rõ rệt, xem xét các tình huống tái thông và cung cấp thông tin chẩn đoán phối hợp, tuy nhiên giá trị chẩn đoán không bằng DSA. Tình trạng tĩnh mạch bắt cản quang có thể che lấp làm đầy động mạch và CLVT có nguy cơ gây tổn thương thận do thuốc cản quang.
7.3.3.1. Biện pháp không dùng thuốc
Bao gồm chế độ tập luyện, điều chỉnh chế độ ăn, bỏ hút thuốc. Nên bắt đầu các bài tập từ từ, tăng dần như đi bộ, các bài tập dành cho chân từ 3-4 lần/tuần, phương pháp này có thể làm giảm triệu chứng sau vài tháng. Chế độ ăn giảm chất béo bão hòa giúp góp phần làm giảm tình trạng xơ vữa mạch máu.
7.3.3.2. Biện pháp dùng thuốc
- Statin
Nên giảm cholesterol đến mức tối đa có thể.
LDL-C mục tiêu ở BN bị PAD là <100mg/dL (<2,59mmol/L), cần điều chỉnh rối loạn TG và HDL-C kèm theo.
LDL-C mục tiêu là <70mg/dL (<1,8mmol/L) ở BN có nguy cơ cao.
- Kiểm soát huyết áp
HA mục tiêu ở BN PAD là <140/90mmHg, đối với BN BTM là < 130/80mmHg. Có thể sử dụng các thuốc nhóm ƯCMC, ƯCTT, chẹn beta giao cảm, chẹn kênh calci để làm giảm các biến cố tim mạch nói chung cho BN PAD.
Thuốc chẹn beta giao cảm không bị chống chỉ định ở BN PAD khi sử dụng cho BN có bệnh lý mạch vành kèm theo.
- Thuốc chống ngưng tập tiểu cầu
Thuốc chống ngưng tập tiểu cầu (aspirin và clopidogrel) làm giảm các biến cố mạch máu ở bệnh nhân PAD, clopidogrel có hiệu quả cao hơn aspirin trong dự phòng bậc hai cho BN xơ vữa động mạch. Kết hợp aspirin và clopidogrel không làm gia tăng rõ rệt hiệu quả dự phòng nhưng lại làm tăng nguy cơ chảy máu.
- Cilostazol
Cilostazol là thuốc thuộc nhóm ức chế phosphodiesterase III với tác dụng giãn mạch, chuyển hóa và kháng tiểu cầu. Liều cilostazol trung bình là 100mg x 02 lần/ngày. Tác dụng không mong muốn của thuốc này bao gồm nhức đầu, tiêu chảy và hồi hộp. Bộ 3 kháng tiểu cầu (cilostazol, aspirin và clopidogrel) làm giảm biến cố tim mạch ở BN hội chứng vành cấp.
- Naftidrofuryl
Thuốc dùng cho điều trị đau cách hồi thuộc nhóm kháng 5-hydroxytryptamine typ 2, cải thiện chuyển hóa cơ và giảm ngưng tập tiểu cầu. Naftidrofuryl làm gia tăng khả năng đi bộ và chất lượng cuộc sống BN sau 3 đến 6 tháng.
- Chỉ định điều trị tái thông mạch máu theo AHA/ACC và TASC II
+ Cần can thiệp sớm khi BN thiếu máu chi nghiêm trọng như đau khi nghỉ, loét do thiếu máu, hoại thư.
+ BN không đáp ứng với điều trị thuốc và phục hồi chức năng
+ BN bị giới hạn hoạt động bởi triệu chứng đau cách hồi
7.4. LƯU Ý TRONG SỬ DỤNG THUỐC Ở BỆNH NHÂN BỆNH THẬN MẠN
Một số thuốc có thể gây tổn thương thận cấp thông qua giảm lưu lượng máu đến thận, giảm áp lực lọc cầu thận và viêm ống kẽ thận cấp. Một số loại thuốc có thể gây tác dụng phụ lên những cơ quan khác khi sử dụng ở BN BTM. Những thuốc có cơ chế gây tổn thương thận tương tự nhau có thể gây tác dụng hiệp đồng khi sử dụng đồng thời.
Bảng 38. Một số thuốc có nguy cơ gây độc thận
| Thuốc/ Nhóm thuốc | Cơ chế | Thuốc/ Nhóm thuốc | Cơ chế |
| Kháng sinh aminoglycoside | Tổn thương ống thận do ức chế ribosome, gốc oxy hóa | Kháng sinh cephalosporin | Tổn thương ống thận do quá mẫn, gây độc trực tiếp, bệnh trụ niệu do tinh thể |
| Vancomycin | Tổn thương ống thận do gây độc trực tiếp, viêm, gốc oxy hóa. Tổn thương trực tiếp cầu thận | Colistin | Tổn thương ống thận do gốc oxy hóa, viêm, colistin gắn màng phospholipid (-) |
| Amphotericin B | Tổn thương ống thận do gây độc trực tiếp, viêm, gốc oxy hóa. Tổn thương trực tiếp cầu thận | CNI | Co tiểu động mạch đến Tổn thương trực tiếp ống thận, gốc oxy hóa Xơ hóa khoảng kẽ |
| Thuốc ức chế RAAS | Giãn tiểu động mạch đi của cầu thận. Giảm áp suất nội cầu thận | Lợi tiểu | Giảm tưới máu thận do giảm thể tích tuần hoàn Viêm ống kẽ thận cấp Quá mẫn |
| Thuốc nhuộm màu nhóm azo gây tê niêm mạc đường tiết niệu | Tổn thương trực tiếp ống thận Tắc nghẽn ống thận do vi tinh thể | Kháng sinh quinilone | Bệnh ống thận do tinh thể |
| NSAID | Giảm tưới máu thận do ức chế tổng hợp prostaglandin | Kháng sinh penicillin | Tổn thương ống thận do quá mẫn, viêm. Hiếm gặp |
| Hợp chất chứa nguyên tố lithium | Tổn thương trực tiếp ống thận | Methotrexate | Giảm tưới máu thận. Tổn thương ống thận do gây độc trực tiếp. |
| Cisplatin | Tổn thương trực tiếp ống thận | Thuốc thảo dược |
|
| PPI | Chưa rõ ràng Tổn thương ống thận do toan hóa, rối loạn chuyển hóa Ca-P | Acyclovir | Bệnh ống thận do tinh thể |
| Thuốc cản quang | Giảm tưới máu thận do co mạch Tổn thương trực tiếp ống thận | Rifampin | Tổn thương trực tiếp ống thận, quá mẫn |
| TMP/SMX | Tổn thương trực tiếp ống thận Bệnh thận vi tinh thể Quá mẫn | Tetracyclin | Bệnh thận vi tinh thể Viêm ống kẽ thận cấp |
7.4.2. Các khuyến cáo về lưu ý trong sử dụng thuốc
- Tránh hoặc hạn chế tối đa việc sử dụng các thuốc có nguy cơ gây độc thận ở người mắc BTM, ưu tiên sử dụng các thuốc thay thế nếu có thể.
- BN sử dụng các thuốc có nguy cơ gây độc thận cần được theo dõi chức năng thận, MLCT, điện giải đồ và nồng độ thuốc định kỳ.
- Thường xuyên điều chỉnh liều các thuốc có nguy cơ gây độc thận dựa trên chức năng thận của BN.
- Người trưởng thành mắc BTM cần được bác sỹ tư vấn trước khi sử dụng các thuốc không kê đơn hoặc các loại thực phẩm chức năng bổ sung protein (đạm thận).
- Không sử dụng các bài thuốc dân gian thảo dược cho người mắc BTM. (1B)
- Nên tạm ngừng sử dụng các thuốc có nguy cơ gây độc thận và các thuốc thải trừ qua thận cho BN có MLCT < 60ml/phút/1,73m2 mắc kèm các bệnh lý nghiêm trọng do làm tăng nguy cơ TTTC. Một số thuốc hay gặp gồm: các thuốc ức chế RAAS (thuốc ức chế men chuyển, thuốc đối kháng thụ thể angiotensin, thuốc kháng aldosterone, thuốc ức chế renin trực tiếp), lợi tiểu, thuốc giảm đau chống viêm không steroid (NSAID), metformin, hợp chất chứa nguyên tố lithium, digoxin.
- Tránh hoặc hạn chế sử dụng các thuốc NSAID và ưu tiên sử dụng paracetamol thay cho NSAID để giảm đau ở người mắc BTM.
- Tránh hoặc hạn chế sử dụng kháng sinh nhóm aminoglycoside và vancomycin ở BN BTM.
- Hạn chế việc sử dụng thuốc cản quang chứa iod và thuốc đối quang từ chứa Gadolinium ở người mắc BTM (xem ở phần sau của hướng dẫn).
- Cần cân nhắc khi khởi trị thuốc đối kháng RAAS ở BN có MLCT <30 ml/phút/1,73m2; theo dõi định kỳ HA, chức năng thận và điện giải đồ cho BN đang điều trị thuốc ức chế RAAS, đặc biệt trong vòng 2 - 4 tuần kể từ khi bắt đầu khởi trị; ngừng sử dụng các thuốc ức chế RAAS nếu BN có tăng kali máu hoặc tăng creatinine máu >25% so với mức nền trước khi điều trị.
- Tránh sử dụng các thuốc CNI ở BN mắc BTM.
- Tránh sử dụng các thuốc chứa lithium ở BN BTM mắc rối loạn cảm xúc lưỡng cực.
- Metformin có thể được tiếp tục sử dụng cho BN có MLCT ≥ 45ml/phút/1,73m2; cân nhắc sử dụng cho BN có MLCT 30-44ml/phút/1,73m2; ngừng sử dụng cho BN có MLCT <30 ml/phút/1,73m2. (1C)
- Các thuốc ức chế bơm proton nên được sử dụng cho người mắc BTM với liều tối thiểu và trong thời gian ngắn nhất có thể.
- Tránh sử dụng thuốc chống nấm amphotericin B (ở mọi dạng bào chế) cho người mắc BTM.
- Tránh sử dụng thuốc điều trị ung thư cisplatin cho người mắc BTM.
7.5. SỬ DỤNG THUỐC CẢN QUANG CHỨA IOD Ở BỆNH NHÂN BỆNH THẬN MẠN
Các kỹ thuật sử dụng thuốc cản quang chứa iod bị hạn chế và chống chỉ định trong nhiều trường hợp BN có BTM hoặc TTTC do lo ngại nguy cơ xuất hiện “tổn thương thận cấp do thuốc cản quang (CI-AKI).”
Thuật ngữ “tổn thương thận cấp liên quan đến thuốc cản quang (CA-AKI)” hoặc “tổn thương thận cấp sau sử dụng thuốc cản quang (PC-AKI)” được sử dụng nhiều hơn trong các khuyến cáo gần đây. Tình trạng này được định nghĩa là tổn thương thận cấp do mọi nguyên nhân xuất hiện trong vòng 48 giờ sau khi sử dụng thuốc cản quang.
7.5.2. Các yếu tố nguy cơ của CA-AKI và CI-AKI
- Tiền sử BTM và MLCT. MLCT càng thấp, nguy cơ CA-AKI và CI-AKI càng cao.
- Đái tháo đường, các thuốc gây độc cho thận, tụt HA, thiếu dịch, albumin niệu và suy tim sung huyết.
- Thuốc cản quang có độ thẩm thấu cao (HOCM) (1500 - 2000 mOsm/kg H2O) có nguy cơ gây TTTC cao nhất. Thuốc cản quang có độ thẩm thấu thấp (LOCM) (600 - 900 mOsm/kg H2O) hay có độ thẩm thấu đẳng trương (IOCM) (290 mOsm/kg H2O) có nguy cơ gây TTTC thấp hơn so với HOCM.
7.5.3. Đối tượng cần điều trị dự phòng trước khi sử dụng thuốc cản quang
- Cần đánh giá MLCT trước khi sử dụng thuốc cản quang thường quy cho tất cả BN có tiền sử mắc bệnh thận (BTM, TTTC, phẫu thuật thận, can thiệp đốt bán phần thận, bệnh nhân có albumin niệu).
- ĐTĐ là yếu tố để cân nhắc việc đánh giá MLCT trước khi sử dụng thuốc cản quang.
- Chỉ định điều trị dự phòng cho tất cả BN đang có TTTC hoặc BN BTM có MLCT < 30ml/phút/1,73m2 chưa phải lọc máu chu kỳ.
- Không chỉ định điều trị dự phòng cho BN có MLCT ổn định ≥ 30ml/phút/1,73m2, BN lọc máu chu kỳ, BN có nguy cơ suy tim.
- Cân nhắc điều trị dự phòng cho BN có nguy cơ cao (có nhiều yếu tố nguy cơ, TTTC gần đây, MLCT ở giá trị giáp ranh), BN có MLCT 30 - 44ml/phút/1,73m2.
- Nếu cần sử dụng thuốc cản quang khẩn cấp, nên tiến hành điều trị dự phòng sớm, ngay sau thủ thuật có tiêm thuốc cản quang.
- MLCT < 30ml/phút/1,73m2 không phải chống chỉ định tuyệt đối của sử dụng thuốc cản quang, tùy thuộc việc cân nhắc lợi ích và nguy cơ.
- Bệnh nhân đang lọc máu chu kỳ hoặc lọc màng bụng có nước tiểu tồn dư > 100mL/ngày nên được cân nhắc điều trị dự phòng như những BN có MLCT < 30ml/phút/1,73m2 nhằm bảo tồn tối đa chức năng thận tồn dư, tuy nhiên cần thận trọng do nguy cơ quá tải dịch.
- Bệnh nhân có thận đơn độc (thiểu sản 1 thận bẩm sinh, cắt thận, thận ghép) nên được điều trị dự phòng tùy theo MLCT, tương tự như BN có đủ 2 thận. Việc đánh giá nguy cơ CA-AKI phụ thuộc vào chức năng thận (MLCT) và bệnh cảnh lâm sàng (TTTC, yếu tố nguy cơ).
7.5.4. Các phương pháp điều trị dự phòng
- Bác sỹ lâm sàng và bác sỹ điện quang cần thảo luận về lợi ích và nguy cơ khi sử dụng thuốc cản quang, các phương pháp thay thế (nếu có).
- Tránh sử dụng các thuốc cản quang có độ thẩm thấu cao (HOCM)
- Dùng liều thuốc cản quang thích hợp đảm bảo mục đích chẩn đoán và điều trị.
- Tránh dùng thuốc cản quang lần 2 trong 48 giờ kể từ lần tiêm thuốc trước ở BN nguy cơ cao (MLCT ≤ 30ml/phút/1,73m2, thuốc cản quang đường động mạch). Không có khuyến cáo hạn chế đối với bệnh nhân nguy cơ thấp (MLCT > 30ml/phút/1,73m2, không bị TTTC, thuốc cản quang dùng đường tĩnh mạch).
- Ngừng các thuốc có nguy cơ gây độc thận 24 - 48 giờ trước và 48 giờ sau khi dùng thuốc cản quang, ví dụ: thuốc giảm đau chống viêm không steroid (NSAID), lợi tiểu, kháng sinh nhóm aminoglycoside, amphotericin B, platin, zoledronate, methotrexate.
- Nên cân nhắc tạm ngừng các thuốc ức chế RAAS 48 giờ trước khi tiêm thuốc cản quang. Các thuốc này có thể được sử dụng lại nếu CA-AKI không xảy ra hoặc sau khi chức năng thận hồi phục lại mức nền. Ở những BN đã dùng nhóm thuốc này lâu dài, nguy cơ CA-AKI cao hơn nếu không ngừng thuốc. Mối quan hệ này không được ghi nhận ở BN mới sử dụng thuốc ức chế RAAS.
- Metformin không làm tăng nguy cơ CA-AKI nhưng làm tăng nguy cơ nhiễm toan lactic nếu xảy ra TTTC. Do đó, nên tạm ngừng metformin ở BN có MLCT < 30ml/phút/1,73m2. Có thể cân nhắc tạm ngừng metfformin cho BN có MLCT 30 - 59 ml/phút/1,73m2 nếu có nguy cơ cao. Chỉ sử dụng lại metformin sau ít nhất 48 giờ nếu creatinine máu tăng ít hơn 25% so với mức nền.
- Khuyến cáo bù dịch đẳng trương NaCl 0,9%, tuy nhiên chưa có khuyến cáo thông nhất về thời điểm tối ưu, thể tích dịch truyền, tốc độ truyền dịch. Phác đồ thường được áp dụng như sau:
+ Thời gian: bù dịch trước tiêm thuốc cản quang 1 giờ và tiếp tục trong vòng 3- 12 giờ sau tiêm thuốc.
+ Lượng dịch bù: 1 - 3mL/kg/h
- Dịch natri bicarbonate có vẻ có hiệu quả tương đương NaCl 0,9%
- N-acetyl cysteine, Statin, lọc máu cấp cứu và lọc máu liên tục hiện không được khuyến cáo cho dự phòng CA-AKI.
- Cần đánh giá MLCT trong vòng 48 - 72 giờ sau khi dùng thuốc cản quang.
Bảng 39. Chỉ định sử dụng thuốc cản quang tĩnh mạch
| Phương pháp chụp | Cần dùng thuốc cản quang | Không cần dùng thuốc cản quang |
| CT sọ não | Chụp mạch não, u não, viêm màng não, viêm não, tổn thương thần kinh khu trú, bệnh lý nền sọ, bệnh lý nhãn cầu, tuyến yên, bệnh xoang mũi phức tạp, động kinh | Chấn thương sọ não, nhồi máu não, xuất huyết não |
| CT cột sống | Khối bất thường ở cột sống, nghi ngờ u hoặc viêm, bất thường thần kinh sọ số X, XI, XII và đám rối cánh tay | Chấn thương cột sống trừ khi có nghi ngờ tổn thương động mạch hoặc vết thương xuyên thấu |
| CT ngực | Tổn thương tim và mạch máu trong ngực, chấn thương, phân độ ung thư phổi | Đánh giá vôi hóa động mạch vành, bệnh lý nhu mô phổi |
| CT bụng và tiểu khung | Hầu hết các bệnh lý ống tiêu hóa, gan, mật, tụy, thận tiết niệu, phụ sản | Sỏi tiết niệu, CT đại tràng |
| CT hệ cơ xương | Khối vùng mô mềm, nghi ngờ viêm khớp nhiễm khuẩn, nhiễm khuẩn chi giả | Phần lớn các trường hợp |
| Chụp dựng hình mạch | Đánh giá nội mạch, giả phình, tách thành, tưới máu cơ quan đích, điểm chảy máu hoạt động | Theo dõi tiến triển ổ phình mạch đã biết, phát hiện ổ tụ máu |
Bảng 40. Khuyến cáo về sử dụng thuốc cản quang chứa iod
| Khuyến cáo | KDIGO 2012 | ACR 2018 | ACR-NKF 2021 |
| 1. Thuật ngữ CA-AKI và PC-AKI được khuyến cáo sử dụng do nhiều trường hợp TTTC có liên quan nhưng không phải do thuốc cản quang. | Đã đề cập đến những nguyên nhân khác |
|
|
| 2. CI-AKI chỉ có thể được chẩn đoán chính xác trong bối cảnh nghiên cứu bệnh chứng ghép cặp tốt. | X | X |
|
| 3. Tiêu chuẩn của KDIGO được sử dụng để chẩn đoán TTTC và BTM. |
| Tiêu chuẩn AKIN |
|
| 4. Tỉ lệ thực tế CI-AKI thấp hơn những nhận định trước đây. Nếu không có lựa chọn thay thế, việc sử dụng thuốc cản quang tĩnh mạch không nên bị hạn chế chỉ dựa vào nguy cơ CI-AKI. |
|
|
|
| 5. Nguy cơ CI-AKI nên được đánh giá chủ yếu dựa vào giai đoạn BTM và tình trạng TTTC. Người có nguy cơ cao là BN có TTTC mới xảy ra gần đây, MLCT < 30ml/phút/1,73m2, BN lọc máu chu kỳ hoặc lọc màng bụng còn tiểu > 100mL/ngày. | Nguy cơ cao khi MLCT < 45 ml/phút/1,73m2 |
|
|
| 6. Sàng lọc chức năng thận được chỉ định để phát hiện BN có nguy cơ cao bị CI-AKI. Cần sàng lọc chức năng thận cho BN có tiền sử BTM, TTTC, phẫu thuật thận, đốt bán phần thận. | Thêm tuổi, ĐTĐ, THA, đa u tủy xương, Gout, protein niệu | Thêm tuổi, ĐTĐ, THA |
|
| 7. Trao đổi giữa bác sỹ lâm sàng và bác sỹ điện quang về lợi ích và nguy cơ của thuốc cản quang có thể hữu ích cho BN có nguy cơ CI-AKI cao | X | X |
|
| 8. Không có sự khác biệt về lâm sàng đối với nguy cơ CI-AKI giữa LOCM và IOCM |
|
|
|
| 9. Dự phòng bằng NaCl 0,9% truyền tĩnh mạch được chỉ định cho BN có MLCT < 30 ml/phút/1,73m2 hoặc BN bị TTTC. Với BN có nguy cơ cao, cần cân nhắc dự phòng cho BN có MLCT 30 - 44 ml/phút/1,73m2 | Dự phòng khi MLCT < 45 ml/phút/1,73m2 bằng NaCL 0,9% hoặc bicarbonate; cân nhắc NAC | Dự phòng khi MLCT <30 |
|
| 9. Dự phòng bằng NaCl 0,9% truyền tĩnh mạch được chỉ định cho BN có MLCT < 30 ml/phút/1,73m2 hoặc BN bị TTTC. Với BN có nguy cơ cao, cần cân nhắc dự phòng cho BN có MLCT 30 - 44 ml/phút/1,73m2 | Dự phòng khi MLCT < 45 ml/phút/1,73m2 bằng NaCL 0,9% hoặc bicarbonate; cân nhắc NAC | Dự phòng khi MLCT <30 |
|
| 10. Không chỉ định dự phòng cho BN có MLCT ổn định ≥ 45 ml/phút/1,73m2 | Chỉ định dự phòng chưa rõ khi MLCT 45 - 59 ml/phút/1,73m2 | Không khuyến cáo khi MLCT ≥ 30 ml/phút/1,73m2 |
|
| 11. Việc điều trị thay thế thận không nên được chỉ định hoặc thay đổi lịch chỉ vì mục đích dự phòng sau sử dụng thuốc cản quang |
|
|
|
| 12. Thận đơn độc không phải là yếu tố độc lập quyết định nguy cơ CI- AKI | X | X |
|
| 13. Ở BN có nguy cơ CI-AKI cao, không nên chủ động giảm liều thuốc cản quang sử dụng xuống dưới 1 ngưỡng nhất định. Thay vào đó, liều tối thiểu trên lâm sàng nhằm đảm bảo hiệu quả can thiệp nên được sử dụng. | Khuyến cáo giảm liều | X |
|
| 14. Nếu có thể, nên tạm ngừng các thuốc gây độc cho thận ở những BN có nguy cơ cao |
| X |
|
| 15. Dữ liệu về CI-AKI ở BN nhi khoa chủ yếu được ngoại suy từ người trưởng thành. Những nghiên cứu trên đối tượng này còn chưa đáp ứng được nhu cầu thực tế. | X |
|
|
| KDIGO: Kidney Disease Improving Global Outcomes; ACR: American College of Radiology; NKF: National Kidney Foundation; AKIN: Acute Kidney Injury Network; NAC: N-acetyl cysteine | |||
7.6. SỬ DỤNG THUỐC ĐỐI QUANG TỪ CHỨA GADOLINIUM Ở BỆNH NHÂN BỆNH THẬN MẠN
7.6.1.1. Gadolinium
Gadolinium là một kim loại được sử dụng trong hầu hết các thuốc đối quang từ vì nó có tính thuận từ mạnh giúp phân biệt tổ chức bình thường và tổ chức bất thường.
Gadolinium được tạo phức với các phối tử hữu cơ nhằm giảm độc tính, tạo thành các thuốc đối quang từ chứa Gadolinium (TĐQTCG). TĐQTCG chủ yếu phân bố ở dịch ngoại bào, ít gắn với protein và chủ yếu bài tiết qua nước tiểu. Tuy nhiên, một số TĐQTCG gắn kết với protein rõ rệt hơn và/hoặc bài tiết một phần qua mật.
7.6.1.2. Bệnh xơ hóa toàn thể do thận (nephrogenic systemic fibrosis - NSF)
Bệnh xơ hóa toàn thể do thận là tình trạng xơ hóa toàn thân có khả năng gây suy nhược và có thể dẫn đến tử vong xảy ra ở những BN bị TTTC hoặc BTM giai đoạn 4,5 (MLCT < 30ml/phút/1,73m2). Biểu hiện lâm sàng: thường xuất hiện ở da và tổ chức dưới da (da dày lên, ngứa, thay đổi sắc tố) và một số trường hợp có thể xơ hóa tiến triển các cơ quan khác như thực quản, tim, phổi, hệ cơ xương. Chẩn đoán xác định dựa vào sinh thiết cơ quan tổn thương (hay sử dụng nhất trên lâm sàng là sinh thiết da).
7.6.1.3. Phân loại TĐQTCG
Bảng 41. Phân loại thuốc TĐQTCG dựa theo nguy cơ NSF
| Nhóm | Tên hoạt chất | Cấu trúc | Đặc điểm |
| I | Gadodiamide | Mạch hở Điện tích trung hòa | Liên quan đến số lượng lớn nhất BN bị NSF, tương ứng là 70%, 4,8% và 20% với các hoạt chất Gadodiamide, Gadoversetamid, Gadopentetate dimeglumine. Nhóm TĐQTCG này không còn được lưu hành trên thị trường Hoa Kỳ và châu Âu |
| Gadopentetate dimeglumine | Mạch hở Mang điện tích | ||
| II | Gadobenate dimeglumine | Mạch hở Mang điện tích | - Liên quan đến một vài ca bệnh NSF được báo cáo. - Một nghiên cứu phân tích hệ thống trên 4931 BN NSF, không ghi nhận BN nào sử dụng TĐQTCG nhóm II |
| Gadobutrol | Vòng lớn Điện tích trung hòa | ||
| Gadoterate meglumine | Vòng lớn Mang điện tích | ||
| III | Gadoxetate disodium | Mạch hở Mang điện tích | - Dữ liệu nghiên cứu còn hạn chế do sử dụng chưa đủ nhiều. - Gadoxetate disodium chủ yếu được sử dụng để phát hiện các tổn thương gan |
7.6.2. Khuyến cáo sử dụng thuốc đối quang từ ở bệnh nhân BTM
- BN đang điều trị thay thế thận, TTTC, BTM giai đoạn 4-5 sử dụng TĐQTCG nhóm I (đặc biệt khi sử dụng liều cao) có nguy cơ mắc NSF cao nhất.
- Nguy cơ mắc NSF khác nhau giữa các nhóm TĐQTCG: Nhóm I nguy cơ cao nhất; nhóm II nguy cơ rất thấp; nhóm III nguy cơ thấp nhưng chưa đủ bằng chứng.
- Nguy cơ mắc NSF tăng lên nếu sử dụng TĐQTCG nhóm I với liều lượng lớn hơn. Nguy cơ liên quan đến liều của nhóm II và III vẫn chưa được báo cáo, tuy nhiên nên sử dụng liều TĐQTCG thấp nhất có thể.
- Không nên trì hoãn sử dụng TĐQTCG nhóm II nếu chỉ định chụp cộng hưởng là cần thiết.
- Không bắt buộc sàng lọc chức năng thận nếu sử dụng TĐQTCG nhóm II nhưng bắt buộc nếu sử dụng TĐQTCG nhóm III.
- Không cần hội chẩn giữa bác sỹ điện quang và bác sỹ lâm sàng khi sử dụng TĐQTCG nhóm II, nhưng cần hội chẩn nếu sử dụng TĐQTCG nhóm III, đặc biệt ở BN có MLCT < 30ml/phút/1,73m2 hoặc BN có TTTC.
- Nguy cơ mắc NSF rất thấp với liều tiêu chuẩn (0,1mmol/kg) TĐQTCG nhóm II ngay cả ở BN có MLCT < 30ml/phút/1,73m2 hoặc BN bị TTTC.
- Không có chỉ định điều trị dự phòng NSF, nên chờ chức năng thận hồi phục trước khi sử dụng TĐQTCG và nên sử dụng TĐQTCG nhóm II.
- Không sử dụng lọc máu hoặc thay đổi kế hoạch lọc máu khi sử dụng TĐQTCG nhóm II và III.
- Sử dụng liều lượng theo hướng dẫn sử dụng của TĐQTCG nhóm II và III không có nguy cơ gây tổn thương thận đáng kể trên lâm sàng.
- Nếu BN có chỉ định sử dụng TĐQTCG nhóm II và III nhiều lần, không nên trì hoãn sử dụng. Nếu chỉ định chụp cộng hưởng từ có thể trì hoãn thì nên trì hoãn 24 tiếng hoặc thực hiện lọc máu để thúc đẩy quá trình thải TĐQTCG.
- Các khuyến cáo trên vẫn được áp dụng cho BN đang dùng thuốc độc cho thận, BN hóa trị liệu hoặc đang sử dụng thuốc cản quang.
- Các khuyến cáo trên vẫn được áp dụng cho BN nhi. Nguy cơ mắc NSF ở trẻ em là thấp, dù dữ liệu còn hạn chế. Nên sử dụng công thức Bedside Schwartz hoặc công thức CKiD dựa vào creatinine - cystatin C để đánh giá MLCT ở trẻ em.
7.7. CHỈNH LIỀU THUỐC Ở BỆNH NHÂN BỆNH THẬN MẠN
Điều chỉnh liều thuốc cho BN bị BTM là một vấn đề cần được quan tâm trong thực hành lâm sàng. Mức lọc cầu thận (MLCT) và độ thanh thải creatinine (CrCl) là 2 chỉ số chính được sử dụng để hướng dẫn điều chỉnh liều thuốc, tùy thuộc vào nghiên cứu dược động học được thực hiện với mỗi loại thuốc khác nhau.
7.7.2. Các công thức thường được sử dụng để đánh giá chức năng thận
7.7.2.1. Công thức Cockcroft-Gault
Công thức này ước tính CrCl và cho kết quả cao hơn MLCT thực tế do một phần creatinine trong nước tiểu được ống thận bài tiết. Kết quả không được hiệu chỉnh theo diện tích bề mặt cơ thể, không áp dụng được cho BN quá thừa cân hoặc suy kiệt, trẻ dưới 18 tuổi và phụ nữ có thai. Để ước tính chính xác hơn, có thể tính công thức Cockcroft-Gault với cân nặng lí tưởng hoặc hiệu chỉnh theo diện tích da.
7.7.2.2. Công thức MDRD (Modification of Diet in Renal Disease)
Công thức này có hiệu chỉnh MLCT theo diện tích cơ thể và cho kết quả chính xác hơn so với Cockcroft-Gault nhưng không áp dụng cho trẻ dưới 18 tuổi hay người trên 85 tuổi. Trong các nghiên cứu, MDRD ước tính chính xác nhất khi MLCT < 60 ml/phút/1,73 m2 da.
7.7.2.3. Công thức CKD-EPI
CKD-EPI ước tính MLCT chính xác hơn MDRD ở người có MLCT ≥ 60 ml/phút/1,73 m2 da và không có bệnh thận trước đó.
Trong thực hành lâm sàng, công thức Cockcroft-Gault vẫn hay được sử dụng để hiệu chỉnh liều thuốc vì dễ tính toán, nhiều tài liệu hướng dẫn sử dụng của các nhà sản xuất thuốc vẫn dựa vào độ thanh thải creatinine tính theo Cockcroft-Gault, và liều thuốc không khác biệt nhiều khi điều chỉnh theo Cockcroft-Gault hay MDRD.
Các bác sĩ lâm sàng cần chọn phương pháp/công cụ phù hợp nhất để đánh giá chính xác nhất chức năng thận cho BN, cần sử dụng MLCT làm tiêu chuẩn để phân giai đoạn bệnh và hiệu chỉnh liều thuốc. Đối với BN bị TTTC cần đánh giá động học.
7.7.3. Các phương pháp chỉnh liều thuốc ở bệnh nhân BTM
7.7.3.1. Giảm liều: áp dụng cho
- Thuốc có khoảng điều trị hẹp (ví dụ: Digoxin)
- Thuốc có thời gian bán thải (T1/2) ngắn và không tăng lên ở BN suy thận (penicillin)
- Thuốc cần đạt được nồng độ tối thiểu hoặc không đổi trong huyết tương khi điều trị nên khoảng cách dùng thuốc phải không được thay đổi để duy trì nồng độ
7.7.3.2. Tăng khoảng cách giữa các lần đưa thuốc: áp dụng cho
- Thuốc có phạm vi điều trị rộng.
- Thuốc có tác dụng điều trị phụ thuộc vào nồng độ đỉnh (Cmax) đạt được.
- Thuốc có độc tính hoặc T1/2 tăng lên (ví dụ: gentamicin).
7.7.3.3. Kết hợp giảm liều và tăng khoảng cách giữa các lần đưa thuốc
- Thường hay được áp dụng, nhằm đảm bảo nồng độ điều trị và thuận tiện cho việc sử dụng. Ví dụ việc dùng một thuốc ở liều bình thường sau mỗi 15 giờ sẽ khó đảm bảo dùng thuốc đúng giờ, vì vậy giảm liều và chuyển sang dùng thuốc mỗi 12 giờ sẽ hợp lý hơn (cephalosporin, metronidazol)
7.7.4. Các bước thực hiện chỉnh liều thuốc cho bệnh nhân BTM
Bước 1. Tìm hiểu tiền sử bệnh và đánh giá lâm sàng người bệnh: thông tin nhân khẩu học, tiền sử bệnh đặc biệt là bệnh thận, tình trạng lâm sàng và xét nghiệm hiện tại.
Bước 2. Đánh giá chức năng thận: chọn công cụ phù hợp nhất để đánh giá MLCT hoặc CrCl cho BN dựa trên loại thuốc cần sử dụng, tuổi, diện tích cơ thể, chủng tộc và bệnh đồng mắc.
Bước 3. Xem lại các thuốc BN đang sử dụng: xác định thuốc cần chỉnh liều theo chức năng thận, cần chỉnh liều theo độ thanh thải creatinine hay MLCT, ví dụ các thuốc kháng sinh thường được chỉnh liều theo CrCl.
Bước 4. Cá thể hóa điều trị: xác định mục tiêu điều trị; tính toán phác đồ liều lượng dựa trên đặc điểm dược động học của thuốc, MLCT hoặc CrCl.
Bước 5. Theo dõi: theo dõi định kỳ các thông số về phản ứng và độc tính của thuốc, nồng độ thuốc (nếu định lượng được) đặc biệt là với các thuốc có cửa sổ điều trị hẹp.
Bước 6. Sửa đổi phác đồ: điều chỉnh phác đồ dựa trên đáp ứng, sự thay đổi tình trạng BN (bao gồm cả chức năng thận), tương tác thuốc. Nếu cần tạm ngừng thuốc phải lên kế hoạch dùng lại hoặc tạm thay để dự phòng biến chứng.
7.7.5. Liều lượng một số thuốc dựa trên chức năng thận
Bảng 42. Chỉnh liều một số thuốc kháng sinh theo độ thanh thải creatinine (CrCl)
| Thuốc | Liều điển hình (có thể thay đổi) | CrCL (ml/phút) | Chỉnh liều |
| Acyclovir IV | 5-10 mg/kg mỗi 8h | >50 | 5-10 mg/kg mỗi 8h |
| 25-50 | 5-10 mg/kg mỗi 12h | ||
| 10-24 | 5-10 mg/kg mỗi 24h | ||
| <10 hoặc lọc máu | 2,5-5 mg/kg mỗi 24h | ||
| Acyclovir PO (herpes sinh dục) | 200 mg 5lần/ngày | >10 | 200 mg 5 lần/ ngày |
| <10 | 200 mg mỗi 12h | ||
| Acyclovir PO (herpes zona) | 800 mg 5lần/ngày | >25 | 800 mg 5 lần/ ngày |
| 10-25 | 800 mg mỗi 8h | ||
| <10 hoặc lọc máu | 800 mg mỗi 12h | ||
| Amikacin | Chế độ liều giãn cách: 15 mg/kg, 1 lần/ngày Chế độ đa liều mỗi ngày: 5mg/kg, mỗi 8h Khuyến cáo theo dõi nồng độ thuốc trong huyết tương |
| Chế độ liều giãn cách thường dùng, xác định bởi các mức độ/ biểu đồ Hartford Chế độ đa liều mỗi ngày: CrCl 51-90: 60-90% TM mỗi 12h CrCl 10-50: 30-70% TM mỗi 12-18h CrCl <10: 20-30% TM mỗi 24-48h |
| Amoxicillin | 500-1000 mg mỗi 12h | >30 | 500-1000 mg mỗi 12h |
| 10-30 | 250-875 mg mỗi 12h | ||
| <10 hoặc lọc máu | 250-875 mg mỗi 24h | ||
| Amoxicillin (Viêm phổi) | 1 g mỗi 8 h | >30 | 1 g mỗi 8 h |
| 10-30 | 1 g mỗi 12 h | ||
| <10 hoặc lọc máu | 1 g mỗi 24 h | ||
| Amoxicillin / Clavulanate | 500-1000 mg mỗi 12h | >30 | 500-1000 mg mỗi 12h |
| 10-30 | 250-500 mg mỗi 12h | ||
| <10 hoặc lọc máu | 250-500 mg mỗi 24h | ||
| Ampicillin / Sulbactam | 1,5-3 g mỗi 6h | ≥30 | 1,5-3 g mỗi 6h |
| 15-29 | 1,5-3 g mỗi 12h | ||
| ≤14 hoặc lọc máu | 1,5-3 g mỗi 24h | ||
| Ampicillin / Sulbactam (Acinetobacter, E. faecalis) | 3 g mỗi 4h | ≥50 | 3 g mỗi 4h |
| 10-50 | 3 g mỗi 6h | ||
| Lọc máu | 3 g mỗi 8h | ||
| Cefaclor | 250mg mỗi 8h (Tối đa: 4g/ngày) | ≥ 10 | liều bình thường |
| <10 | 250mg mỗi 8h | ||
| Cefixime | 200-400mg/ngày (1 lần hoặc 2 lần/ngày) | ≥ 10 | liều bình thường |
| <10 | 200mg/ngày | ||
| Cefotaxim | NK nhẹ: 1g mỗi 12h NK trung bình: 1g mỗi 8h NK nặng: 2g mỗi 6h NK nguy hiểm tính mạng: có thể đến 12g/ngày chia 3-4 lần | ≥ 10 | liều bình thường |
| <10 | 1g mỗi 8-12h | ||
| Cefuroxim (tiêm) | 750mg - 1500mg mỗi 6-8h Viêm màng não : 3g mỗi 8h | 20-50 | 750mg-1,5g mỗi 8h |
| 10-20 | 750mg-1,5g mỗi 8-12h | ||
| <10 | 750mg-1,5g mỗi 12-24h | ||
| Cefpodoxime | 100-400mg mỗi 12h | ≥30 | 100-400 mg mỗi 12h |
| <30 | 100-400 mg mỗi 24h | ||
| Lọc máu | 100-400 mg 3 lần/tuần | ||
| Ceftazidime | 1-2g mỗi 8h Điều trị Pseudomonas | >50 | 1-2 g mỗi 8h |
| 30-50 | 1-2 g mỗi 12h | ||
|
| 2 g mỗi 8h | 15-29 | 1-2 g mỗi 24h |
| <15 hoặc lọc máu | 1 g mỗi 24h | ||
| Cephalexin | 500 mg uống mỗi 6h | >50 | 500 mg mỗi 6h |
| 10-50 | 500 mg mỗi 8h | ||
| <10 hoặc lọc máu | 500 mg mỗi 12h | ||
| Ciprofloxacin tĩnh mạch | 400 mg mỗi 8-12h | ≥30 | 400 mg mỗi 8-12h |
| <30 hoặc lọc máu | 400 mg mỗi 24h | ||
| Ciprofloxacin đường uống | 250-750mg mỗi 12h | ≥30 | 250-750mg mỗi 12h |
| <30 hoặc lọc máu | 250-500mg mỗi 24h | ||
| Clarithromycin | 250-500mg mỗi 12h | ≥30 | 250-500mg mỗi 12h |
| <30 | 250-500mg mỗi 24h | ||
| Colistin | 2,5 mg/kg mỗi 12h | ≥50 | 2,5 mg/kg mỗi 12h |
| 20-50 | 2,5 mg/kg mỗi 24h | ||
| ≤20 hoặc lọc máu | 1,25 mg/kg mỗi 24h | ||
| Erythromycin | TM : 25-50mg/kg/ngày Uống : 250-500mg mỗi 6h hoặc mỗi 12h Tối đa : 4g/ngày |
|
|
| <10 | 50-75% liều bình thường. Tối đa : 2g/ngày | ||
| Ertapenem | 1g mỗi 24h | ≥30 | 1g mỗi 24h |
| <30 hoặc lọc máu | 500g mỗi 24h | ||
| Gentamicin | Chế độ 1 liều/ngày: 7 mg/kg 1 lần/ngày 5 mg/kg/ngày có thể dùng cho NK đường tiết niệu Chế độ đa liều/ngày: 1,5-2,5 mg/kg tiêm TM mỗi 8h |
| Chế độ 1 liều/ngày: liều thường được xác định bởi các mức độ/biểu đồ Hartford Chế độ đa liều/ngày: CrCl 51-90: 60-90% tiêm TM mỗi 8-12h CrCl 10-50: 30-70% tiêm TM mỗi 12h CrCl <10: 20-30% tiêm TM mỗi 24-48h |
| Imipenem / Cilastatin | TM: 1-4g/ngày chia 3-4 liều IM với NK nhẹ và trung bình: 500- 750mg mỗi 12h | 31-70 | 500mg mỗi 6-8h |
| 21-30 | 500mg mỗi 8-12h | ||
| <20 | 250-500mg (hoặc 3,5mg/kg) mỗi 12h | ||
| Levofloxacin | 250-500mg x 1 hoặc 2 lần/ngày | 20-50 | Liều khởi đầu 250-500mg, sau đó giảm 50% liều |
| 10-20 | Liều khởi đầu 250-500mg, sau đó giảm còn 125mg mỗi 12-24h | ||
| <10 | Liều khởi đầu 250-500mg, sau đó giảm còn 125 mỗi 24-48h | ||
| Meropenem | 1g mỗi 8h | >51 | 1g mỗi 8h |
| 26-50 | 1g mỗi 12h | ||
| 10-25 | 500mg mỗi 12h | ||
| <10 hoặc lọc máu | 500mg mỗi 24h | ||
| Meropenem (viêm màng não, Enterobacteriacea e kháng carbapenem | 2g mỗi 8h | >51 | 2g mỗi 8h |
| 26-50 | 1g mỗi 8h | ||
| 10-25 | 1g mỗi 12h | ||
| <10 hoặc lọc máu | 1g mỗi 24h | ||
| Nalidixic acid | 600 - 900mg mỗi 6h | ≥20 | Không cần điều chỉnh liều |
| <10 | Tránh dùng | ||
| Ofloxacin | Uống : 200-400mg/ngày, tối đa 400mg x 2 lần/ngày TM : 200-400mg x 2 lần/ngày | ≥20 | 200-400mg x 1 lần/ngày |
| <10 | 200mg x 1 lần/ngày | ||
| Piperacillin / Tazobactam | 3,375 - 4,5g mỗi 6h | >40 | 3,375g mỗi 6h (4,5g mỗi 6h trị Pseudomonas) |
| 20-40 | 2,25g mỗi 6h (3,375g mỗi 6h trị Pseudomonas) | ||
| <20 | 2,25g mỗi 8h (2,25g mỗi 6h trị Pseudomonas) | ||
| Lọc máu | 2,25g mỗi 12h (2,25g mỗi 8h trị Pseudomonas) | ||
| Teicoplanin | TB/TM: Liều nạp 400mg mỗi 12h x 3 lần, sau đó 200-400mg/ngày hoặc 3-6mg/kg/ngày (có thể đến 10mg/kg/ngày) | 20-50 | Không cần điều chỉnh |
| 10-20 | Liều tải bình thường, sau đó 200-400mg mỗi 24-48h | ||
| <10 | Liều tải bình thường, sau đó 200-400mg mỗi 48-72h | ||
| Vancomycin | 15 - 20 mg/kg TM mỗi 8 - 12h (2 - 3 g/ngày); (500 mg TM mỗi 6 h hoặc 1 g TM mỗi 12 h) | 50 - 80 | 15 mg/kg TM mỗi 12h |
| 10 - 50 | 15 mg/kg TM mỗi 24h | ||
| < 10 | 15 mg/kg TM mỗi tuần |
7.8. DỰ PHÒNG NHIỄM TRÙNG Ở BỆNH NHÂN BỆNH THẬN MẠN
Nhiễm trùng là nguyên nhân tử vong đứng hàng thứ hai sau các nguyên nhân tim mạch ở BN bị BTM. Tiêm chủng có thể tạo ra hàng rào miễn dịch hiệu quả nhưng hiệu quả này bị giảm đi ở những BN mắc BTM.
Các yếu tố nguy cơ làm gia tăng nhiễm trùng ở BN bị BTM gồm:
- Rối loạn cơ chế điều hòa miễn dịch qua trung gian kháng thể và tế bào
- Bệnh thận nguyên phát cần điều trị thuốc ức chế miễn dịch
- Bệnh đồng mắc: đái tháo đường, tăng huyết áp…
- Tình trạng thiếu hụt dinh dưỡng
- Hàng rào bảo vệ da - niêm mạc bị suy yếu
- Nhiễm khuẩn từ đường vào mạch máu và catheter lọc màng bụng ở bệnh nhân đã điều trị thay thế
- Tình trạng quá tải sắt ở BN phải truyền máu nhiều lần
- Tuổi cao
7.8.2. Các tác nhân gây nhiễm trùng phổ biến ở bệnh nhân BTM
Bảng 43. Các tác nhân gây nhiễm trùng thường gặp ở bệnh nhân BTM
| Nhóm | Loại nhiễm trùng | Tác nhân thường gặp |
| Nhiễm trùng liên quan đến catheter tĩnh mạch | Tại chỗ | S.epidermidis, S.aureus |
| Theo đường hầm | S.aureus | |
| Nhiễm khuẩn huyết | S.aureus, K.pneumoniae | |
| Nhiễm trùng liên quan đến catheter lọc màng bụng | Viêm phúc mạc | Enterococcus faecium, E.coli, S.aureus, Candida sp |
| Tại chỗ (viêm chân ống) | S.aureus, P.aeruginosa | |
| Nhiễm trùng liên quan đến đường vào mạch máu | Tại vị trí vết mổ AVF hoặc AVG | S.aureus |
| Nhiễm khuẩn huyết | S.aureus, E.coli | |
| Nhiễm trùng liên quan đến lọc máu | Các nhiễm trùng lây truyền qua đường máu | HBV, HCV, HIV |
| Nhiễm trùng liên quan đến ghép thận | Nhiễm trùng cơ hội (vi khuẩn, nấm, KST, virus) | CMV, Candida sp, PJP, Toxoplasma, Lao |
| Nhiễm khuẩn đường tiết niệu | Viêm bàng quang | E.coli |
| Viêm thận bể thận | E.coli, K.pneumoniae, Enterococus sp | |
| Nhiễm khuẩn bệnh viện | Tại vị trí phẫu thuật | Streptococcus pyogenes |
| Đường hô hấp | Moraxella catarrhalis, P.aeruginosa, K.pneumonia | |
| Tiêu chảy nhiễm khuẩn, liên quan đến dùng kháng sinh dài ngày | Clostridium difficile | |
| Nhiễm khuẩn cộng đồng | Cúm | Influenza virus (A,B), Covid-19 |
| Viêm phổi | Phế cầu | |
| Nhiễm khuẩn tiêu hóa | Novovirus |
7.8.3. Chiến lược dự phòng nhiễm trùng ở bệnh nhân BTM tại các cơ sở lọc máu
7.8.3.1. Các khuyến cáo về kiểm soát nhiễm khuẩn dành riêng cho nhân viên y tế liên quan đến lọc máu
- Kiểm soát những nhiễm trùng liên quan đến chăm sóc của nhân viên y tế
- Vệ sinh tay đúng cách (tuân thủ 5 thời điểm rửa tay của WHO)
- Mang găng tay và các phương tiện phòng hộ cá nhân khác khi chăm sóc tất cả người bệnh lọc máu chu kỳ
- Thực hiện các khuyến cáo về tiêm an toàn:
+ Không dùng lại hay dùng chung bơm kim tiêm
+ Không dùng chung 1 lọ hay 1 túi thuốc cho nhiều bệnh nhân
+ Vệ sinh tay và làm sạch các cổng truyền trước khi tiêm thuốc vào
+ Ưu tiên sử dụng lọ thuốc có 1 liều, tránh làm nhiễm bẩn các lọ thuốc đa liều
+ Không nên đậy nắp kim
+ Bỏ những vật sắc nhọn vào thùng riêng biệt
+ Nên sử dụng các thiết bị y tế có thiết kế an toàn (kim tự rút hoặc kim tự bọc)
+ Không sử dụng đường lọc máu cho các mục đích khác
- Phân chia riêng khu vực sạch và khu vực nhiễm bẩn
- Sử dụng thuốc an toàn:
+ Chuẩn bị tất cả thuốc cho BN trong khu vực sạch
+ Sử dụng thuốc ngay sau khi chuẩn bị, không mang thuốc từ phòng này sang phòng khác
+ Không chuẩn bị hoặc dự trữ thuốc tại phòng bệnh
- Làm sạch và khử trùng các vùng lọc máu giữa các bệnh nhân
- Cần xử lý an toàn các bộ lọc
7.8.3.2. Các biện pháp kiểm soát lây lan nhiễm trùng tại cơ sở lọc máu
- Thực hiện các biện pháp an toàn nghề nghiệp:
+ Áp dụng biện pháp phòng ngừa chuẩn và phòng ngừa theo đường lây. Mặc PPE nếu cần và vệ sinh tay để làm sạch máu hoặc dịch cơ thể
+ Khuyến cáo sử dụng găng tay, khẩu trang và áo choàng khi kết nối và kết thúc lọc cho BN chạy thận nhân tạo với máy chạy thận
+ Cần tiêm vắc-xin phòng viêm gan B và cúm mùa cho nhân viên
+ Không khuyến cáo thường xuyên xét nghiệm HCV, HBV, hay vi khuẩn đa kháng thuốc cho nhân viên
- Tiêm vắc xin phòng viêm gan B, cúm, phế cầu và kiểm tra định kỳ đối với BN lọc máu chu kỳ
- Kiểm tra và xử lý hệ thống nước R.O
+ Kiểm tra nước dùng để lọc máu và dịch lọc định kỳ theo hướng dẫn của cơ quan quản lý
+ Chất lượng nước cần được đánh giá về thành phần vi sinh vật và hoá học
+ Tổng số vi khuẩn sống trong nước dùng để lọc máu hoặc để xử lý màng lọc phải dưới 200 CFU/ml và nồng độ endotoxin phải dưới 2 EU/ml
+ Cần tiến hành ngay các biện pháp khắc phục nếu tổng số vi khuẩn đạt 50 CFU/ml hoặc nồng độ endotoxin đạt 1 EU/ml
7.8.3.3. Giáo dục bệnh nhân, nhân viên y tế và người chăm sóc
- Cần giáo dục BN, nhân viên y tế và người chăm sóc về chăm sóc nơi đặt catheter và vết thương, về các dấu hiệu và triệu chứng nhiễm trùng, và tầm quan trọng của việc báo cáo các nhiễm trùng tiềm ẩn
- Kiểm tra kiến thức, thái độ, hành vi của BN, nhân viên y tế và người chăm sóc thời điểm ban đầu và định kỳ hàng năm về các vấn đề:
+ Kỹ thuật vệ sinh tay và vệ sinh cá nhân
+ Trách nhiệm của BN trong việc chăm sóc vị trí catheter và ghi nhận các dấu hiệu nhiễm trùng
+ Khuyến cáo tiêm phòng (viêm gan B, cúm và phế cầu)
+ Việc lựa chọn đường vào mạch máu (mạch tự thân hoặc mạch nhân tạo ít có nguy cơ nhiễm trùng hơn catheter).
7.8.4. Khuyến cáo về tiêm vắc xin cho bệnh nhân có BTM
Bảng 44. Khuyến cáo về tiêm chủng cho người mắc BTM
| Khuyến cáo | Mức độ bằng chứng |
| Tiêm vắc xin phòng cúm hàng năm cho tất cả BN trưởng thành bị BTM, trừ khi có chống chỉ định. | 1B |
| Tiêm vắc xin phòng phế cầu đa giá cho tất cả người lớn có MLCT < 30 ml/phút/1,73m2 (giai đoạn G4-G5) và những người có nguy cơ nhiễm phế cầu cao (ví dụ: HCTH, đái tháo đường hoặc những người đang dùng thuốc ức chế miễn dịch), trừ khi có chống chỉ định. | 1B |
| Trong vòng 5 năm cần tiêm vắc xin phòng phế cầu nhắc lại cho tất cả BN bị BTM trưởng thành đã được tiêm phòng phế cầu. | 1B |
| Cần tiêm vắc xin phòng viêm gan B cho tất cả BN có BTM tiến triển và MLCT < 30 ml/phút/1,73m2 (G4-G5), cần xác nhận đáp ứng bằng xét nghiệm huyết thanh học thích hợp. | 1B |
| Cần đánh giá tình trạng miễn dịch của BN bị BTM trước khi sử dụng vắc-xin sống, tuân thủ các khuyến cáo từ các cơ quan quản lý hoặc chính phủ. | Không xếp hạng |
| Cần tuân thủ lịch tiêm chủng cho trẻ em theo các khuyến cáo chính thức của quốc tế và khu vực dành cho trẻ em mắc BTM. | Không xếp hạng |
7.8.4.1. Viêm gan B
- Khuyến cáo tiêm vắc xin phòng viêm gan B tái tổ hợp đường tiêm bắp vùng cơ delta, liều 40 μg/lần, vào thời điểm 0, 1, 2 và 6 tháng càng sớm càng tốt
- Nên đánh giá hiệu giá kháng thể anti-HBs sau khi hoàn thành liệu trình tiêm vắc xin 1-2 tháng, sau đó định lượng lại định kỳ hằng năm
- Tiêm liều nhắc lại nếu hiệu giá kháng thể anti-HBs giảm xuống dưới 10 mU/ml
- Đối với những người không đạt hiệu giá kháng thể mức bảo vệ sau liệu trình cơ bản cần tiêm nhắc lại một liệu trình đầy đủ với liều lượng được khuyến cáo.
7.8.4.2. Phế cầu
- Khuyến cáo tiêm vắc xin PCV13 và PPSV23
- Nên tiêm liều đầu tiên bằng PCV13, sau đó ít nhất 8 tuần tiêm PPSV23 cho BN bị BTM trên 19 tuổi
- Nên tuân theo các khuyến cáo về PPSV23 hiện tại cho người lớn có nguy cơ cao đối với các liều tiếp theo. Liều PPSV23 thứ hai được khuyến cáo tiêm sau liều PPSV23 đầu tiên 5 năm cho những người từ 19-64 tuổi
7.8.4.3. Virus cúm
- Nên tiêm vắc xin phòng cúm hàng năm trước khi bắt đầu mùa cúm cho BN lọc máu chu kỳ
- Nên tiêm phòng cúm hàng năm cho những người tiếp xúc trong gia đình và nhân viên chăm sóc để giảm lây truyền cho BN bị BTM có nguy cơ cao
7.8.4.4. Covid-19
- Nên ưu tiên tiêm phòng COVID-19 cho BN bị bệnh thận. Có thể sử dụng các loại vắc xin hiện có cho nhóm đối tượng này
- Nên ưu tiên sử dụng các loại vắc xin có hiệu lực cao (vắc xin mRNA được ưu tiên hơn vắc xin bất hoạt) vì BN mắc bệnh thận thường có đáp ứng với vắc xin kém hơn dân số nói chung
- Có thể cân nhắc sử dụng kháng thể đơn dòng trung hòa virus để dự phòng COVID-19 cho những BN không dung nạp/không đáp ứng với vắc xin hoặc có nguy cơ cao (như BN đang dùng thuốc ức chế miễn dịch, BTM giai đoạn cuối…)
Không khuyến cáo tiêm vắc xin phòng tụ cầu vàng (S.aureus) thường quy cho BN lọc máu do nhóm BN này có đáp ứng miễn dịch yếu hơn so với người khỏe mạnh
7.8.4.6. Các vắc-xin khác
Cần khai thác kỹ tiền sử và nên cân nhắc tiêm một số vắc xin khác cho BN bị BTM khi cần thiết, như:
- Vắc-xin Tdap phòng bạch hầu, ho gà, uốn ván
- Vắc-xin Zoster phòng thủy đậu, phòng Herpes cho BN trên 50 tuổi hoặc người có hệ miễn dịch suy giảm
- Vắc-xin phòng HPV cho BN dưới 26 tuổi
- Vắc-xin MMR phòng sởi, quai bị và rubella (nếu chưa được tiêm phòng)
8. TIẾN TRIỂN VÀ BIẾN CHỨNG CỦA BTM
Nếu không có biện pháp can thiệp phù hợp, BTM có xu hướng tiến triển, gây mất dần chức năng thận và sẽ đi đến giai đoạn cuối. Tốc độ giảm chức năng thận tăng theo mức độ nặng bệnh.
Can thiệp ở giai đoạn bệnh sớm có thể giúp giảm tốc độ tiến triển bệnh đến giai đoạn cuối, can thiệp càng sớm càng hiệu quả, thậm chí có thể làm bệnh ngừng tiến triển. Một số trường hợp bệnh có thể thoái lui một phần.
Các biến chứng quan trọng của BTM bao gồm:
- Biến cố tim mạch: thường gặp nhất. Tỷ lệ mắc tăng theo giai đoạn BTM. Thường quan sát thấy THA, suy tim, bệnh tim thiếu máu cục bộ, tai biến mạch não, bệnh mạch máu ngoại vi
- Rối loạn khoáng xương và khoáng hóa xương: tỷ lệ mắc tăng theo giai đoạn BTM. Thường quan sát thấy loãng xương, yếu xương, canxi hóa ngoài xương, và gãy xương bệnh lý.
- Thiếu máu: tỷ lệ mắc và mức độ thiếu máu tăng theo giai đoạn BTM.
- Rối loạn điện giải và thăng bằng kiềm toan, thường quan sát thấy toan máu, đặc biệt là tăng Kali máu ở giai đoạn cuối
- Nhiễm trùng
- Suy thận, xơ thận, tử vong
- Một số biến chứng khác, phụ thuộc vào căn nguyên gây BTM
Ưu tiên việc ngăn ngừa tiến triển BTM bằng cách kiểm soát các yếu tố nguy cơ ảnh hưởng đến thận như có protein nước tiểu, THA, ĐTĐ, bệnh tim mạch, béo phì, tắc nghẽn đường tiết niệu, toan chuyển hóa, tổn thương thận cấp, dùng chất gây độc thận hoặc suy tim phải nhập viện.
9.1. Tránh các thuốc độc thận
- Tránh sử dụng NSAID không cần thiết cũng như các thuốc có khả năng gây suy thận khác (aminoglycosides, thuốc chống virus - acyclovir, cidofovir). Cần tra cứu các thuốc phải chỉnh liều theo chức năng thận trước khi kê đơn.
- Cân nhắc khi chỉ định và thận trọng khi sử dụng thuốc cản quang.
+ Suy thận do thuốc cản quang được xác định khi có mất chức năng thận >30% hoặc tăng creatinin lên 0,5 mg/dL so với trước tiêm thuốc, xuất hiện trong vòng 3 ngày đầu sau dùng thuốc cản quang và không tìm thấy nguyên nhân khác. Tình huống này thường xảy ra ở người lớn tuổi, suy tim, đái tháo đường, bệnh thận mạn, đặc biệt khi MLCT ước tính <30ml/phút, trước đó có tổn thương thận cấp, mất nước, nhồi máu cơ tim, shock, liều thuốc cản quang cao, thiếu máu, tụt huyết áp, sử dụng đồng thời thuốc gây độc thận và lợi tiểu liều cao. Nếu có thể, nên ưu tiên sử dụng phương pháp chẩn đoán hình ảnh khác. Nếu việc sử dụng thuốc cản quang là không thể tránh được, nên sử dụng liều thấp nhất có thể, và tránh sử dụng liều lặp lại.
+ Hạn chế tối đa những tình huống nguy cơ. Khuyến cáo nên dừng sử dụng thuốc lợi tiểu ít nhất 4 - 6 ngày trước, truyền dịch hoặc uống nhiều nước.
9.2. Thận trọng khi dùng thuốc ảnh hưởng đến huyết động cầu thận
Một vài thuốc có thể làm thay đổi huyết động cầu thận, làm giảm tưới máu thận và làm tăng nguy cơ độc thận của các thuốc khác. Phần lớn các thuốc này dùng để bảo vệ tim, bảo vệ thận (ví dụ SGLT2i, RASi, MRA, lợi tiểu…). Tuy nhiên không nên sử dụng phối hợp các thuốc này với liều cao hoặc nhiều loại cùng lúc, vì việc này có thể gây suy thận chức năng hoặc làm tăng nguy cơ độc thận của các thuốc khác (mất nước đột ngột, tụt huyết áp, tăng Kali máu), nhất là khi phối hợp với NSAIDs.
Bệnh thận đái tháo đường (ĐTĐ) cùng bệnh võng mạc và biến chứng thần kinh được xếp vào nhóm biến chứng mạch máu nhỏ của ĐTĐ. Bệnh thận ĐTĐ xảy ra ở 20-40% BN ĐTĐ, sau khoảng 10 năm mắc ĐTĐ týp 1, và có thể hiện diện tại bất kỳ thời điểm nào khi ĐTĐ týp 2 được chẩn đoán. Đái tháo đường là nguyên nhân hàng đầu gây BTM giai đoạn cuối ở các nước phát triển. Bệnh nhân ĐTĐ týp 1 hoặc týp 2 bị BTM đều có tăng đáng kể nguy cơ bệnh tim mạch và chi phí chăm sóc sức khoẻ. Tỉ lệ tử vong sau 10 năm của BN ĐTĐ nếu không có bệnh thận là 4,1%, nếu có albumin niệu sẽ tăng lên 17,8%, nếu giảm MLCT sẽ tăng lên 23,9%, và nếu kết hợp cả 2 tiêu chí này sẽ tăng lên đến 47%.
Bệnh thận ĐTĐ có thể đi kèm với bệnh mạch máu lớn, bệnh cảnh lâm sàng thường gặp nhất là sự kết hợp giữa béo phì, hội chứng chuyển hoá và bệnh thận.
Tổn thương thận do ĐTĐ điển hình xuất hiện sau 15 đến 20 năm mắc ĐTĐ týp 1, và ở một số BN ĐTĐ týp 2, bắt đầu bằng sự tăng siêu lọc cầu thận (tăng MLCT), tăng kích thước thận, tiếp đến là xuất hiện albumin niệu vi lượng (30-300 mg/24 giờ), dần dần tiến triển thành bệnh thận ĐTĐ ở mức lâm sàng, bao gồm albumin niệu đại lượng (>300 mg/24giờ), THA, giảm chức năng thận và cuối cùng là bệnh thận giai đoạn cuối. Ở BN ĐTĐ týp 2, bệnh thận ĐTĐ có thể biểu hiện với giảm MLCT < 60 ml/phút/1,73 m2 mà không có albumin niệu, có thể do biến chứng mạch máu lớn.
Các biến chứng mạch máu nhỏ khác gồm tổn thương võng mạc (gặp ở tất cả BN ĐTĐ týp 1 nhưng chỉ gặp ở 50%-60% BN ĐTĐ týp 2 có protein niệu) và tổn thương đa dây thần kinh ngoại biên do ĐTĐ. Do đó, ở bệnh nhân ĐTĐ týp 2, không có tổn thương võng mạc không thể loại trừ bệnh thận ĐTĐ.
Các xét nghiệm thường dùng để chẩn đoán bệnh thận ĐTĐ gồm:
- Albumin niệu: Tốt nhất là định lượng albumin trong nước tiểu 24 giờ, xác định khi > 30 mg/24 giờ ít nhất ở 2 trong 3 mẫu xét nghiệm.
- Tỉ số albumin niệu/creatinine niệu trong mẫu nước tiểu bất kỳ, do nước tiểu 24 giờ không phải luôn có sẵn ở môi trường ngoại trú.
- Giải phẫu bệnh: giai đoạn sớm sau khi chẩn đoán ĐTĐ, về đại thể thận thường tăng 15% trọng lượng và kích thước; về vi thể có tăng thể tích cầu thận và lòng mao mạch cầu thận, phì đại mô kẽ. Màng đáy dần dày lên, có thể gấp 3 lần bình thường. Các nốt tổn thương Kimmelstiel-Wilson xuất hiện ở cầu thận giữa các quai mao mạch do dãn các vi phình mạch, ly giải các tế bào gian mạch, các mảnh vụn gian mạch gặp ở 10% - 50% các mẫu sinh thiết thận ở BN ĐTĐ týp 1 và týp 2. Có thể có các tế bào bọt xung quanh các nốt tổn thương. Tổn thương xơ chai cầu thận lan toả gặp ở > 90% BN ĐTĐ týp 1 được chẩn đoán > 10 năm và 25% đến 50% BN ĐTĐ týp 2, mức độ lan tỏa tương quan với tình trạng giảm chức năng thận. Khi bệnh diễn tiến nặng, thành mao mạch dày lên và các khoang gian mạch dãn rộng dẫn đến hẹp lòng mao mạch, hyalin hoá và xơ hoá quanh cầu thận. Chân bào tương của tế bào biểu mô tạng bị dính, mật độ tế bào giảm. Thành tiểu động mạch đến và đi bị hyalin hóa. Miễn dịch huỳnh quang thường âm tính nhưng có thể gặp lắng đọng IgG dọc quai mao mạch. Mô kẽ bị xơ hóa, kèm teo ống thận, mức độ tổn thương tương quan với mức độ giảm MLCT.
- Bối cảnh bệnh cầu thận xuất hiện trên nền BN ĐTĐ với thời gian mắc bệnh phù hợp
- Albumin niệu/creatinin niệu ≥ 30mg/g, được khẳng định bởi ít nhất hai lần xét nghiệm trong khoảng thời gian cách nhau 3 - 6 tháng và/hoặc
- Giảm MLCT ước tính xuống dưới 60 ml/phút/1,73m2 da mà không có nguyên nhân nguyên phát khác của tổn thương thận
- Kết quả mô bệnh học phù hợp
Cần chẩn đoán phân biệt với các tổn thương thận không do ĐTĐ như bệnh cầu thận nguyên phát, bệnh hệ thống, hẹp động mạch thận…. Chẩn đoán xác định thường dựa vào kết quả sinh thiết thận
Chỉ định sinh thiết thận ở bệnh nhân ĐTĐ mắc BTM bao gồm:
(1) protein niệu ở mức thận hư hoặc suy giảm chức năng thận mà không kèm bệnh võng mạc do ĐTĐ;
(2) protein niệu ở mức thận hư hoặc suy giảm chức năng thận trên BN được chẩn đoán
ĐTĐ dưới 5 năm;
(3) protein niệu mức thận hư kèm chức năng thận bình thường;
(4) cặn lắng nước tiểu bất thường (hồng cầu, bạch cầu, trụ tế bào nước tiểu);
(5) suy thận tiến triển nhanh ở BN trước đó có chức năng thận bình thường;
(6) có triệu chứng của bệnh hệ thống.
2.5. Tầm soát và phát hiện bệnh thận mạn ở bệnh nhân ĐTĐ
Đánh giá tỉ số albumin niệu/creatinin niệu trong mẫu nước tiểu bất kì và MLCT ước tính ít nhất một lần mỗi năm cho các BN bị ĐTĐ týp 1 được chẩn đoán ≥5 năm và cho tất cả BN ĐTĐ týp 2 tại thời điểm bệnh được chẩn đoán. Những BN có albumin niệu/creatinin niệu >30 mg/g và/hoặc MLCT <60 ml/phút/1,73m2 cần được làm xét nghiệm theo dõi hai lần mỗi năm để có kế hoạch quản lý phù hợp.
Mục tiêu điều trị là làm giảm albumin niệu, bảo tồn chức năng thận và giảm biến cố tim mạch, giảm tử vong.
Chiến lược chăm sóc toàn diện BN ĐTĐ mắc BTM nhằm cải thiện kết cục thận và tim mạch bao gồm điều chỉnh lối sống và tự quản lý, điều trị thuốc bậc 1 tuỳ theo đặc tính bệnh, sử dụng các thuốc bảo vệ thận và tim dựa vào đánh giá nguy cơ tồn dư, và can thiệp khác nếu cần để kiểm soát thêm các yếu tố nguy cơ.
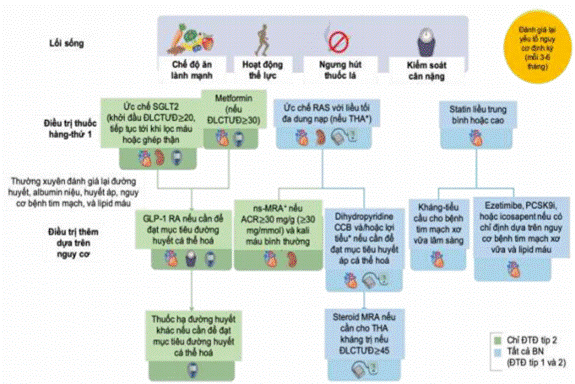
Hình 3. Tiếp cận toàn diện để cải thiện kết cục của bệnh nhân ĐTĐ và BTM
Thuốc ức chế men chuyển angiotensin hoặc chẹn thụ thể angiotensin II nên là điều trị THA bậc 1 khi BN có albumin niệu, ngoài ra cũng có thể cân nhắc thuốc chẹn kênh canxi (CCB) nhóm dihydropyridine hoặc lợi tiểu.
Thuốc đối vận thụ thể mineralocorticoid không steroid (ns-MRA) có thể là lựa chọn tiếp theo với các chế phẩm được chứng minh là mang lại lợi ích cho thận và tim mạch trên lâm sàng.
Cần can thiệp thay đổi lối sống cho tất cả BN ĐTĐ mắc BTM, bao gồm:
- Khuyến cáo chế độ ăn tùy theo cá thể, nhiều rau xanh, trái cây, ngũ cốc nguyên hạt, chất xơ, đậu, protein từ thực vật, mỡ không bão hoà, và các loại hạt; giảm thịt chế biến sẵn, carbohydrate tinh chế, và thức uống có đường. Chỉ khuyến cáo chế độ ăn giảm kali cho những BN ở giai đoạn nặng (G4-5). Những BN chưa lọc máu nên giảm lượng protein ăn vào, xuống khoảng 0,8 g/kg/ngày; hạn chế lượng natri ăn vào (Na <2g hoặc <90 mmol/ngày, hoặc NaCl < 5 g/ngày).
- Khuyến cáo hoạt động thể lực cường độ trung bình, ít nhất 150 phút/tuần, hoặc ở mức phù hợp với tình trạng tim mạch và thể chất của BN.
- Khuyến khích giảm cân, đặc biệt BN có MLCT ước tính < 30 ml/phút/1,73 m2.
- Tư vấn ngừng hút thuốc.
- Can thiệp bằng thuốc bao gồm:
- Kiểm soát HA: ưu tiên nhóm thuốc ức chế RAAS (ƯCMC, ƯCTT), đặc biệt cho các BN có albumin niệu, nếu không có chống chỉ định. Nên dùng liều tối đa có thể dung nạp được cho BN ĐTĐ mắc BTM có THA và albumin niệu trên mức bình thường. Khuyến cáo HA mục tiêu <130/80mmHg khi có albumin niệu, có thể cân nhắc HA tâm thu < 120mmHg nếu BN có thể dung nạp.
- Cân nhắc dùng ƯCMC, ƯCTT cho BN ĐTĐ có albumin niệu nhưng HA bình thường.
- Khuyến cáo sử dụng SGLT2i (Dapagliflozin 10mg/ngày, Empagliflozin 10mg hoặc 25mg/ngày) cho BN ĐTĐ týp 2 mắc BTM có MLCT > 20ml/phút/1,73m2 để bảo vệ thận và tim mạch. Đây là lựa chọn được ưu tiên cho các BN có albumin niệu trên mức bình thường nhưng HA bình thường.
- Khuyến cáo sử dụng thuốc đối vận thụ thể mineralocorticoid không steroid (nsMRA) để giảm albumin niệu và bảo vệ tim mạch cho BN bị ĐTĐ týp 2 có MLCT ≥ 25ml/phút/1,73m2, có Kali máu bình thường và có albumin niệu (tỉ số albumin niệu/creatinin niệu 1 mẫu nước tiểu ≥30 mg/g (≥3 mg/mmol) sau khi đã dùng thuốc ức chế RAAS ở liều tối đa dung nạp được. Nhóm thuốc này phù hợp nhất cho BN ĐTĐ týp 2 có nguy cơ tiến triển BTM và biến cố tim mạch mặc dù đã được dùng phác đồ chuẩn, thông thường là bằng ức chế RAAS và SGLT2i.
- Kiểm soát đường máu tích cực để đường máu gần như bình thường giúp làm chậm sự khởi phát và tiến triển của albumin niệu, làm giảm tốc độ giảm MLCT ước tính cho BN ĐTĐ. Khuyến cáo sử dụng HbA1c để theo dõi dài hạn việc kiểm soát đường máu cho BN ĐTĐ mắc BTM 2 lần/năm khi HbA1c đạt mục tiêu ổn định. Nếu cần điều chỉnh thuốc hạ đường máu hoặc khi chưa đạt mục tiêu có thể làm xét nghiệm HbA1c đến 4 lần/năm. Lưu ý rằng độ tin cậy của HbA1C giảm khi BN mắc BTM tiến triển (G4-G5) và BN lọc máu. Mục tiêu HbA1c ở BN ĐTĐ mắc BTM chưa lọc máu nói chung là từ 6,5% đến <8% nhưng có thể điều chỉnh tùy theo tình trạng BN và các bệnh đồng mắc (hình 4).
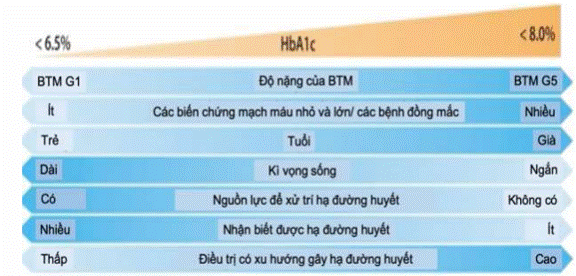
Hình 4. Các yếu tố cần cân nhắc khi đặt mục tiêu HbA1C
- Metformin và thuốc SGLT2i là lựa chọn đầu tay, nếu đường máu chưa đạt mục tiêu có thể thêm thuốc nhóm khác. Khuyến cáo sử dụng đầu tay Metformin cho BN ĐTĐ týp 2 bị BTM và có MLCT >30 ml/phút/1,73 m2. Cần theo dõi MLCT cho các BN dùng Metformin và tăng tần suất theo dõi khi MLCT ≤ 45 ml/phút/1,73 m2.
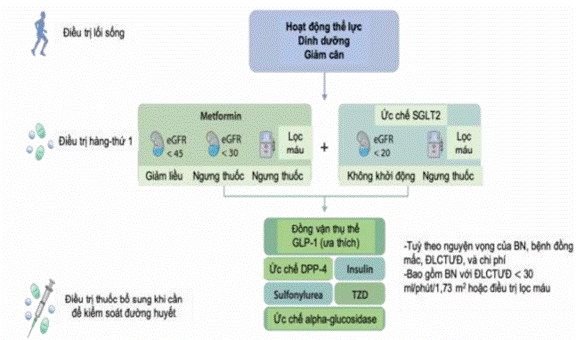
Hình 5. Lựa chọn thuốc hạ đường máu cho bệnh nhân ĐTĐ týp 2 và BTM
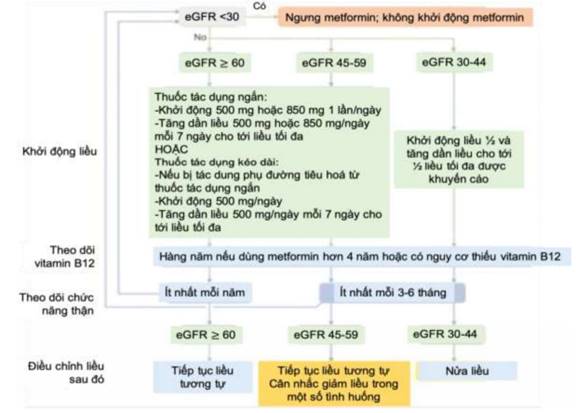
Hình 6. Chỉnh liều metformin theo chức năng thận
- Khuyến cáo bổ sung thuốc đồng vận thụ thể GLP-1 tác dụng kéo dài nếu đường máu không đạt mục tiêu đã xác định cho cá thể với Metformin và SGLT2i, hoặc nếu BN không thể dùng 2 thuốc này. Khởi trị thuốc đồng vận thụ thể GLP-1 với liều thấp, sau đó tăng liều dần dần để giảm tác dụng phụ đường tiêu hoá.
Bảng 45. Liều thuốc đồng vận thụ thể GLP-1 cho BN mắc BTM
| Đồng vận thụ thể GLP-1 | Liều | Chỉnh liều cho bệnh thận mạn |
| Liraglutide | 1,2 mg và 1,8 mg 1 lần/ngày | Không chỉnh liều Ít dữ liệu cho BTM nặng |
| Lixisenatide | 10 μg và 20 μg, 1 lần/ngày | Không chỉnh liều Ít dữ liệu cho BTM nặng Không khuyến cáo với MLCT ước tính < 15 ml/phút/1,73 m2 |
Các yếu tố nguy cơ tiến triển bệnh thận ĐTĐ bao gồm tăng đường máu, tăng huyết áp, hút thuốc, di truyền, gia đình, tăng lipid máu, ăn nhiều protein, đề kháng insulin, béo phì, thai kỳ, bệnh thần kinh tim tự động.
- Kiểm soát HA
- Kiểm soát đường máu
- Điều trị hạ lipid máu
- Điều chỉnh lối sống
- Aspirin hoặc thuốc ức chế kết tập tiểu cầu khác để phòng ngừa biến cố tim mạch
Lupus ban đỏ hệ thống (SLE) là bệnh tự miễn phức tạp, gây tổn thương nhiều cơ quan, bệnh cảnh nặng nề, có tỉ lệ tử vong và tỉ lệ bệnh đồng mắc cao do biến chứng trực tiếp của bệnh và do tác dụng phụ của thuốc điều trị. SLE gặp nhiều ở độ tuổi 15 - 45, tỉ lệ nữ/nam là 8 - 13/1; gặp nhiều ở người Mỹ da đen, người châu Á, người gốc Tây Ban Nha và Bồ Đào Nha. Viêm thận lupus xảy ra ở 25 - 50% các trường hợp lúc mới khởi phát lupus; nhưng phát sinh trong quá trình diễn tiến ở trên 60% các trường hợp. Viêm thận lupus thường dẫn đến suy thận mạn giai đoạn cuối và làm giảm đáng kể tỉ lệ sống.
- Di truyền: SLE hay tập trung ở một số gia đình, ở trẻ sinh đôi cùng trứng, ở một số chủng tộc, một số kiểu gen như HLA B8, DR2, DR3, DR15, DQW1…
- Hormone: Tần suất bệnh ưu thế ở phụ nữ trong lứa tuổi sinh đẻ, phụ nữ mãn kinh có dùng hormone thay thế. Một số nghiên cứu cho thấy bệnh cải thiện khi cắt buồng trứng hoặc điều trị androgen.
- Môi trường: Thể hiện qua sự thay đổi hệ thống miễn dịch gây ra bởi tình trạng nhiễm trùng hoặc nhiễm virus, đặc biệt là Epstein Barr virus, sự tiếp xúc quá mức với ánh sáng mặt trời, tia cực tím và một số thuốc như procainamide, hydralazine, quinidine, thuốc sinh học anti-TNF, hút thuốc, uống rượu, tiếp xúc nghề nghiệp với tinh thể silic (hít bụi bột xà phòng, hoặc bụi đất trong nông trại).
- Quyết định kháng nguyên: Khả năng DNA tiếp cận các yếu tố chuyển mã và biểu hiện gen do sự methyl hoá DNA và điều chỉnh histone điều hòa thông qua quá trình methyl hoá và acetyl hoá, làm tăng biểu hiện gen và/hoặc tăng sản xuất interferon.
Triệu chứng lâm sàng giống nhau ở hai giới, người lớn và trẻ em. Các hệ thống cơ quan thường bị ảnh hưởng bao gồm thận, cơ xương khớp, thanh mạc (màng phổi, màng tim), hệ thần kinh, hệ tạo máu và da niêm mạc. Ngoài ra, còn có thể gặp các tổn thương tim, gan, phổi, và tiêu hoá. Bệnh nhân có thể có 1 số triệu chứng không đặc hiệu như mệt, sốt, chán ăn, sụt cân.
Biểu hiện tổn thương thận gồm protein niệu, hoặc cặn lắng nước tiểu bất thường như đái máu vi thể, hồng cầu niệu biến dạng, trụ hồng cầu. Nặng hơn có thể là biểu hiện hội chứng viêm thận kết hợp viêm cầu thận tăng sinh, THA, giảm MLCT. Ít gặp tổn thương ống thận, toan hoá ống thận, viêm ống thận mô kẽ đơn thuần, thuyên tắc vi mạch huyết khối kèm hoặc không kèm hội chứng kháng phospholipid. Tổn thương thận thường xuất hiện đồng thời hoặc sau khởi phát lupus một thời gian ngắn, diễn tiến kéo dài qua những đợt bùng phát xen kẽ những đợt lui bệnh. Biểu hiện lâm sàng thường tương quan chặt chẽ với mức độ tổn thương cầu thận, nhưng một số BN có mức độ tổn thương mạch máu và ống thận mô kẽ không tương xứng, chiếm ưu thế trong diễn tiến lâm sàng.
- Các XN cần làm để chẩn đoán gồm:
+ Kháng thể kháng nhân (ANA): độ nhạy cao nhưng độ đặc hiệu thấp
+ Kháng thể kháng ds-DNA: đặc hiệu cho Lupus, đặc biệt cho những BN có tổn thương thận hoặc đa cơ quan, nhưng độ nhạy thấp hơn kháng thể kháng nhân
+ Bổ thể: giảm bổ thể toàn phần, C3, C4 khi có đợt cấp
+ Các kháng thể khác: anti-Sm, anti-nRNP, anti-Ro/SSA, anti-La/SSB, anti-C1q
+ Các XN cần làm để đánh giá tình trạng tăng đông máu ở BN Lupus gồm
+ Kháng thể anti-cardiolipin, anti-phospholipid, anti-beta2-glycoprotein 1
- Chẩn đoán mô bệnh học: đặc biệt giá trị trong phân loại, đánh giá độ hoạt động hay mạn tính, theo dõi đáp ứng điều trị, tiên lượng và giúp khẳng định chẩn đoán.
3.3.1 Các tiêu chuẩn thường dùng để chẩn đoán xác định Lupus ban đỏ hệ thống:
- Tiêu chuẩn của Hiệp hội Thấp học Hoa Kỳ (ACR): xây dựng năm 1982, cải biên năm 1997 gồm 11 tiêu chí. Đáp ứng 4/11 tiêu chí giúp chẩn đoán xác định với độ nhạy 82,2% và độ đặc hiệu 93%.
- Tiêu chuẩn SLICC: xây dựng năm 2012, gồm 17 tiêu chí, giúp chẩn đoán xác định với độ nhạy 96,7% và độ đặc hiệu 84%.
- Tiêu chuẩn EULAR/ACR: xây dựng năm 2019, phối hợp các tiêu chí lâm sàng và xét nghiệm để chấm theo thang điểm từ 2 đến 10, trong đó tiêu chí bắt buộc phải có là ANA dương tính 1 lần. Chẩn đoán xác định khi có từ 10 điểm trở lên với độ nhạy 96,1% và độ đặc hiệu 93,4%.
3.3.2 Chẩn đoán viêm thận lupus:
Bệnh nhân đã được chẩn đoán SLE được chẩn đoán viêm thận lupus khi đồng thời có thêm:
- Protein niệu > 0,5 g/24 giờ, hoặc > 3+ trên que nhúng, HOẶC
- Có trụ tế bào (trụ hồng cầu, trụ hemoglobin, trụ hạt, hoặc trụ hỗn hợp).
Có thể thay protein niệu 24 giờ bằng tỉ số protein niệu/creatinin niệu trong mẫu nước tiểu đầu tiên buổi sáng (> 0,5g/g). Tiêu chí “cặn lắng nước tiểu bất thường” khi có > 5 hồng cầu/vi trường phóng đại cao, > 5 bạch cầu /vi trường phóng đại cao mà không có nhiễm trùng, trụ hồng cầu, trụ bạch cầu) có thể thay thế cho trụ tế bào.
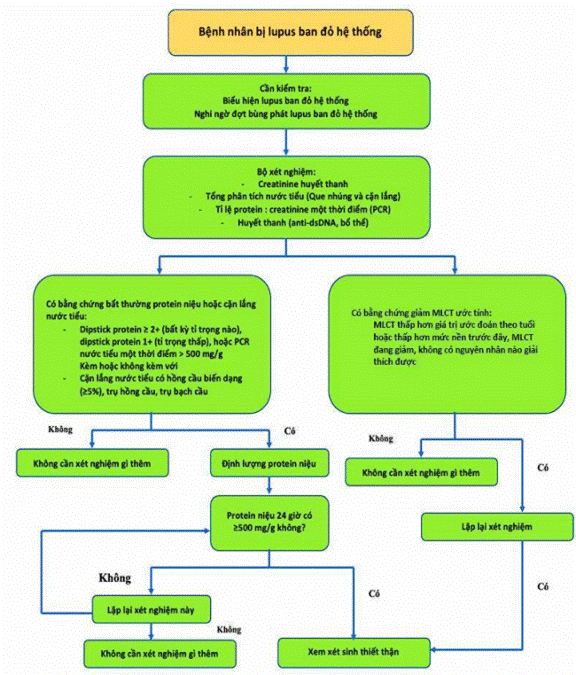
Hình 7. Sơ đồ chẩn đoán viêm thận lupus
Bảng 46. Phân loại viêm thận lupus theo ISN/RPS 2004
| Nhóm | Mô tả |
| I | Viêm thận lupus tăng sinh gian mạch tối thiểu |
| II | Viêm thận lupus tăng sinh gian mạch |
| III III (A) III (A/C) III (C) | Viêm thận lupus khu trú* (< 50% số cầu thận) Tổn thương hoạt động Tổn thương hoạt động và mạn tính Tổn thương mạn tính |
| Nhóm | Mô tả |
| IV | Viêm thận lupus lan tỏa ** (>50% số cầu thận) |
|
| Viêm thận lupus lan tỏa từng phần (IV-S) hay toàn bộ (IV-G) |
| IV (A) IV (A/C) IV (C) | Tổn thương hoạt động Tổn thương hoạt động và mạn tính Tổn thương mạn tính |
| V*** | Viêm thận lupus màng |
| VI | Viêm thận lupus xơ hóa tiến triển (≥90% số cầu thận bị xơ hóa hoàn toàn, không có tổn thương hoạt động) |
| * Chỉ phần cầu thận với tổn thương hoạt động hoặc xơ hóa ** Chỉ phần cầu thận với tổn thương hoại tử fibrin và tổn thương hình liềm *** Tổn thương màng có thể kết hợp với nhóm III hoặc nhóm IV, trong trường hợp đó phải ghi cả hai chẩn đoán | |
Để làm rõ các khái niệm, tăng tính đồng nhất và tăng mối tương quan giữa phân loại hình thái học với kết cục lâm sàng cho viêm thận lupus, năm 2016 nhóm chuyên gia về viêm thận lupus đã đồng thuận điều chỉnh lại 1 số định nghĩa và thuật ngữ mô tả như sau:
- Thay "tăng sinh” bằng “tăng số tế bào” (ở khoang gian mạch cho nhóm II; ở nội mao mạch cho nhóm III và IV) và quy định ngưỡng số lượng tế bào
- Lượng giá tổn thương hình liềm để phân loại hình thái học thành "liềm tế bào”, “liềm xơ” hay “liềm xơ-tế bào”
- Bỏ việc chia thành phân nhóm “từng phần” (S) hay “toàn bộ” (G) cho nhóm IV
- Thay các mô tả “hoạt động”, “mạn tính”, “hoạt động/mạn tính” bằng hệ thống cho điểm đánh giá mức độ hoạt động hay mạn tính của NIH.
- Các bệnh hệ thống: bệnh cơ sợi, hội chứng Sjogren, thuyên tắc vi mạch huyết khối, hội chứng kháng phospholipid nguyên phát, viêm da cơ, xơ cứng bì hệ thống, bệnh mô liên kết hỗn hợp
- Các bệnh lý có viêm cầu thận kèm theo: bệnh thận IgA, viêm mạch Henoch- Schonlein, viêm cầu thận kết hợp kháng thể kháng bạch cầu đa nhân trung tính (ANCA), viêm nội tâm mạc nhiễm trùng, viêm cầu thận kết hợp cryoglobulin trong máu.
- Mục tiêu điều trị là làm chậm tiến triển bệnh, đạt được thuyên giảm hoàn toàn, tránh tái phát, giảm tổn thương thận lâu dài, hạn chế tác dụng phụ của thuốc, cải thiện chất lượng cuộc sống.
- Cần điều trị cho tất cả BN mắc SLE và viêm thận lupus với hydroxychloroquine (HCQ) hoặc một thuốc chống sốt rét tương đương trừ phi có chống chỉ định (1C). Liều HCQ giai đoạn tấn công 6,5 mg/kg/ngày hoặc 400 mg/ngày, giai đoạn duy trì 4-5 mg/kg/ngày. Giảm liều 25% cho BN có eGFR < 30 ml/phút. Cần khám mắt trước khi khởi trị HCQ và khám định kỳ hàng năm trong thời gian điều trị.
- Các biện pháp điều trị hỗ trợ cho BN viêm thận Lupus: xem bảng 48
Bảng 47. Các biện pháp làm giảm nhẹ phòng ngừa biến chứng của viêm thận lupus
| Nguy cơ | Xử trí |
| Tim mạch | - Điều chỉnh lối sống: ngừng hút thuốc, giảm cân, luyện tập - Điều trị rối loạn lipid máu - Aspirin liều thấp khi mang thai |
| Protein niệu | - Chế độ ăn giảm muối - Kiểm soát tốt HA - Dùng thuốc ức chế RAAS |
| Nhiễm trùng | - Tìm hiểu tiền sử mắc bệnh lao hoặc nhiễm herpes zoster - Tầm soát HBV, HCV, HIV và tiêm vắc xin phòng HBV - Phòng ngừa pneumocystis jirovecii - Tiêm phòng cúm và phế cầu - Cá thể hoá việc tiêm vắc xin tái tổ hợp phòng virus zoster - Cá thể hoá việc phòng ngừa và điều trị nhiễm trùng theo khuyến cáo của địa phương |
| Tổn thương xương | - Đánh giá nguy cơ gãy xương và đo độ khoáng xương - Bổ sung calcium và vitamin D - Biphosphonate khi cần thiết |
| Tiếp xúc tia cực tím | - Tránh tiếp xúc tia cực tím từ ánh nắng mặt trời, kem chống nắng |
| Suy buồng trứng Suy tinh hoàn | - Dùng đồng vận Gonadotropin-releasing hormone (leuprolide) - Trữ tinh trùng /trứng |
| Có thai ngoài kế hoạch | - Thăm khám đánh giá từng người bệnh và tư vấn các biện pháp ngừa thai (sở thích của người bệnh, nguy cơ huyết khối, tuổi) |
| Ung thư | - Đánh giá nguy cơ mắc bệnh ác tính - Tầm soát nguy cơ ung thư theo tuổi - Hạn chế tổng liều cyclophosphamide <36 g trong suốt cuộc đời |
4.3.1 Viêm thận lupus nhóm I hoặc nhóm II
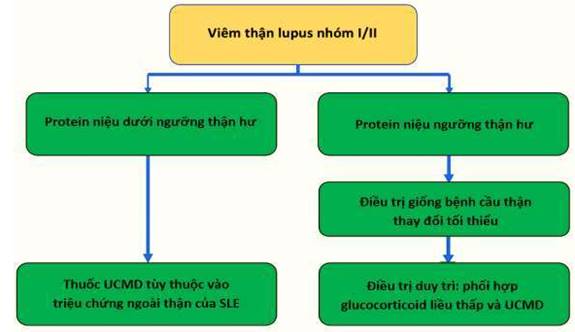
Hình 8. Sơ đồ điều trị ức chế miễn dịch cho viêm thận Lupus nhóm I hoặc II
4.3.2 Viêm thận lupus nhóm III hoặc nhóm IV
4.3.2.1. Giai đoạn tấn công
- Khuyến cáo điều trị ban đầu bằng glucocorticoids phối hợp với: 1) mycophenolate acid analogs (MPAA) HOẶC 2) cyclophosphamide truyền tĩnh mạch liều thấp HOẶC 3) kháng thể đơn dòng ức chế yếu tố hoạt hóa tế bào B phối hợp với MPAA hoặc cyclophosphamide truyền tĩnh mạch liều thấp HOẶC 4) MPAA và một thuốc ức chế calcineurin (CNI) khi chức năng thận không giảm nặng (MLCT ước tính ≤ 45 mL/phút/1,73m2) cho các BN viêm thận lupus hoạt động nhóm III hoặc IV, kèm hoặc không kèm tổn thương màng (1B)
- Nếu triệu chứng thận và ngoài thận cải thiện sau liều methylprednisolon bolus, có thể giảm nhanh liều glucocorticoid (xem bảng 49).
- Khuyến cáo điều trị ban đầu bằng Cyclophosphamide truyền tĩnh mạch cho BN viêm thận lupus nhóm III/IV kém tuân thủ phác đồ điều trị thuốc uống (xem bảng 50).
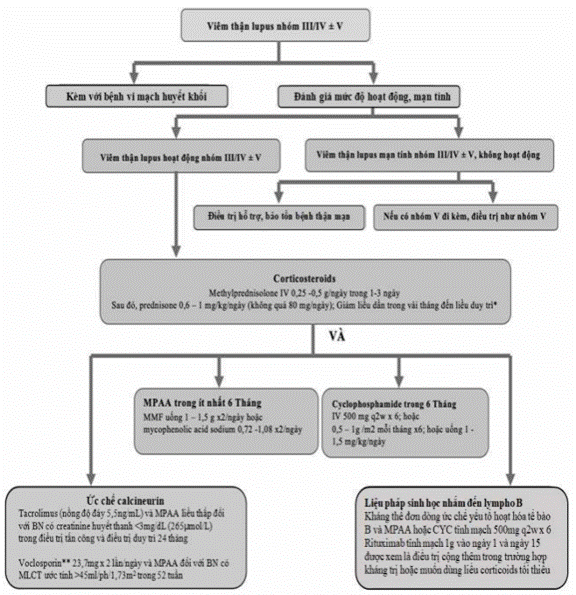
Hình 9. Sơ đồ điều trị tấn công cho viêm thận Lupus hoạt động nhóm III/IV
- Ưu tiên điều trị tấn công bằng MPAA cho BN có nguy cơ vô sinh cao, BN đã sử dụng cyclophosphamide trước đây và BN gốc Á, Tây Ban Nha, Bồ Đào Nha hoặc gốc Phi.
- Điều trị tấn công bằng phác đồ 3 thuốc gồm CNI (tacrolimus hoặc cyclosporin), MPAA liều thấp và glucocorticoids cho các BN không dung nạp MPAA liều chuẩn, không thích hợp hoặc không muốn sử dụng cyclophosphamide. BN có MLCT > 45 ml/phút/1,73 m2, có thể phối hợp thuốc ức chế calcineurin thế hệ mới với MPAA và glucocorticoids.
- Các thuốc sinh học nhắm đích tế bào lympho B: có thể lựa chọn
+ Kháng thể đơn dòng ức chế yếu tố hoạt hóa tế bào B phối hợp phác đồ chuẩn cho viêm thận lupus hoạt động
+ Rituximab sử dụng cho BN có bệnh hoạt dộng kéo dài hoặc nhiều đợt bùng phát
- Nếu BN không dung nạp các thuốc cơ bản, hoặc không sẵn có các thuốc cơ bản, hoặc kinh phí hạn chế có thể xem xét sử dụng một số loại thuốc khác như azathioprin, hoặc leflunomide phối hợp glucocorticoids để điều trị tấn công cho BN viêm thận lupus tăng sinh. Tuy nhiên hiệu quả của các phác đồ này không cao, có thể tăng tỷ lệ bùng phát và/hoặc tăng độc tính của thuốc.
Bảng 48. Các phác đồ liều glucocorticoids cho BN viêm thận Lupus
|
| Liều chuẩn | Liều trung bình | Liều giảm |
| Methylprednisolone bolus tĩnh mạch | Không có hoặc 0,25 - 0,5 g/ngày tối đa 3 ngày xem như điều trị ban đầu | 0,25 - 0,5 g/ngày tối đa 3 ngày thường bao gồm trong điều trị ban đầu | 0,25 - 0,5 g/ngày tối đa 3 ngày thường bao gồm trong điều trị ban đầu |
| Liều tương đương prednisone /ngày |
|
|
|
| Tuần 0 - 2 | 0,8 - 1 mg/kg (tối đa 80 mg) | 0,6 - 0,7 mg/kg (tối đa 50 mg) | 0,5 - 0,6 mg/kg (tối đa 40 mg) |
| Tuần 3 - 4 | 0,6 - 0,7 mg/kg | 0,5 - 0,6 mg/kg | 0,3 - 0,4 mg/kg |
| Tuần 5 - 6 | 30 mg | 20 mg | 15 mg |
| Tuần 7 - 8 | 25 mg | 15 mg | 10 mg |
| Tuần 9 - 10 | 20 mg | 12,5 mg | 7,5 mg |
| Tuần 11 - 12 | 15 mg | 10 mg | 5 mg |
| Tuần 13 -14 | 12,5 mg | 7,5 mg | 2,5 mg |
| Tuần 15 -16 | 10 mg | 7,5 mg | 2,5 mg |
| Tuần 17 - 18 | 7,5 mg | 5 mg | 2,5 mg |
| Tuần 19 - 20 | 7,5 mg | 5 mg | 2,5 mg |
| Tuần 21 - 24 | 5 mg | < 5 mg | 2,5 mg |
| Tuần > 25 | < 5 mg | < 5 mg | < 2,5 mg |
Bảng 49. Các phác đồ liều Cyclophosphamide phối hợp glucocorticoids để điều trị tấn công viêm thận lupus hoạt động nhóm III/IV
| Phác đồ | Cyclophosphamide TM (Phác đồ NIH) | Cyclophosphamide TM (Euro-Lupus) | Cyclophosphamide uống |
| Liều cyclophosphamide | 0,5-1 g/m2/tháng trong 6 tháng | 500 mg/2 tuần trong 3 tháng | 1-1,5 mg/kg/ngày (tối đa 150 mg/ngày) trong 2 - 6 tháng |
4.3.2.2 Giai đoạn duy trì
- Khuyến cáo điều trị duy trì bằng MPAA sau điều trị tấn công (1B). Liều MMF 750-1000mg uống 2 lần/ngày; liều MPA 540-720mg uống 2 lần/ngày
- Có thể sử dụng Azathioprine thay thế MPAA cho những BN không dung nạp, hoặc không thể tiếp cận MPAA, hoặc mong muốn có thai.
- Nên giảm dần liều Glucocorticoids đến liều thấp nhất có hiệu quả trong thời gian điều trị duy trì, có thể tăng liều nếu có đợt bùng phát do tổn thương ngoài thận. Xem xét ngừng glucocorticoids khi BN duy trì tình trạng đáp ứng hoàn toàn trên 12 tháng.
- Xem xét sử dụng CNI (tacrolimus 3mg/ngày hoặc liều đủ để đạt nồng độ đáy 4-6ng/ml) kết hợp glucocorticoids liều thấp nếu không thể sử dụng MPAA và azathioprine. Giảm liều CNI nếu creatinine huyết thanh tăng nhưng không đạt ổn định hoặc tăng trên 30% giá trị nền. Liều lý tưởng nhất của CNI có thể điều chỉnh tuỳ từng bệnh nhân để đạt được hiệu quả mong muốn (protein niệu cân bằng với nồng độ creatinine huyết thanh). Ngừng CNI nếu creatinine huyết thanh không giảm sau khi đã giảm liều.
- Tổng thời gian điều trị tấn công và duy trì cho BN viêm thận lupus tăng sinh không nên ngắn hơn 36 tháng.
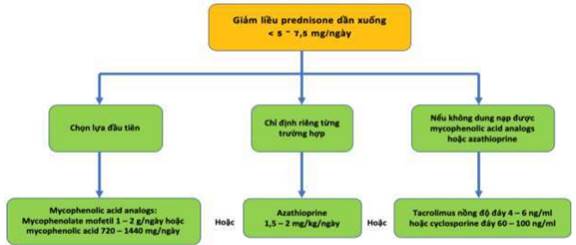 Hình 10. Sơ đồ điều trị duy trì cho viêm thận Lupus nhóm III và nhóm IV
Hình 10. Sơ đồ điều trị duy trì cho viêm thận Lupus nhóm III và nhóm IV
4.3.3 Viêm thận lupus nhóm V
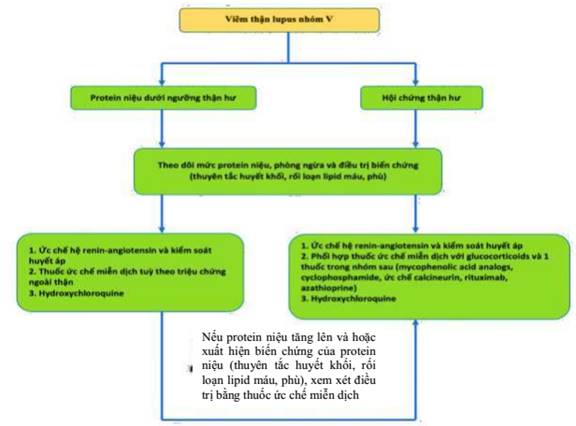
Hình 11. Sơ đồ điều trị viêm thận Lupus nhóm V
4.4. Đánh giá đáp ứng điều trị
Bảng 50. Phân loại đáp ứng điều trị trong viêm thận Lupus
| Tiêu chuẩn | Định nghĩa |
| Đáp ứng hoàn toàn* | - Giảm protein niệu < 0,5 g/g (đo bằng PCR hoặc nước tiểu 24 giờ) - Chức năng thận ổn định hoặc cải thiện (± 10% so với giá trị nền) - Đạt được trong 6 - 12 tháng điều trị nhưng không được quá 12 tháng |
| Đáp ứng không hoàn toàn | - Giảm protein niệu ít nhất 50% và < 3 g/g (đo bằng PCR hoặc nước tiểu 24 giờ) - Chức năng thận ổn định hoặc cải thiện (± 10% so với giá trị nền) - Trong vòng 6 - 12 tháng điều trị |
| Không đáp ứng | Không đạt được đáp ứng hoàn toàn hoặc không hoàn toàn sau 6 - 12 tháng điều trị |
5. ĐIỀU TRỊ VIÊM THẬN LUPUS TÁI PHÁT
Nếu viêm thận lupus tái phát sau khi đạt đáp ứng hoàn toàn hoặc không hoàn toàn, nên điều trị bằng phác đồ đã cho đáp ứng ban đầu hoặc phác đồ thay thế trong khuyến cáo lựa chọn đầu tay.
6. VIÊM THẬN LUPUS Ở CÁC TÌNH HUỐNG LÂM SÀNG ĐẶC BIỆT
6.1 VIÊM THẬN LUPUS VÀ THUYÊN TẮC VI MẠCH HUYẾT KHỐI
Chú thích: Chỉ số PLASMIC bao gồm số lượng tiểu cầu, các thông số tan máu, không có bệnh lý ác tính đang hoạt động, không có ghép tế bào gốc hoặc ghép tạng đặc, MCV, INR, Creatinine.
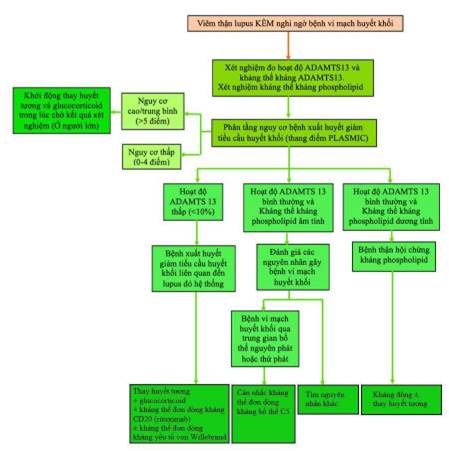
Hình 12. Sơ đồ điều trị viêm thận lupus kèm bệnh vi mạch huyết khối.
6.2 THAI KỲ Ở BỆNH NHÂN VIÊM THẬN LUPUS
- Nên tư vấn cho BN viêm thận lupus hoạt động các biện pháp tránh thai hiệu quả khi bệnh đang hoạt động, hoặc đang sử dụng các thuốc điều trị có tiềm năng gây dị dạng thai, và ít nhất trong vòng 6 tháng sau khi độ hoạt động của lupus đã giảm.
- Nên tiếp tục sử dụng HCQ trong suốt thời gian mang thai và bắt đầu aspirin liều thấp trước tuần 16 của thai kỳ để giảm nguy cơ xảy ra biến chứng trong thai kỳ.
- Được phép sử dụng glucocorticoids, HCQ, azathioprine và CNI trong thai kỳ.
6.3 ĐIỀU TRỊ VIÊM THẬN LUPUS KÈM SUY THẬN
Khi bị suy thận giai đoạn cuối, BN viêm thận lupus có thể được điều trị thay thế thận suy bằng lọc máu (TNT chu kỳ, lọc màng bụng) và ghép thận; ghép thận được ưu tiên chọn lựa hơn lọc máu.
Bệnh thận IgA là loại bệnh thường gặp nhất trong các bệnh cầu thận nguyên phát trên phạm vi toàn cầu và là nguyên nhân thường gặp gây BTM và suy thận giai đoạn cuối (ESRD), với tổn thương mô bệnh học là viêm cầu thận tăng sinh gian mạch do lắng đọng IgA lan toả ở gian mạch. Bệnh có biểu hiện lâm sàng đa dạng, từ không triệu chứng đến viêm cầu thận mạn, suy thận giai đoạn cuối. Dịch tễ học, biểu hiện lâm sàng, diễn tiến bệnh, kết cục lâu dài của bệnh thận IgA khác nhau rõ rệt giữa các chủng tộc khác nhau trên thế giới, với tần suất mắc và tỉ lệ suy thận cao nhất ở người Đông Á, tiếp theo là người da trắng, và tương đối hiếm gặp ở người da đen.
Bệnh thận IgA có thể là nguyên phát hoặc thứ phát do viêm mạch máu liên quan IgA (Henoch-Schonlein), nhiễm virus (HIV, viêm gan), bệnh viêm ruột, bệnh tự miễn, xơ gan, bệnh ác tính, hoặc liên quan nhiễm khuẩn có lắng đọng IgA chủ yếu ở gian mạch.
3.1 Lâm sàng
Biểu hiện lâm sàng có thể là đái máu đại thể xuất hiện sớm khi có các đợt nhiễm trùng, hội chứng thận hư, suy thận cấp, hoặc các dấu hiệu của BTM hay bệnh thận giai đoạn cuối. Một số BN không có triệu chứng lâm sàng.
3.2 Cận lâm sàng
Protein niệu, đái máu vi thể, các chỉ số chức năng thận gợi ý chẩn đoán, phối hợp các biểu hiện lâm sàng nếu có.
Chỉ có thể chẩn đoán xác định bệnh thận IgA bằng mô bệnh học dựa vào kỹ thuật miễn dịch huỳnh quang hoặc hóa mô miễn dịch, với hình ảnh lắng đọng IgA ưu thế lan toả ở gian mạch cầu thận. Đồng thời, có thể thấy tăng sinh tế bào gian mạch và chất nền gian mạch lan toả hoặc từng phần, tăng sinh tế bào nội mao mạch, xơ hoá cầu thận ổ - cục bộ, hyalin hoá thành động mạch, xơ hoá dưới nội mạch, viêm ống - kẽ thận, dẫn đến xơ hoá mô kẽ, teo ống thận trên hiển vi quang học. Một số trường hợp có biểu hiện tổn thương tối tiểu kèm lắng đọng IgA gian mạch. Khi có TTTC kèm theo có thể thấy các hồng cầu làm tắc nghẽn ống thận (hay gặp khi có TTTC kèm đái máu đại thể), VCT hoại tử, VCT tăng sinh hình liềm.
3.3 Chẩn đoán xác định
Hiện tại, chỉ có thể chẩn đoán xác định bệnh thận IgA dựa vào mô bệnh học trên tiêu bản sinh thiết thận.
Cần tìm nguyên nhân thứ phát với mọi BN bị bệnh thận IgA.
3.4 Phân loại mức độ
Phân loại mức độ cũng dựa vào hình ảnh mô bệnh học, bằng thang điểm MEST-C theo phân loại Oxford có cải biên (M: tăng sinh tế bào gian mạch, E: tăng sinh tế bào nội mao mạch, S: xơ hoá từng phần, T: xơ hoá mô kẽ/teo ống thận, C: liềm).
3.5 Chẩn đoán phân biệt
Cần phân biệt chẩn đoán với 1 số bệnh có biểu hiện lâm sàng tương tự như: viêm thận lupus, bệnh kháng thể đơn dòng gammaglobulin-IgA, bệnh thận do sán máng, VCT liên quan nhiễm Staphylococcus có lắng đọng IgA.
4.1 Nguyên tắc chung
Phối hợp các biện pháp điều trị không sử dụng thuốc ƯCMD (kiểm soát HA tích cực, ức chế tối ưu RAAS) với lối sống tích cực như giảm cân, tập thể dục, ngừng hút thuốc, chế độ ăn hạn chế muối. Sử dụng thuốc ƯCMD cho các tình huống chọn lọc.
4.2 Mục tiêu điều trị
Mục tiêu điều trị chính là giảm protein niệu. Bên cạnh đó cần kiểm soát tốt HA, giảm tốc độ tiến triển đến suy thận giai đoạn cuối và hạn chế tác dụng phụ do thuốc.
4.3 Điều trị cụ thể
- Các trường hợp bệnh thận IgA mức độ nhẹ chủ yếu được điều trị hỗ trợ tối ưu: điều chỉnh lối sống (ăn hạn chế muối, bỏ hút thuốc, giảm cân, tập thể dục), can thiệp giảm nguy cơ tim mạch khi cần thiết.
- BN có protein niệu > 0,5 g/ngày kèm hoặc không kèm THA nên được điều trị ban đầu với thuốc ức chế men chuyển hoặc thuốc ức chế thụ thể angiotensin II liều dung nạp tối đa (1B).
- BN có MLCT > 20m/phút nên được điều trị bằng thuốc ức chế SGLT2 (Dapagliflozin, Empagliflozin) để làm giảm tốc độ tiến triển BTM đến giai đoạn cuối.
- BN có nguy cơ tiến triển BTM cao (người có protein niệu >1 g/ngày kéo dài, mặc dù đã được điều trị bằng thuốc ức chế hệ renin angiotensin với liều tối đa theo khuyến cáo hoặc liều tối đa dung nạp được trong ít nhất 3 tháng và HA đạt mục tiêu khuyến cáo (HA tâm thu < 120 mmHg đo chuẩn tại phòng khám) trong ít nhất 3 tháng) mặc dù đã tối ưu hoá điều trị hỗ trợ có thể xem xét dùng thuốc ƯCMD để làm giảm protein niệu xuống < 1 g/ngày.
+ Điều trị với glucocorticoids trong 6 tháng. Cân nhắc nguy cơ và lợi ích của thuốc, đặc biệt khi BN có MLCT < 50 ml/phút/1,73 m2 (2B). Thận trọng khi sử dụng glucocorticoids cho những BN có MLCT < 30 ml/phút/1,73m2, đái tháo đường, béo phì (BMI > 30 kg/m2), nhiễm trùng tiềm ẩn (lao, viêm gan virus…), bệnh thứ phát (xơ gan), loét đường tiêu hoá thể hoạt động, rối loạn tâm thần chưa kiểm soát được, loãng xương nặng. Khi dùng glucocorticoids liều tương đương prednisone ≥ 0,5 g/kg/ngày cần phối hợp điều trị dự phòng Pneumocystis pneumonia, bảo vệ dạ dày và phòng loãng xương.
+ Cân nhắc cắt amydan đơn độc hoặc phối hợp với glucocorticoids bolus liều cao.
+ Có thể sử dụng glucocorticoids đường uống tác dụng tại chỗ lên các mảng Peyer ở đoạn xa của ruột non (Budesonide) để hạn chế các tác dụng không mong muốn của glucocorticoids tác dụng toàn thân.
- Các thuốc có tiềm năng làm giảm protein niệu cho BN bị bệnh thận IgA bao gồm các thuốc đối vận thụ thể endothelin, ức chế hoạt hóa bổ thể, ức chế hoạt hóa tế bào B, phối tử cảm ứng tăng sinh A (APRIL) có thể là các lựa chọn điều trị trong thời gian tới.
- BN có HCTH thể thay đổi tối thiểu nên được điều trị như bệnh cầu thận thay đổi tối thiểu.
- BN có VCT màng tăng sinh nên được điều trị như trường hợp có nguy cơ tiến triển BTM cao dù đã điều trị hỗ trợ tối ưu.
- BN có TTTC nên được điều trị hỗ trợ.
- BN có VCT tiến triển nhanh (giảm ≥ 50% MLCT trong vòng ≤ 3 tháng sau khi đã loại trừ các nguyên nhân VCT tiến triển nhanh khác như viêm mạch máu liên quan ANCA, bệnh kháng thể kháng màng đáy… và các nguyên nhân có thể hồi phục được như độc tính thuốc, các nguyên nhân trước thận hay sau thận...) nên được xem xét điều trị bằng cyclophosphamide phối hợp với glucocorticoids tương tự VCT liên quan ANCA. Áp dụng các biện pháp phòng ngừa nhiễm trùng khi sử dụng thuốc ƯCMD.
- BN nữ ở độ tuổi sinh sản có hoạt động tình dục cần được tư vấn các biện pháp tránh thai phù hợp. Khi có ý định mang thai, cần tư vấn ngừng thuốc ức chế hệ renin- angiotensin. Cần kiểm soát HA tối ưu bằng các thuốc hạ áp khác trước khi mang thai. Những phụ nữ có nguy cơ tiến triển BTM cao mặc dù đã điều trị hỗ trợ tối ưu có thể thử dùng thuốc ƯCMD trước khi mang thai để tối ưu hoá hoạt động miễn dịch và giảm protein niệu hơn là khởi trị thuốc ƯCMD khi đang mang thai.
- Mycophenolate mofetil và hydroxychloroquin mới chỉ được thử nghiệm ở người gốc Trung quốc với cỡ mẫu còn hạn chế nên cần cân nhắc khi chỉ định.
Cần có thông tin mô bệnh học (MEST-C) phối hợp với thông tin lâm sàng tại thời điểm sinh thiết thận để tiên lượng nguy cơ giảm 50% chức năng thận hoặc suy thận sau 5 năm khi sử dụng công cụ tiên đoán bệnh thận IgA Quốc tế (The International IgA Prediction Tool).
Nguy cơ tiến triển bệnh đến giai đoạn cuối được đánh giá theo bảng phân tầng nguy cơ tiến triển BTM (bảng 9).
Sau 20 năm theo dõi, khoảng 25% BN tiến triển tới suy thận giai đoạn cuối, 20% giảm chức năng thận tiến triển.
Các yếu tố tiên lượng xấu bao gồm: THA kiểm soát kém, protein niệu cao, giảm MLCT tại thời điểm chẩn đoán, có xơ hoá cầu thận và mô kẽ, teo ống thận trên mô bệnh học, tình trạng tăng acid uric, hút thuốc, thừa cân/béo phì.
BỆNH CẦU THẬN THAY ĐỔI TỐI THIỂU
Bệnh cầu thận thay đổi tối thiểu là nguyên nhân chính gây hội chứng thận hư (HCTH) ở trẻ em (khoảng 90%) và 10 - 25% trường hợp HCTH ở người lớn. Bệnh cầu thận thay đổi tối thiểu và xơ cầu thận ổ cục bộ là hai bệnh có cơ chế tổn thương về bệnh học chủ yếu ở tế bào Podocyte. Bệnh thường đáp ứng tốt với glucocorticoids.
Hầu hết các trường hợp mắc bệnh cầu thận thay đổi tối thiểu là vô căn, không có mối liên hệ rõ ràng với một bệnh nền hay yếu tố nào, nhưng được cho là có liên quan đến việc sản xuất yếu tố thấm cầu thận (glomerular permeability factor) lưu hành ảnh hưởng trực tiếp đến thành mao mạch cầu thận, dẫn đến mòn chân tế bào biểu mô Podocyte và hậu quả là gây thoát nhiều albumin vào nước tiểu.
3.1. Lâm sàng
Hầu hết BN có khởi phát đột ngột trong vài ngày đến một hoặc hai tuần với các dấu hiệu và triệu chứng của HCTH, thường xảy ra sau nhiễm trùng đường hô hấp trên hoặc nhiễm trùng toàn thân. Triệu chứng điển hình gồm phù tăng nhanh, giảm lượng nước tiểu, tăng cân nhanh, kèm các dấu hiệu toàn thân không đặc trưng. Một số BN có khó thở do tràn dịch màng phổi, tức bụng khi tràn dịch ổ bụng... Có một tỷ lệ nhỏ BN có THA, mức độ không nặng.
3.2. Cận lâm sàng
- Nước tiểu: protein niệu ≥ 3,5 g/24 giờ, với > 80% là albumin. Có thể có ít hồng cầu hoặc bạch cầu trong nước tiểu.
- Công thức máu: thường tăng hematocrite.
- Sinh hoá máu: albumin < 30 g/L (có thể giảm cả protein < 60 g/L). Rối loạn lipid máu, thường gặp tăng cholesterol > 6,5 mmol/L. Một số BN có tăng urê và creatinine.
- Siêu âm thận: thường ít biến đổi.
- Sinh thiết thận: điển hình là cầu thận bình thường trên hiển vi quang học, không có lắng đọng miễn dịch trên hiển vi miễn dịch huỳnh quang. Đôi khi chỉ có tăng sinh nhẹ tế bào gian mạch (3-4 tế bào/khoang gian mạch) và chất mầm gian mạch, hoặc lắng đọng nhẹ C3 gian mạch. Tổn thương chỉ được phát hiện bằng hiển vi điện tử, gồm mất chân và sưng phồng podocytes, có thể lắng đọng đặc điện tử nhẹ ở gian mạch cầu thận.
3.3. Chẩn đoán xác định
Biểu hiện phù điển hình của HCTH không kèm THA hay suy thận; protein niệu cao, chọn lọc nhưng không kèm hồng cầu và bạch cầu niệu gợi ý chẩn đoán.
Chẩn đoán xác định dựa vào hình ảnh mô bệnh học.
3.4. Chẩn đoán phân biệt
Cần phân biệt chẩn đoán với HCTH do xơ cầu thận ổ-cục bộ, bệnh thận IgM, bệnh thận C1q.
4. ĐIỀU TRỊ BỆNH CẦU THẬN THAY ĐỔI TỐI THIỂU CÓ HCTH
4.1. Nguyên tắc chung
Cần điều trị theo cơ chế bệnh sinh, giảm nhẹ triệu chứng, dự phòng và điều trị biến chứng, kết hợp dùng thuốc với điều chỉnh chế độ ăn, uống, sinh hoạt. Về lâu dài cần dự phòng bệnh tái phát.
4.2. Điều trị cụ thể
4.2.1. Điều trị theo cơ chế bệnh sinh
- Glucocorticoids:
+ Liều tấn công: prednisolon 1 mg/kg/ngày (tối đa 80 mg) hoặc 2 mg/kg cách ngày (tối đa 120 mg), nên uống 1 lần trong khoảng 7 giờ đến 9 giờ sáng để giảm thiểu sự ức chế tuyến thượng thận; thời gian tối thiểu 4 tuần, tối đa 16 tuần.
+ Liều giảm dần: khi BN có đáp ứng hoàn toàn (protein niệu về âm tính hoặc < 0,2 g/24 giờ sau đợt điều trị tấn công) có thể giảm liều prednisone hàng ngày từ 5 đến 10 mg/tuần, duy trì đủ thời gian điều trị glucocorticoids ít nhất 24 tuần.
- Thuốc ức chế miễn dịch: chỉ định cho BN phụ thuộc hoặc kháng glucocorticoids, hoặc hay tái phát.
+ Glucocorticoids: prednisolon 0,5 mg/kg/ngày phối hợp với
+ Cyclophosphamid 2 mg/kg/ngày x 8 -12 tuần, hoặc với
+ Ức chế calcineurin (Cyclosporine 3 - 5 mg/kg/ngày để đạt nồng độ 60-150ng/ml hoặc tacrolimus 0,05 - 0,1 mg/kg/ngày để đạt nồng độ 5-10ng/ml) x 8-12 tuần, hoặc với
+ Mycophenolat mofetil 1000 - 2000 mg/ngày x 8-12 tuần.
+ Khi BN có đáp ứng, giảm dần liều glucocorticoids rồi ngừng trong 4 - 6 tuần.
4.2.2. Điều trị triệu chứng
- Giảm phù bằng lợi tiểu khi đủ dịch (lợi tiểu quai hoặc furosemid tĩnh mạch hoặc uống tùy theo đáp ứng của BN), duy trì lượng nước tiểu hàng ngày 1,5 - 2 lít.
- Phục hồi thể tích tuần hoàn bằng albumin và/hoặc plasma tươi và/hoặc dung dịch cao phân tử để tăng đáp ứng với lợi tiểu.
- Phối hợp lợi tiểu kháng aldosterone với furosemide nếu phù đáp ứng kém hoặc không đáp ứng với lợi tiểu quai/furosemide.
- Phối hợp thuốc ƯCMC hoặc ƯCTT AT1 của angiotensin nếu không có chống chỉ định để kiểm soát HA (khi có THA) và tăng hiệu quả giảm protein niệu.
- Cân nhắc chỉ định thuốc hạ lipid máu cho các BN có nguy cơ biến chứng tắc mạch như tuổi cao, THA từ trước, có đái tháo đường, hút thuốc, nằm lâu do thể trạng yếu, tăng đông và cô đặc máu kéo dài. Ưu tiên lựa chọn nhóm statin.
4.2.3. Điều trị và dự phòng biến chứng
- Sàng lọc chủ động nhiễm trùng tiềm tàng trước khi khởi trị ƯCMD và điều trị dự phòng khi có chỉ định, hướng dẫn BN giữ vệ sinh, giảm thời gian điều trị trong bệnh viện để phòng ngừa nhiễm trùng. Khi có nhiễm khuẩn cần dùng kháng sinh không độc hoặc ít độc với thận.
- Sàng lọc các BN có nguy cơ tăng đông và tắc mạch cao, điều trị dự phòng bằng một trong các nhóm thuốc: chống kết tập tiểu cầu (như aspirin, clopidogrel), thuốc kháng vitamin K (như coumadin, acenocoumarol), heparin trọng lượng phân tử thấp (như fraxiparin, enoxaparin) hoặc heparin không phân đoạn. Nếu có tắc nghẽn mạch (tĩnh mạch hoặc động mạch) được phát hiện trong vòng 6 giờ đầu có thể điều trị tích cực bằng thuốc tiêu sợi huyết.
4.2.4. Chế độ ăn uống và sinh hoạt
- Hạn chế natri/muối (không quá 2g natri/ngày).
- BN chưa bị giảm chức năng thận có thể ăn 0,8-1g protein/kg/ngày (cân khô) cộng thêm 1g protein cho mỗi g protein mất qua nước tiểu ( tối đa 5g/ngày). Ưu tiên nguồn protein từ thực vật.
- BN có suy thận cần giảm lượng protein cung cấp hàng ngày theo chức năng thận.
- Cung cấp đủ năng lượng 35kcal/kg/ngày. Nếu MLCT <60ml/ph/1,73m2 cung cấp năng lượng 30-35kcal/kg/ngày.
- Cung cấp đủ vitamin, chất khoáng, nhất là canxi.
- BN thiểu niệu hoặc vô niệu cần hạn chế kali trong thức ăn vì có nguy cơ tăng kali máu. BN đái nhiều do dùng thuốc lợi tiểu gây mất kali, làm giảm kali máu cần bù kali bằng chế độ ăn hoặc thuốc chứa kali.
5.1. Tiến triển
- BN bị bệnh cầu thận thay đổi tối thiểu đáp ứng hoàn toàn với điều trị có tiên lượng tốt. Khoảng 5-10% BN trưởng thành tự thuyên giảm sớm (trong vòng vài tháng). Tuy nhiên, nếu không được điều trị BN có nguy cơ chuyển nặng, có thể có biến chứng huyết khối tắc mạch, TTTC và nhiễm trùng.
- BN có giảm MLCT trong giai đoạn thận hư có thể phục hồi chức năng thận sau khi HCTH được giải quyết.
- BN kháng glucocorticoid có thể tiến triển đến giai đoạn cuối, đặc biệt là những BN có TTTC dai dẳng. Những BN này thường có tổn thương xơ cầu thận ổ cục bộ, nhưng chưa được chẩn đoán ở thời điểm ban đầu.
5.2. Biến chứng
- Các biến chứng của HCTH: tắc mạch, nhiễm khuẩn, suy thận cấp, suy dinh dưỡng, giảm canxi máu.
- Biến chứng do thuốc, đặc biệt glucocorticoid và các thuốc ƯCMD: nhiễm khuẩn/ nhiễm trùng cơ hội, viêm phổi, giảm bạch cầu, thiếu máu, tăng enzym gan, xuất huyết tiêu hóa, tăng đường máu, tăng HA, loãng xương…
6.1. Quản lý bệnh (tái khám)
- Đánh giá lâm sàng và xét nghiệm hàng tháng protein máu, albumin máu, chức năng thận, tỷ lệ protein trên creatinin niệu (uPCR) hoặc protein niệu 24 giờ và các xét nghiệm để tầm soát và phát hiện kịp thời các tác dụng không mong muốn của thuốc.
- BN ổn định cần được tái khám định kỳ theo khuyến cáo đối với quần thể chung hoặc với người mắc BTM.
6.2. Phòng bệnh
- Không có biện pháp dự phòng đặc hiệu. BN đã điều trị ổn định cần dự phòng tổn thương thận hoặc tái phát bằng các biện pháp sau:
- Tránh hoặc hạn chế dùng các thuốc có thể gây tổn thương cầu thận tối thiểu như NSAIDs, hợp chất chứa nguyên tố lithium, kháng sinh...
- BN có cơ địa dị ứng cần tránh tiếp xúc với các dị nguyên: nọc ong, sứa, phấn hoa...
- Phòng ngừa nhiễm trùng: vệ sinh răng miệng, tránh nhiễm lạnh, điều trị các nhiễm trùng (viêm gan virus B, C, HIV, kí sinh trùng...).
- Điều trị các bệnh ác tính.
Xơ cầu thận ổ cục bộ (focal segmental glomerulosclerosis: FSGS) là một dạng tổn thương cầu thận biểu hiện bằng xơ, tăng sinh collagen ở một số vùng của cầu thận, xuất hiện ở một số cầu thận. Biểu hiện lâm sàng có thể có protein niệu đơn thuần; tăng HA đơn thuần; HCTH; suy thận hoặc hỗn hợp. BN có HCTH đáp ứng kém với glucocorticoids.
Căn nguyên chưa rõ ràng. Xơ cầu thận ổ cục bộ có thể là nguyên phát do yếu tố độc tế bào podocyte lưu hành hoặc di truyền do đột biến gen tổng hợp các protein màng đáy cầu thận và tế bào podocyte. Xơ cầu thận ổ cục bộ có thể là thứ phát do nhiễm virus (HIV, CMV, Parvo virus B19, EBV, HCV, SARS-COV-2...), thuốc (thuốc ức chế mTOR, ức chế calcineurin như Tacrolimus/Cyclosporin, Anthracycline, Heroin, hợp chất chứa nguyên tố lithium, Interferon, NSAIDs, Pamidronate...), đáp ứng thích nghi với tăng áp lực cầu thận (béo phì, thiểu sản thận một bên, cắt thận 1 phần, loạn sản thận, bệnh thận do trào ngược, hồng cầu hình liềm, tuổi tác)...
3.1. Lâm sàng
Biểu hiện lâm sàng đa dạng:
- HCTH điển hình.
- Hội chứng suy thận
- Thể tiềm tàng không có triệu chứng lâm sàng, chỉ có protein niệu và hồng cầu niệu.
- Thể THA với triệu chứng ưu thế là THA, kèm protein niệu và hồng cầu niệu.
- Thể hỗn hợp có biểu hiện HCTH trên lâm sàng và suy thận mạn.
3.2. Cận lâm sàng
- Nước tiểu có protein niệu ở các mức độ khác nhau, có thể ở mức thận hư (≥ 3,5g/24 giờ, có khi lên tới 30 - 40g/24 giờ), có thể có HC niệu.
- Huyết học: thiếu máu xuất hiện ở BN thể suy thận và hỗn hợp.
- Sinh hoá: BN HCTH có albumin máu giảm xuống dưới 30g/l, protein toàn phần giảm xuống dưới 60g/l, rối loạn lipid máu (thường tăng cholesterol > 6,5mmol/L). BN thể suy thận hoặc hỗn hợp có tăng urê, creatinine, acid uric máu.
- Siêu âm thận: BN suy thận hoặc hỗn hợp có thận tăng âm, giảm hoặc mất ranh giới tuỷ vỏ.
- Sinh thiết thận:
+ Hiển vi quang học: xơ hóa xuất hiện và tiến triển tại một phần của một số cầu thận, thường ở vùng ranh giới vỏ - tủy và phát triển về phía vỏ thận tạo thành ổ. Hyalin hóa và xơ hóa cục bộ cầu thận, tập trung ở vùng rốn của bó mao mạch cầu thận. Hay gặp dính mao mạch vùng cầu thận bị tổn thương với bao Bowman. Phần mao mạch cầu thận còn lại và những cầu thận không bị xơ hóa trông có vẻ bình thường, nhưng giãn rộng hơn nhiều so với bệnh thay đổi tối thiểu. Teo ống thận từng ổ từ giai đoạn sớm. Khi bệnh tiến triển, số tiểu thùy bị xơ hóa trong một cầu thận và số cầu thận bị xơ hóa tăng lên, dẫn đến mất chức năng thận.
+ Hiển vi miễn dịch huỳnh quang: lắng đọng IgM, C3 dạng ổ, cục bộ ở vùng cầu thận bị xơ hóa. Lắng đọng IgG hoặc IgA lan tỏa ở khoang gian mạch cầu thận gợi ý tổn thương do VCT tăng sinh gây xơ hóa.
+ Hiển vi điện tử: màng đáy của các cầu thận bị tổn thương nhăn nheo, dày và nứt rạn. Quai mao mạch xẹp, khoang dưới nội mô và gian mạch giãn rộng. Lắng đọng đặc điện tử dạng hạt ở vùng gian mạch của các cầu thận bị tổn thương. Có thể thấy hiện tượng mất chân lồi và khe lọc. Các tế bào biểu mô bị hốc hóa và có thể bị bong ra khỏi màng đáy mao mạch hoặc tạo thành các vùng dưới biểu mô chứa một loại vật chất dạng sợi sáng.
4.1. Chẩn đoán xác định
Chẩn đoán xác định thể tổn thương phải dựa vào kết quả sinh thiết thận. Cần đánh giá tổng thể, toàn diện để tìm nguyên nhân. Có thể cần đánh giá và phân loại tổn thương xơ cứng ổ cục bộ phù hợp bằng kính hiển vi điện tử. Một số trường hợp cần làm xét nghiệm gen.
4.2. Chẩn đoán phân biệt
- Xơ cầu thận ổ toàn bộ: Xơ cứng cầu thận ổ toàn bộ thường là biểu hiện của lão hóa và/hoặc THA và có thể chồng lấp tổn thương xơ cầu thận ổ cục bộ, đặc biệt ở những BN lớn tuổi. BN xơ cầu thận ổ toàn bộ có protein niệu ở nhiều mức độ khác nhau và thường không có HCTH.
- Bệnh cầu thận thay đổi tối thiểu.
- Lành tổn thương do viêm trước đó: ví dụ, do bệnh thận IgA hoạt động, viêm mạch máu nhỏ hoặc viêm thận lupus.
5.1. Nguyên tắc chung
Cần điều trị nguyên nhân của xơ cầu thận ổ cục bộ, áp dụng điều trị hỗ trợ cho tất cả các thể xơ cầu thận ổ cục bộ và cần có kế hoạch quản lý dài hạn, dự phòng tái phát.
5.2. Điều trị cụ thể
5.2.1. Các biện pháp điều trị hỗ trợ
Áp dụng cho mọi BN xơ cầu thận ổ cục bộ, bao gồm:
- Kiểm soát HA, giảm protein niệu bằng chế độ ăn giảm muối và protein, thuốc ức chế RAAS; thuốc ức chế SGLT2 (Dapagliflozin, Empagliflozin);
- Điều trị rối loạn lipid máu;
- Thuốc chống đông máu (với 1 số trường hợp nhất định);
- Điều trị phù và cung cấp đủ dinh dưỡng
5.2.2. Điều trị xơ cầu thận ổ cục bộ
Bệnh nhân có HCTH đơn thuần:
- Khởi đầu prednisolon 1 mg/kg/ngày (tối đa 80 mg/Lần) hoặc 2 mg/kg cách ngày (tối đa 120 mg/Lần) trong tối thiểu 4 tuần, tối đa 16 tuần; nếu đáp ứng tốt có thể giảm liều dần (5- 10 mg/tuần) và duy trì trên 6 tháng.
- HCTH tái phát, kháng glucocorticoids hoặc có chống chỉ định glucocorticoids: cân nhắc Cyclosporine 3-5 mg/kg/ngày để đạt nồng độ 100-175ng/ml hoặc tacrolimus 0,05 - 0,1 mg/kg/ngày để đạt nồng độ 5-10ng/ml x 1 - 2 năm, có thể giảm liều ở năm thứ 2.
- HCTH không đáp ứng cyclosporine hoặc tacrolimus: cân nhắc Mycophenolat mofetil 1000 mg/ngày kết hợp prednisolon 0,5 mg/kg/ngày.
Bệnh nhân có thể hỗn hợp trên lâm sàng:
Chiến lược điều trị tương tự BN có HCTH đơn thuần, kèm điều trị triệu chứng (THA, thiếu máu,rối loạn lipid máu...), chế độ ăn giảm protein và bổ sung viên Keto acid, bảo vệ thận và giảm tốc độ tiến triển đến giai đoạn cuối.
Xơ cầu thận ổ cục bộ nguyên phát không được điều trị thường tiến triển đến bệnh thận giai đoạn cuối. Chỉ dưới 10% BN có HCTH tự thuyên giảm hoàn toàn, hay gặp hơn ở BN có chức năng thận bình thường và protein niệu dưới mức thận hư. Việc điều trị dài hơn giúp tăng tỷ lệ đáp ứng lên tới 70% và cải thiện tiên lượng chung của bệnh. Bệnh có thể tái phát trên thận ghép.
7.1. Quản lý
Cần theo dõi chặt chẽ tất cả BN bị xơ cầu thận ổ cục bộ nguyên phát đang điều trị để đánh giá đáp ứng điều trị, theo dõi nồng độ thuốc CNI và chức năng thận mỗi 1 - 2 tháng một lần.
7.2. Phòng bệnh
Không có biện pháp dự phòng xơ cầu thận ổ cục bộ nguyên phát, hướng dẫn BN:
- Tránh, hạn chế dùng các thuốc NSAIDs, hợp chất chứa nguyên tố lithium, kháng sinh, pamidronate, heroin...
- Điều trị các bệnh do virus (viêm gan virus B, C, HIV, CMV, EBV,...);
- Điều trị các bệnh có thể gây tăng áp lực lọc cầu thận: đái tháo đường, bệnh thận trào ngược, hồng cầu hình liềm…
- Duy trì cân nặng lý tưởng, tránh thừa cân béo phì, không hút thuốc, tăng vận động.
Bệnh cầu thận màng gặp ở khoảng 1/3 các trường hợp BN trưởng thành có HCTH được sinh thiết thận. Bệnh nhân thường ở độ tuổi 40 - 60, nam gặp nhiều hơn nữ. Khoảng 75%- 80% bệnh cầu thận màng ở người trưởng thành là nguyên phát, do các tự kháng thể chống lại các kháng nguyên trên tế bào Podocyte; 20 -25% còn lại là thứ phát, liên quan đến một số tình trạng bệnh lý như viêm gan virus B, bệnh tự miễn, viêm tuyến giáp, bệnh ác tính và sử dụng một số loại thuốc như NSAIDs, vàng, penicillamine và captopril. Biểu hiện lâm sàng đa dạng, như protein niệu đơn thuần, THA, HCTH và hỗn hợp. Bệnh hay có biến chứng tăng đông gây tắc mạch.
- Bệnh cầu thận màng nguyên phát là bệnh tự miễn, do các tự kháng thể chống lại một số kháng nguyên trên tế bào podocyte [thụ thể phospholipase - A2 (PLA2R), thrombospondin type-1 domain-containing 7a (THSD7A), neural epidermal growth factor-like 1 (NELL1), semaphorin 3b (SEMA3B), the serine protease high- temperature requirement a1 (HTRA1), protocadherin 7 (PCDH7)]...
- Bệnh cầu thận màng thứ phát thường do một số nguyên nhân như:
+ Thuốc: NSAIDs, penicillamine, muối vàng, bucillamine, alemtuzumab, muối thủy ngân, thủy ngân, thuốc ức chế yếu tố hoại tử u TNF (etanercept, infliximab, adalimumab).
+ Nhiễm trùng: nhiễm virus viêm gan B,C; giang mai; ký sinh trùng...
+ Bệnh ác tính: 5 - 20 % người trưởng thành mắc bệnh cầu thận màng, đặc biệt người trên 65 tuổi, có khối u ác tính.
+ Lupus ban đỏ hệ thống: 10 - 20 % BN viêm thận lupus có bệnh cầu thận màng, được gọi là viêm thận lupus lớp V.
- Bệnh cầu thận màng sau ghép thận có thể là tái phát (ví dụ khi kháng thể anti-PLA2R dương tính tại thời điểm ghép) hoặc có thể xuất hiện mới.
- Bệnh cầu thận màng đồng thời với các bệnh cầu thận khác có thể gặp ở BN đái tháo đường, viêm cầu thận hình liềm, xơ hóa cầu thận ổ cục bộ, bệnh thận IgA, và chưa rõ mối quan hệ là nhân - quả hay bệnh đồng mắc.
3.1. Lâm sàng
- Biểu hiện trên lâm sàng có thể là:
- Hội chứng thận hư: gặp ở khoảng 80% BN mắc bệnh cầu thận màng với biểu hiện phù toàn thân tăng nhanh, mức độ nặng, có thể kèm tràn dịch đa màng hoặc phù não. BN có giảm số lượng nước tiểu, thường dưới 1000ml, có thể thiểu niệu vô niệu.
- Hội chứng suy thận: với các biểu hiện lâm sàng của nhiễm độc tăng urê.
- Thể tiềm tàng: không có triệu chứng lâm sàng, chỉ có protein niệu và hồng cầu niệu.
- Thể THA: triệu chứng chiếm ưu thế là THA, kèm protein niệu và hồng cầu niệu.
- Hỗn hợp: biểu hiện lâm sàng của HCTH và suy thận mạn.
3.2. Cận lâm sàng
- Nước tiểu: có protein niệu ở các mức độ khác nhau, từ 1-3g/24 giờ đến mức thận hư (≥ 3,5g/24 giờ, có khi lên tới 30 - 40g/24 giờ). HC niệu thường ít.
- Huyết học: thiếu máu ở BN thể suy thận và hỗn hợp.
- Sinh hoá: khi có HCTH protein máu toàn phần giảm xuống dưới 60g/l, albumin máu giảm xuống dưới 30g/l, lipid máu toàn phần tăng, cholesterol thường > 6,5mmol/L. Tăng urê, creatinine, acid uric máu gặp ở thể suy thận; hỗn hợp.
- Siêu âm thận: nhu mô thận tăng âm, giảm hoặc mất ranh giới tuỷ vỏ ở thể suy thận hoặc hỗn hợp.
- Sinh thiết thận: giúp chẩn đoán xác định thể tổn thương mô bệnh học
+ Hiển vi quang học: dày lan toả màng đáy mao mạch cầu thận, các tổn thương hình gai nhú trong màng đáy dưới biểu mô tiến triển song song với mức độ hoạt động của bệnh. Ở giai đoạn muộn các gai nhú dính với nhau phía trên các lắng đọng làm cho màng đáy có cấu trúc dày giống dây thừng.
+ Hiển vi miễn dịch huỳnh quang: các lắng đọng dạng hạt mịn chứa IgG và C3 ở thành mao mạch cầu thận, đôi khi thấy lắng đọng IgM hoặc IgA, không thấy IgE.
+ Hiển vi điện tử: lắng đọng đặc điện tử dưới biểu mô và trong màng đáy cầu thận. Độ dày màng đáy không đều. Tế bào podocyte xẹp
4.1. Chẩn đoán xác định
Chẩn đoán xác định dựa vào hình ảnh mô bệnh học trên tiêu bản sinh thiết thận. Có thể sử dụng dấu ấn kháng thể kháng PLA2R trong máu hoặc trên mô thận để chẩn đoán bệnh cầu thận màng nguyên phát.
4.2. Chẩn đoán phân biệt
Cần chẩn đoán phân biệt với các týp tổn thương mô bệnh học khác có biểu hiện lâm sàng tương tự, như bệnh cầu thận thay đổi tối thiểu, xơ cầu thận ổ cục bộ, VCT màng tăng sinh, bệnh thận IgA, bệnh thận đái tháo đường, viêm thận lupus.
5.1. Nguyên tắc chung
Cần điều trị nguyên nhân gây bệnh cầu thận màng thứ phát. Điều trị theo cơ chế bệnh sinh đối với bệnh cầu thận màng nguyên phát (thuốc ƯCMD). Áp dụng các biện pháp điều trị hỗ trợ cho tất cả BN mắc bệnh cầu thận màng. Cần quản lý BN dài hạn và dự phòng bệnh tái phát.
5.2. Điều trị cụ thể
5.2.1. Các biện pháp điều trị hỗ trợ
Áp dụng cho tất cả BN mắc bệnh cầu thận màng, bao gồm:
- Kiểm soát HA và giảm protein niệu bằng chế độ ăn giảm muối và protein, thuốc ức chế RAAS, thuốc ức chế SGLT2 (Dapagliflozin, Empagliflozin).
- Điều trị rối loạn lipid máu.
- Thuốc chống đông máu (với 1 số trường hợp nhất định).
- Điều trị phù và cung cấp đủ dinh dưỡng
5.2.2. Điều trị bệnh cầu thận màng
Bệnh cầu thận màng nguyên phát
Chỉ cân nhắc điều trị ƯCMD cho những BN có ít nhất 1 yếu tố nguy cơ tổn thương thận tiến triển dẫn đến mất chức năng thận, hoặc có các biến chứng nguy hiểm của HCTH (như TTTC, nhiễm trùng, huyết khối tắc mạch).
BN có nguy cơ cao mất dần chức năng thận khi có MLCT <60ml/phút và/hoặc protein niệu >8g/ngày từ 6 tháng trở lên; hoặc có MLCT bình thường, protein niệu >3,5g/ngày nhưng không giảm từ 50% trở lên sau 6 tháng điều trị bảo tồn với ƯCMC/ƯCTT , kèm theo ít nhất 1 trong số những yếu tố: 1) Albumin máu <25g/L; 2) Kháng thể kháng PLA2- R >50RU/ml; 3) α1-microglobulin nước tiểu >40 µg/phút; 4) IgG nước tiểu >1 µg/phút; 5) β2-microglobulin nước tiểu >250mg/ngày; 6) Chỉ số chọn lọc (độ thanh thải IgG/độ thanh albumin) >0,2. Khuyến cáo điều trị bằng Rituximab hoặc Cyclophosphamid xen kẽ với glucocorticoid hàng tháng trong vòng 6 tháng; hoặc CNI trong 6 tháng trở lên tùy theo nguy cơ được đánh giá. Có thể điều chỉnh điều trị dựa vào theo dõi nồng độ kháng thể kháng PLA2R.
Không khởi trị ƯCMD cho BN có MLCT < 30 ml/p và kích thước thận trên siêu âm nhỏ hơn 8 cm hoặc đang có nhiễm khuẩn nặng. Không dùng glucocorticoids hoặc Mycophenolat mofetil đơn độc.
Khởi trị bằng glucocorticoids truyền tĩnh mạch và uống phối hợp thuốc alkyl hóa:
- Tháng 1, 3, 5: Methyprednisolon 1g/ngày TM 3 ngày liên tiếp, Prednisolon 0,5mg/kg/ngày uống 27 ngày tiếp theo.
- Tháng 2, 4, 6: có thể dùng Cyclophosphamid 2mg/kg/ngày, uống 30 ngày.
Liều các thuốc alkyl hóa được điều chỉnh theo tuổi và mức lọc cầu thận.
Cần sinh thiết thận lại nếu sau 6 tháng BN không đáp ứng hoặc nếu chức năng thận giảm nhanh (creatinin tăng gấp đôi sau 1 - 2 tháng).
BN không đáp điều trị ban đầu có thể chuyển sang Cyclosporine 3 - 5 mg/kg/ngày hoặc tacrolimus 0,05 - 0,1 mg/kg/ngày x 4 - 8 tuần, sau đó giảm 1/2 liều, duy trì tối thiểu 12 tháng. Định lượng nồng độ thuốc định kỳ hoặc khi có giảm chức năng thận không rõ nguyên nhân để tránh độc thận do thuốc.
BN bị tái phát có thể dùng lại phác đồ trước đó đã cho đáp ứng tốt, với phác đồ khởi đầu chỉ dùng lại một lần.
BN có thể hỗn hợp trên lâm sàng: có thể áp dụng chiến lược điều trị như đối với BN có HCTH, kèm điều trị triệu chứng THA, thiếu máu, chế độ ăn giảm protein có bổ sung viên Keto analog và bảo vệ thận tránh tổn thương.
Bệnh cầu thận màng thứ phát
Cần điều trị hoặc ngừng các nguyên nhân gây bệnh cầu thận màng thứ phát tùy theo từng trường hợp.
BN mắc bệnh cầu thận màng nguyên phát có bệnh tự thoái lui hoặc thoái lui do điều trị thường có tiên lượng lâu dài tốt. Khi không được điều trị khoảng 5 - 30% BN tự thuyên giảm hoàn toàn sau 5 năm, khoảng 25 - 40% BN tự thuyên giảm một phần (protein niệu ≤ 2,0 g/ngày) sau 5 năm. BN HCTH không được điều trị sẽ tiến triển đến bệnh thận giai đoạn cuối với tỷ lệ 14% sau 5 năm, 35% sau 10 năm, và 41% sau 15 năm.
BN được điều trị bằng Cyclophosphamid và glucocorticoids đạt thuyên giảm hoàn toàn protein niệu ở 30 - 40%; thuyên giảm 1 phần ở 30 - 50%, và bệnh thận tiến triển chỉ khoảng 10%. BN có đáp ứng với điều trị dù chỉ 1 phần cũng có tiên lượng tốt hơn BN không đáp ứng hoặc có bệnh tiến triển.
7.1. Quản lý bệnh (tái khám)
Cần theo dõi chặt chẽ đáp ứng điều trị cho tất cả BN bị bệnh cầu thận màng đang điều trị. Cần theo dõi nồng độ cyclosporin hoặc tacrolimus và chức năng thận mỗi 1 - 2 tháng một lần. Xem xét sinh thiết thận lại khi bệnh kháng trị.
7.2. Phòng bệnh
Không có biện pháp dự phòng hiệu quả cho bệnh cầu thận màng nguyên phát. Dự phòng bệnh cầu thận màng thứ phát bằng cách tránh hoặc hạn chế dùng các thuốc NSAIDs, muối thủy ngân, muối vàng…, điều trị nhiễm trùng (viêm gan virus B, C, HIV, giang mai….), tầm soát và điều trị các bệnh ác tính.
VIÊM CẦU THẬN THỨ PHÁT SAU NHIỄM TRÙNG
Viêm cầu thận thứ phát sau nhiễm trùng là khái niệm để chỉ VCT cấp sau nhiễm trùng, đa phần gặp ở trẻ em. Bệnh xuất hiện sau khởi phát nhiễm trùng từ 1 tuần đến vài tuần tuỳ theo từng loại tác nhân, tiến triển cấp tính, có thể khỏi hoàn toàn nhưng một số ít BN có thể tiến triển đến BTM.
Tác nhân gây bệnh có thể là vi khuẩn, virus, ký sinh trùng và nấm
- Vi khuẩn: Liên cầu tan huyết β nhóm A, Tụ cầu, Leptospirosis, Salmonella typhi, Escherichia coli, Pseudomonas, Thương hàn, Phế cầu, Mycoplasma pneumonia
- Virus: viêm gan B, Cytomegalovirus, Epstein-Barr virus, sởi, quai bị, varicella Zoster, parvovirus B19, Coxsackie
- Ký sinh trùng: sốt rét, Toxoplasmosis, Trypanosomiasis, Schistosomiasis, Filariasis
- Nấm: Coccidioides immitis.
3.1. Lâm sàng
Triệu chứng thường xuất hiện sau nhiễm trùng ở họng 1-2 tuần hoặc sau nhiễm trùng ở da 3-6 tuần. Biểu hiện lâm sàng đa dạng, từ nhẹ với phù, đái máu vi thể, đến nặng với sốt cao, nhức đầu, mệt mỏi, đái máu đại thể, thiểu niệu, vô niệu, THA kèm theo bệnh lý ở não, tim…
Đái máu xuất hiện ở hầu hết BN, nhưng chỉ khoảng 1/3 BN có đái máu đại thể (thường kéo dài từ 7-10 ngày). Đái máu vi thể thường gặp hơn, có thể tồn tại đến 6 tháng.
Phù gặp ở khoảng 65-90% BN, mức độ từ nhẹ đến trung bình, do ứ muối và nước, giảm khi ăn nhạt, thường kéo dài 7-10 ngày.
Tăng huyết áp thường xảy ra ở 60% đến 80% BN và khoảng một nửa trong số đó cần điều trị hạ áp. THA có xu hướng diễn biến cấp tính trong một thời gian sau đó trở về bình thường sau khoảng 10 ngày.
Thiểu niệu có thể gặp ở khoảng 1/2 số BN và là một trong những nguyên nhân khiến BN phải đi khám.
Có thể gặp triệu chứng của nhiễm trùng như sốt, viêm họng, tổn thương da…
3.2. Cận lâm sàng
- Phân tích và xét nghiệm tế bào cặn lắng nước tiểu thấy có hồng cầu biến dạng (nguồn gốc từ cầu thận), có thể kèm bạch cầu và đôi khi có trụ hạt. Tỷ trọng nước tiểu thường cao hơn bình thường do nước tiểu bị cô đặc. Protein niệu ở mức vừa đến nhiều.
- Công thức máu: hay có tăng số lượng bạch cầu, công thức chuyển trái khi nhiễm vi khuẩn, bạch cầu giảm khi nhiễm vi rút. Một tỷ lệ nhỏ BN có thiếu máu, thường ở mức độ nhẹ (trừ khi có bệnh máu phối hợp).
- Sinh hoá máu: tăng urê, creatinine máu khi có TTTC, thường là tạm thời và sẽ trở về bình thường. Nếu thấy tăng dần và kéo dài kèm theo thiểu niệu cần nghĩ tới VCT cấp tiến triển nhanh. Natri máu có thể giảm. Kali bình thường hoặc tăng khi có suy thận kèm thiểu niệu/vô niệu. Protid, albumin máu có thể giảm nếu đi kèm HCTH.
- Xét nghiệm miễn dịch: có thể giảm nồng độ bổ thể, tăng hiệu giá kháng thể kháng liên cầu, giang mai…
- Siêu âm thận: tăng kích thước 2 thận đồng đều.
- Sinh thiết thận: cho hình ảnh tổn thương viêm điển hình
+ Hiển vi quang học: kích thước cầu thận to hơn bình thường, phù nề bó mao mạch làm hẹp khoang Bowmann, nhiều tế bào viêm (chủ yếu bạch cầu đơn nhân, bạch cầu đa nhân, đôi khi cả bạch cầu lympho và bạch cầu ái toan) xâm nhập lòng mao mạch cầu thận. Phù nề và tăng sinh tế bào nội mao mạch cầu thận, tăng sinh tế bào gian mạch, nở rộng khoang gian mạch.
+ Hiển vi miễn dịch huỳnh quang: lắng đọng phức hợp miễn dịch chứa IgG, C3, đôi khi cả IgM, C4, fibrin/fibrinogen dạng hạt mịn và hạt thô dọc quai mao mạch cầu thận và trong khoang gian mạch, lắng đọng dưới tế bào biểu mô tạo thành hình giống bướu lạc đà gọi là lắng đọng hình gò. Không thấy lắng đọng IgA.
+ Hiển vi điện tử: có các hạt, đám đặc điện tử ở gian mạch và màng đáy cầu thận. Có thể thấy lắng đọng đặc điện tử dạng gò dưới biểu mô.
4.1. Chẩn đoán xác định
Triệu chứng lâm sàng xuất hiện sau nhiễm trùng từ 1 đến vài tuần, gồm phù, đái máu, THA. Xét nghiệm nước tiểu có protein niệu, hồng cầu niệu, có thể kèm trụ hồng cầu. Hồng cầu niệu chủ yếu bị biến dạng, méo mó. Hình ảnh tổn thương mô bệnh học là biểu hiện viêm với lắng đọng phức hợp miễn dịch trên hiển vi miễn dịch huỳnh quang và lắng đọng đặc điện tử hình gò trên hiển vi điện tử.
4.2. Chẩn đoán phân biệt
- Bệnh thận IgA: triệu chứng xuất hiện sau đợt viêm họng sớm hơn (thường dưới 5 ngày), tiền sử có nhiều đợt đái máu đại thể, C3 máu bình thường, IgA máu có thể tăng, sinh thiết thận có lắng đọng IgA đặc trưng ở gian mạch cầu thận, có thể phát triển ra làm tổn thương màng đáy cầu thận vùng gần gian mạch.
- Hội chứng Alport: hồng cầu niệu kèm yếu tố gia đình, điếc. C3 máu bình thường.
- Đái máu mang tính gia đình lành tính: đái máu đơn độc kèm theo tiền sử gia đình, hình ảnh màng đáy mỏng trên hiển vi điện tử.
- Đái máu do các nguyên nhân khác: u, sỏi, chấn thương, thuốc…
5.1. Nguyên tắc điều trị
Chủ yếu là điều trị triệu chứng. Điều trị nhiễm trùng nếu còn ổ nhiễm trùng. Dự phòng biến chứng. Cần phối hợp thuốc và các biện pháp không thuốc.
5.2. Điều trị cụ thể
5.2.1. Chế độ ăn uống và sinh hoạt
Nghỉ ngơi tại giường ở giai đoạn cấp, đặc biệt khi có THA, đái máu đại thể nhiều, trong 2 - 3 tuần. Khi có phù, thiểu niệu, vô niệu cần ăn giảm muối, hạn chế nước; khi có suy thận cần ăn hạn chế protein.
5.2.2. Điều trị triệu chứng
- Giảm phù bằng ăn hạn chế muối và nước, có thể thêm Furosemid uống 2 - 5mg/kg/ngày hoặc tiêm tĩnh mạch khi thừa dịch gây THA.
- Điều trị THA bằng thuốc chẹn kênh canxi uống hoặc truyền tĩnh mạch.
- Điều trị tăng kali máu bằng chế độ ăn hạn chế rau, hoa quả và các thức ăn giàu kali, phối hợp lợi tiểu furosemide tiêm tĩnh mạch 2 - 5mg/kg/lần và/hoặc các thuốc trao đổi ion K+ với Na+ và Ca++ đường uống. Nếu điều trị nội khoa không hiệu quả hoặc có biến đổi điện tim cần lọc máu.
- Nếu còn dấu hiệu nhiễm trùng cần dùng kháng sinh phù hợp.
Trẻ em thường có tiên lượng tốt, thường hồi phục hoàn toàn trong vòng 6 đến 8 tuần. Khoảng 50% BN trưởng thành tiếp tục bị suy giảm chức năng thận, THA hoặc có protein niệu kéo dài. Một số trường hợp có rung thất do tăng K+ máu, suy tim sung huyết, phù phổi cấp và hôn mê do tăng urê máu là những biến chứng có thể đe dọa tính mạng trong giai đoạn cấp. Các biến chứng muộn bao gồm BTM và HCTH.
7.1. Quản lý bệnh (tái khám)
Cần có sự hợp tác chặt chẽ giữa các bác sĩ nội khoa, CK thận, CK truyền nhiễm...để chăm sóc BN tối ưu khi quản lý BN bị VCT thứ phát sau nhiễm trùng. Kiểm soát lượng muối ăn và nước uống, theo dõi lượng nước tiểu, cân nặng, HA, tình trạng phù khi chưa hồi phục hoàn toàn. Theo dõi và quản lý BN dài hạn theo quy trình quản lý BTM.
7.2. Phòng bệnh
Cần tránh chỗ đông người, giữ vệ sinh cá nhân để giảm nguy cơ nhiễm trùng. Khi bị nhiễm trùng cần đi khám ngay và điều trị bằng kháng sinh phù hợp.
VIÊM CẦU THẬN DO VIÊM MẠCH LIÊN QUAN ĐẾN ANCA
Viêm mạch liên quan đến ANCA (kháng thể kháng bào tương bạch cầu) là viêm mạch hoại tử, có ít hoặc không có lắng đọng miễn dịch, chủ yếu ảnh hưởng đến các mạch nhỏ (mao mạch, tiểu tĩnh mạch, tiểu động mạch và động mạch nhỏ) (theo đồng thuận CHCC 2012) trong đó có mạch thận gây VCT. Viêm mạch ANCA (AAV) có xét nghiệm huyết thanh học myeloperoxidase (MPO) hoặc proteinase 3 (PR3)-ANCA dương tính. Tổn thương thận trong AAV điển hình là VCT hình liềm hoại tử ở 1 số cầu thận và xâm nhập tế bào viêm ở ống kẽ thận. Trên hiển vi miễn dịch huỳnh quang thấy rất ít hoặc hầu như không thấy lắng đọng globulin miễn dịch hay bổ thể, nên còn được gọi là VCT “nghèo miễn dịch”.
Dựa vào đặc điểm lâm sàng, xét nghiệm và bệnh học, các biến thể của viêm mạch máu nhỏ nghèo miễn dịch được phân loại thành:
- Viêm đa mạch vi mạch (microscopic polyangiitis, MPA) là bệnh viêm mạch máu nhỏ nghèo miễn dịch khi không có bằng chứng viêm u hạt hoại tử.
- Bệnh u hạt kèm viêm đa mạch (bệnh Wegener) (Granulomatosis with polyangiitis, GPA) là bệnh viêm mạch máu nghèo miễn dịch kết hợp viêm u hạt hoại tử, thường ảnh hưởng nhất đến đường hô hấp.
- Bệnh u hạt tăng bạch cầu ái toan kèm viêm đa mạch (hội chứng Churg-Strauss hoặc Eosinophilic Granulomatosis with Polyangiitis, eGPA) là bệnh viêm mạch nghèo miễn dịch kết hợp với bệnh hen suyễn, tăng bạch cầu ái toan và viêm u hạt hoại tử.
- Viêm mạch chỉ giới hạn ở thận (renal limited vasculitis, RLV) kèm VCT hoại tử nghèo miễn dịch đơn thuần không có bằng chứng của viêm mạch hệ thống
Nhiễm trùng, virus, độc chất, hay bệnh ác tính là các yếu tố khởi phát.
Triệu chứng toàn thân không đặc hiệu của bệnh viêm hệ thống như sốt, khó chịu, chán ăn, sụt cân, thường có đau cơ và đau khớp. Nhiều BN có khởi phát giống cúm.
Biểu hiện của VCT tiến triển nhanh với protein niệu, đái máu và suy thận thường gặp ở GPA và MPA, không phổ biến ở eGPA.
Có thể kèm theo tổn thương ngoài thận như ở đường hô hấp, da, mắt, hệ thần kinh.
- ANCA huyết thanh (MPO/PR3) có độ nhạy 80-90%, độ đặc hiệu và giá trị tiên lượng 50-75% đối với AAV tùy thuộc vào số lượng BN và chất lượng xét nghiệm. Hiệu giá ANCA tương quan mức độ hoạt động của bệnh, tăng lên trước hoặc khi bệnh tái phát.
- ANCA có thể dương tính ở các bệnh lý viêm khác ngoài viêm mạch, như viêm ruột (IBD), thấp khớp, viêm gan mạn, viêm nội tâm mạc do vi khuẩn và xơ nang.
- Viêm cầu thận do Anti GBM: 5% BN dương tính kép với ANCA
- Phân tích nước tiểu có HC niệu biến dạng, trụ hồng cầu, protein niệu
- Các xét nghiệm khác: dấu ấn virus viêm gan B, C,...
- Sinh thiết thận: là tiêu chuẩn vàng để chẩn đoán AAV ban đầu và tái phát, đặc hiệu tới 91,5% trong GPA. Mô bệnh học giúp tiên lượng bệnh dựa vào tổn thương cầu thận, ống kẽ thận và mạch máu. Có 4 loại tổn thương VCT liên quan đến ANCA theo mức độ và tuổi của tổn thương cầu thận: hoại tử khu trú, tổn thương hình liềm, hỗn hợp, và xơ cứng. Tại cầu thận, tổn thương được phân loại theo phạm vi tổn thương: dạng ổ (≥50% số cầu thận còn bình thường); dạng hình liềm (≥50% cầu thận có liềm tế bào), dạng xơ hóa (≥50% cầu thận bị xơ hóa toàn bộ), và dạng hỗn hợp (không thỏa mãn các tiêu chuẩn nêu trên).
Chẩn đoán xác định dựa vào biểu hiện VCT tiến triển nhanh với đái máu, protein niệu và suy thận tiến triển. Xét nghiệm máu có MPO và/hoặc PR3-ANCA (+). Một tỷ lệ nhỏ BN đồng thời có kháng thể anti GBM (+).
Bệnh nhân được sinh thiết thận có tổn thương viêm hoại tử, xơ hóa, liềm tăng sinh và nghèo miễn dịch trên hiển vi miễn dịch huỳnh quang.
ìm các 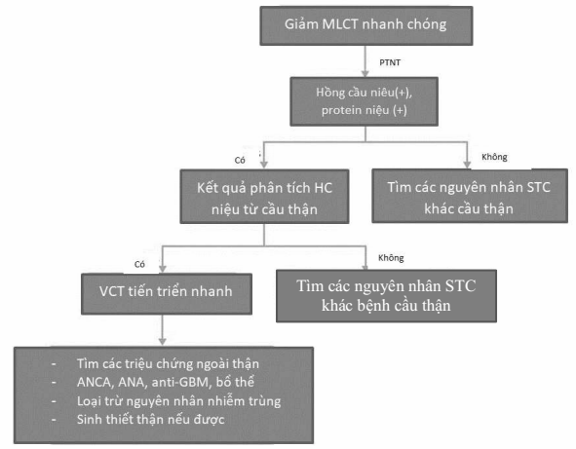
Hình 13. Sơ đồ tiếp cận chẩn đoán viêm cầu thận liên quan ANCA
Dựa vào mức độ hoạt động và đáp ứng với điều trị AAV được phân loại thành:
- Bệnh hoạt động: có biểu hiện lâm sàng viêm mạch ở bất cứ cơ quan nào
- Lui bệnh: không còn triệu chứng viêm mạch hay VCT nữa. VCT lui bệnh khi MLCT ổn định và cải thiện. Đái máu vi thể có thể còn tồn tại dài hơn.
- Tái phát: xuất hiện đợt bệnh hoạt động mới sau một thời gian lui bệnh, protein niệu và hồng cầu niệu xuất hiện lại hoặc tăng lên. Đợt tái phát là nặng khi có tổn thương đa cơ quan đe dọa tính mạng.
- Kháng trị: VCT do viêm mạch tồn tại dai dẳng dù đã điều trị đủ liệu trình ƯCMD.
Viêm mạch máu nhỏ liên quan đến ANCA phải được phân biệt với các dạng viêm mạch máu nhỏ khác có dấu hiệu và triệu chứng tương tự. Bệnh nhân cần được chẩn đoán phân biệt MPA, GPA và eGPA và phân loại theo MPO-ANCA, PR3-ANCA hoặc ANCA âm tính, vì điều này có giá trị tiên đoán độc lập về diễn biến và kết quả lâm sàng.
Bảng 51. Phân biệt một số bệnh liên quan viêm mạch máu nhỏ
| Đặc điểm | HSP | Bệnh Cryoglobulin | MPA | GPA | H/C Churg- Strauss |
| Triệu chứng viêm mạch nhỏ | + | + | + | + | + |
| IgAN | + | - | - | - | - |
| Cryoglobulin huyết thanh | - | + | - | - | - |
| ANCA huyết thanh | - | - | + | + | + |
| Hoại tử dạng hạt | - | - | - | + | + |
| Hen/ bệnh BC ưa eosin | - | - | - | - | + |
3.1. Nguyên tắc chung
Cần bắt đầu điều trị ngay khi có biểu hiện lâm sàng phù hợp mà không cần chờ bằng chứng mô bệnh học của VCT do AAV. Cần chuyển BN đến điều trị tại các trung tâm có kinh nghiệm quản lý AAV. Điều trị bao gồm điều trị khởi đầu tấn công và điều trị duy trì.
3.2. Mục tiêu điều trị:
Ức chế phản ứng miễn dịch do ANCA gây ra tại cầu thận, cải thiện tiên lượng sống cho thận.
3.3. Điều trị cụ thể
3.3.1. Điều trị khởi đầu
- Khuyến cáo sử dụng glucocorticoid phối hợp với rituximab (RTX) hoặc cyclophosphamide (CYC) cho điều trị khởi đầu AAV mới phát hiện (1B). Khi phối hợp với RTX, có thể dùng glucocorticoid liều thấp và với thời gian ngắn hơn.
- Bệnh nhân đã có MLCT giảm rõ hoặc đang giảm nhanh (creatinine máu > 354µmol/L hoặc >4mg/dL) có thể cân nhắc chọn phác đồ phối hợp CYC và Glucocorticoid hoặc RTX và CYC. Bằng chứng ủng hộ phác đồ RTX kết hợp glucocorticoid cho những BN này còn hạn chế.
- Ưu tiên phác đồ có RTX cho những trường hợp BN trẻ tuổi, còn nguyện vọng sinh sản, BN cao tuổi ốm yếu, BN cần tránh dùng glucocorticoid, bệnh tái phát, hoặc có PR3-ANCA dương tính.
- CYC truyền tĩnh mạch hoặc đường uống có hiệu quả tương tự nhưng đường tĩnh mạch có tổng liều tích lũy thấp hơn và ít gây giảm bạch cầu hơn, tuy nhiên BN dùng đường tĩnh mạch hay gặp tái phát hơn khi theo dõi dài hạn so với đường uống.
- Cân nhắc ngừng điều trị ức chế miễn dịch cho những BN vẫn phải lọc máu từ 3 tháng trở lên và không có biểu hiện tổn thương ngoài thận.
- Những BN không có tổn thương cơ quan gây nguy hiểm tính mạng có thể chọn MMF thay CYC cho phân nhóm có MPO-ANCA. MMF cho tỷ lệ thuyên giảm tương tự như CYC đối với BN có PR3-ANCA và MPO-ANCA, nhưng nguy cơ tái phát tăng cao ở những người có PR3-ANCA.
- Cân nhắc thay huyết tương cho những BN có Creatinine máu > 300µmol/L (> 3,4mg/dL); BN cần lọc máu hoặc có creatinine máu tăng nhanh, BN có xuất huyết phế nang lan tỏa kèm giảm oxy máu, và BN có sự chồng lấp giữa hội chứng AAV và kháng thể anti-GBM.
- Thuốc ức chế thụ thể C5a có thể có thể thay thế glucocorticoid trong phác đồ phối hợp để điều trị khởi đầu (khi có thể tiếp cận thuốc), đặc biệt cho những BN có nguy cơ gặp nhiều tác dụng phụ của glucocorticoid. BN có MLCT thấp cũng có thể phục hồi chức năng thận tốt hơn.
Bảng 52. Một số phác đồ ức chế miễn dịch tấn công trong VCT liên quan ANCA
| CYC uống | CYC TM | Rituximab | Rituxumab + CYC TM | MMF |
| 2mg/kg/ngày x 3-6 tháng | 15mg/kg tuần 0,2,4,7,10,13 (cân nhắc thêm tuần 16,19,21,24) | 375mg/m2/ tuần x 4 tuần, hoặc 1g tuần 0,2 | 1. RTX 375mg/m2/tuần x 4 tuần + CYC 15mg/kg TM tuần 0,2 hoặc 2. RTX 1g/tuần 0,2 + CYC 500mg/2 tuần x 6 đợt | 2000-3000m g/ ngày, chia 2 lần |
| Giảm theo tuổi và MLCT 60 tuổi: 1,5mg/kg/ngày 70 tuổi: 1mg/kg/ngày giảm còn 0,5 mg/kg/ngày khi MLCT<30 ml/ph | 60 tuổi: 12,5mg/kg 70 tuổi: 10mg/kg MLCT<30ml/ph: 2,5mg/kg |
|
|
|
3.3.2. Điều trị duy trì
- Điều trị duy trì bằng RTX hoặc azathioprine (AZA) phối hợp glucocorticoids liều thấp sau khi đạt thuyên giảm (1C).
- Sau CYC nên sử dụng AZA kèm glucocorticoid liều thấp hoặc RTX không kèm glucocorticoid để ngăn ngừa tái phát.
- Sau RTX, nên điều trị duy trì cho hầu hết BN. Nếu chọn duy trì bằng AZA phối hợp glucocorticoids liều thấp, khuyến cáo thời gian khoảng từ 18 tháng đến 4 năm sau khi đạt thuyên giảm. Thời gian điều trị duy trì bằng RTX chưa rõ, nhưng khuyến cáo nên kéo dài khoảng 18 tháng sau khi đạt thuyên giảm và không cần phối hợp thường quy thêm với glucocorticoid hoặc thuốc ƯCMD đường uống.
- Cân nhắc lựa chọn RTX hay AZA duy trì dựa trên nguy cơ tái phát, các bệnh đồng mắc, và khả năng tiếp cận thuốc.
- Cân nhắc nguy cơ tái phát khi ngừng điều trị duy trì và cần tư vấn cho BN để phát hiện ngay các dấu hiệu bệnh tái phát.
- Có thể dùng MMF hay Methotrexate duy trì nếu BN không dung nạp AZA, nhưng không chỉ định Methotrexate cho BN có MLCT <60ml/phút/1,73m2.
- Một số yếu tố nguy cơ gây tái phát AAV:
+ U hạt có viêm đa mạch (GPA)
+ PR3-ANCA dương tính
+ Creatinine huyết thanh cao
+ Bệnh tổn thương lan tỏa
+ Có tổn thương ở tai, mũi, họng
+ Có tiền sử từng tái phát
+ Xét nghiệm ANCA vẫn dương tính sau khi điều trị khởi đầu
+ Hiệu giá ANCA tăng trong máu
+ Liều tích lũy CYC thấp
+ Ngừng thuốc ức chế miễn dịch hoặc ngừng glucocorticoid
Bảng 53. Một số phác đồ ức chế miễn dịch duy trì trong VCT liên quan ANCA
| Rituximab | Azathioprine | MMF |
| 1) 500mg x 2 khi đạt thuyên giảm hoàn toàn, 500mg vào tháng thứ 6, 12 và 18; hoặc 2) 1000mg sau khi đạt thuyên giảm, tiếp đó vào tháng thứ 4, 8, 12 và 16 sau lần truyền đầu tiên | 1,5-2mg/kg/ngày khi đạt thuyên giảm hoàn toàn cho đến 1 năm sau chẩn đoán, sau đó giảm liều 25mg mỗi 3 tháng | 2000mg/ ngày (chia liều) khi đạt thuyên giảm hoàn toàn và kéo dài 2 năm |
|
| Khi đạt thuyên giảm hoàn toàn kéo dài thời gian dùng AZA đủ 4 năm tính từ thời điểm bệnh được chẩn đoán: bắt đầu từ 1,5-2mg/kg/ngày trong 18-24 tháng, giảm xuống 1mg/kg/ngày đến đủ 4 năm, sau đó giảm dần 25mg mỗi 3 tháng. Duy trì prednisolon 5-7,5mg/ngày trong 2 năm, sau đó giảm dần 1mg mỗi 2 tháng. |
|
3.3.3. Bệnh tái phát
Cần điều trị tấn công lại khi bệnh tái phát có tổn thương cơ quan hoặc đe dọa tính mạng. Ưu tiên dùng RTX khởi đầu.
3.3.4. Các tình huống đặc biệt
- Bệnh kháng trị: cần tăng liều glucocorticoids (truyền TM hoặc uống), hoặc thêm RTX khi đã khởi đầu bằng CYC hoặc đã dùng CYC trước đó (và ngược lại: thêm CYC nếu đã khởi đầu hoặc đã dùng RTX trước đó). Cân nhắc lọc huyết tương phối hợp, đặc biệt cho BN có xuất huyết phế nang phổi kèm giảm oxy máu.
- Có thể tiến hành ghép thận khi BN đã đạt thuyên giảm hoàn toàn trên lâm sàng từ 6 tháng trở lên. Không quyết định dựa vào có ANCA hay không. AAV có thể tái phát sau ghép thận.
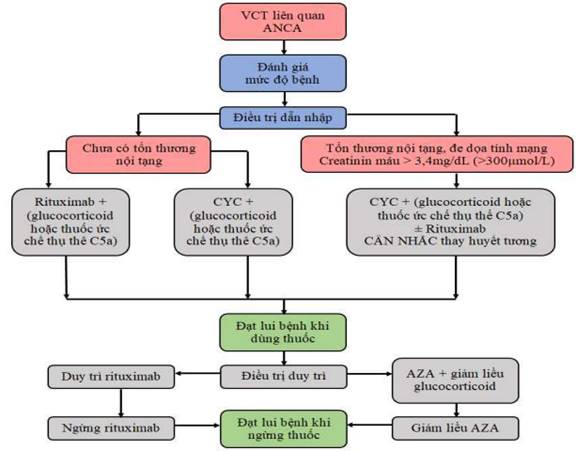
Hình 14. Sơ đồ điều trị viêm cầu thận liên quan ANCA
Tuổi, chức năng thận và/hoặc mức độ tổn thương thận tại thời điểm chẩn đoán là các yếu tố tiên lượng sống còn quan trọng. Điều trị ƯCMD là mấu chốt để cải thiện sự sống còn của BN bị AAV toàn thân hoạt động. Khoảng 10-20% BN chuyển thành BTM/suy thận mặc dù được điều trị tích cực. Tổn thương thận khu trú cho tiên lượng tốt hơn, tổn thương xơ cứng trên 50% hoặc tổn thương hình liềm cho tiên lượng xấu.
Sử dụng sulfamethoxazole/trimethoprim (TMP-SMX) liều thấp hoặc thuốc thay thế để dự phòng viêm phổi do pneumocystis trong thời gian điều trị bằng CYC hoặc trong 6 tháng sau khi dùng RTX. Dự phòng dài hơn nếu truyền RTX lặp đi lặp lại, khi có bệnh phổi cấu trúc hoặc khi phải dùng thuốc ƯCMD hoặc glucocorticoid liên tục.
VIÊM CẦU THẬN DO KHÁNG THỂ KHÁNG MÀNG ĐÁY
Viêm cầu thận do kháng thể kháng màng đáy (anti-glomerular basement membrane, anti- GBM) là một bệnh cầu thận hiếm gặp với tỷ lệ mắc 0,5-1/1000.000 dân. Bệnh do các tự kháng thể chống lại miền không collagen trong chuỗi α3 của collagen type IV(α3(IV)NC1). Viêm cầu thận do kháng thể anti-GBM thường là VCT tiến triển nhanh có tăng sinh hình liềm (gặp ở khoảng 80% BN), biểu hiện dưới dạng bệnh thận đơn độc hoặc hội chứng phổi-thận (hội chứng Goodpasture). Nếu không được điều trị bệnh có tỷ lệ tử vong rất cao và gần như tất cả BN sẽ bị suy thận. Chiến lược điều trị nền tảng là nhanh chóng loại bỏ và ức chế sản xuất kháng thể bệnh lý để ngăn ngừa tổn thương thận và phổi.
Có sự tham gia của yếu tố môi trường và di truyền. Có mối liên hệ chặt chẽ giữa hội chứng Goodpasture và kháng nguyên HLA lớp II, bao gồm DRB1*1501, DRB1*03 và DRB1*04. Các tự kháng thể kháng α3(IV)NC1 là trung tâm trong cơ chế bệnh sinh và chủ yếu là immunoglobulin G1 (IgG1). Ngoài ra còn có vai trò của bổ thể, BC đa nhân trung tính và đại thực bào trong tổn thương thận qua trung gian kháng thể.
Yếu tố nguy cơ: thuốc lá, nhiễm trùng hô hấp, quá tải dịch, phơi nhiễm hydrocarbon trên nền BN đã có kháng thể.
Cần chẩn đoán bệnh do kháng thể anti-GBM sớm nhất có thể trong quần thể BN bị VCT tiến triển nhanh. Cần xét nghiệm máu khẩn cấp để tìm kháng thể anti-GBM. Nếu BN có kết quả kháng thể anti-GBM âm tính (khoảng 10% các trường hợp), cần xác định chẩn đoán bằng sinh thiết thận (lắng đọng IgG tuyến tính dọc màng đáy).
3.1. Lâm sàng
Các triệu chứng thường gặp bao gồm ho, ho ra máu, khó thở, đau ngực, suy hô hấp, đái máu, VCT tiến triển nhanh với chức năng thận giảm nhanh.
Khoảng 50% đến 75% BN có các triệu chứng cấp tính của xuất huyết phổi và giảm dần chức năng thận. BN có thể có triệu chứng trong vài tuần hoặc vài tháng trước đó, nhưng có thể tiến triển nhanh (trong vài ngày) hoặc tiến triển chậm hơn nhiều (trong nhiều tháng).
Xuất huyết phổi có thể xảy ra đồng thời với bệnh thận hoặc đơn độc. Một số BN có xuất huyết phổi nặng đe dọa tính mạng. Khi bắt đầu có giảm chức năng thận có thể tiến triển nhanh đến suy thận.
3.2. Cận lâm sàng
- Xét nghiệm máu tìm kháng thể anti-GBM, ANCA
- Xét nghiệm công thức máu: thiếu máu nếu có xuất huyết phổi nặng, tăng bạch cầu.
- Sinh hóa máu: tăng urê, creatinine do rối loạn chức năng thận
- Xét nghiệm nước tiểu: có hồng cầu niệu (ngay cả trong bệnh phổi đơn độc) biến dạng, có protein niệu vừa phải, có trụ hồng cầu.
- Xquang phổi: hình ảnh kính mờ lan tỏa từ rốn phổi, cả 2 bên, thường ở 2 đáy phổi ; đỉnh phổi và góc sườn hoành ít thấy.
- MSCT độ phân giải cao: giúp chẩn đoán xuất huyết phế nang.
- Nội soi phế quản và đo chức năng hô hấp: có thể hữu ích nhưng thường không cần thiết và khó thực hiện ở những BN nặng và không ổn định.
- Siêu âm thận: kích thước thận thường bình thường hoặc có thể tăng nhẹ.
- Sinh thiết thận: có giá trị chẩn đoán và tiên lượng. Hình ảnh trên hiển vi quang học là VCT tăng sinh hình liềm lan tỏa với các mức độ hoại tử khác nhau. Ở giai đoạn còn sớm, các liềm tăng sinh là liềm tế bào dường như có cùng độ tuổi. Muộn hơn, liềm tăng sinh bị xơ hóa dẫn đến xơ cầu thận, teo ống thận và xơ mô kẽ. Hiển vi miễn dịch huỳnh quang đặc hiệu và có giá trị chẩn đoán hơn, với hình ảnh lắng đọng IgG (chủ yếu là IgG1) và C3 dạng tuyến tính dọc màng đáy. Tỷ lệ cầu thận có liềm tăng sinh trên tiêu bản sinh thiết có liên quan đến tiên lượng sự sống còn của thận. Tuy là tiêu chuẩn vàng để chẩn đoán, sinh thiết thận không phải là bắt buộc để quyết định bắt đầu hay tiếp tục điều trị.
3.3. Chẩn đoán xác định
Chẩn đoán xác định dựa vào sự có mặt của kháng thể anti-GBM lưu hành trong máu, có thể kèm ANCA, ANA trong bệnh cảnh VCT tiến triển nhanh, kèm hoặc không kèm xuất huyết phế nang. Xét nghiệm nước tiểu cho thấy protein niệu mức thấp, có đái máu đại thể hoặc vi thể và trụ hồng cầu.
3.4. Chẩn đoán phân biệt
- Viêm cầu thận do ANCA: kháng thể anti-GBM đôi khi được phát hiện ở những BN có ANCA, đặc biệt là MPO-ANCA. Những BN “dương tính kép” như vậy có thể có diễn biến lâm sàng điển hình của viêm mạch hơn là của hội chứng Goodpasture và đáp ứng với phác đồ điều trị viêm mạch hơn là với phác đồ điều trị hội chứng Goodpasture. Kháng thể anti-GBM có thể là thứ phát sau tổn thương VCT do viêm mạch, hiệu giá kháng thể anti-GBM của những BN này thấp hơn so với BN chỉ có kháng thể anti-GBM. Tiên lượng về thận tốt hơn nếu có ANCA.
- Viêm cầu thận màng: đôi khi kháng thể anti-GBM hiện diện ở BN có VCT màng, thường kèm theo giảm nhanh chức năng thận và hình thành các liềm tăng sinh.
- Hội chứng phổi-thận: nhiều tình trạng bệnh lý có thể gây ra bệnh phổi và thận đồng thời. Thuật ngữ hội chứng phổi-thận nghĩa là suy cả hai cơ quan, nguyên nhân phổ biến nhất là quá tải dịch ở BN suy thận do bất kỳ nguyên nhân nào.
4.1. Nguyên tắc chung
Cần bắt đầu điều trị càng sớm càng tốt, dựa trên nguyên tắc loại bỏ nhanh kháng thể bệnh lý lưu hành và ngăn chặn sản xuất tự kháng thể mới.
4.2. Điều trị cụ thể
- Cần khởi đầu ƯCMD bằng CYC phối hợp glucocorticoid và thay huyết tương cho tất cả BN bị VCT do kháng thể anti-GBM, ngoại trừ những người phải lọc máu ngay, hoặc tiêu bản sinh thiết có 100% cầu thận bị liềm tăng sinh hoặc >50% cầu thận bị xơ hóa toàn bộ, hoặc không có xuất huyết phế nang. Khi chưa có kết quả xét nghiệm và sinh thiết thận để khẳng định chẩn đoán, có thể bắt đầu điều trị bằng glucocorticoids và thay huyết tương trong thời gian chờ đợi chẩn đoán được khẳng định.
- Cần thay huyết tương cho đến khi không còn phát hiện được kháng thể anti-GBM (thông thường khoảng 2-3 tuần). Bệnh nhân có xuất huyết phế nang hoặc ngay sau thủ thuật xâm lấn cần thay huyết tương với huyết tương tươi đông lạnh hoặc truyền 300-400ml huyết tương tươi đông lạnh vào cuối buổi thay huyết tương.
- Cần dùng CYC trong 2-3 tháng và glucocorticoid trong khoảng 6 tháng:
+ Prednisolon uống liều 1 mg/kg/ngày rồi giảm dần hàng tuần để đạt 1/6 liều này sau 8 tuần. Ví dụ liều khởi đầu 60 mg/ngày, giảm liều hàng tuần xuống 45, 30, 25, 20 và 15 mg; 12,5mg/ngày trong 2 tuần và 10mg/ngày đến 3 tháng; giảm dần để ngừng sau 4 tháng
+ Cyclophosphamide uống liều 2-3 mg/kg/ngày. Bệnh nhân trên 55 tuổi dùng liều 2 mg/kg. Ngừng sau 3 tháng. Giảm liều hoặc ngừng nếu có giảm bạch cầu máu
- Bệnh nhân có kháng thể anti-GBM dai dẳng sau 3 tháng dùng CYC cần tiếp tục điều trị bằng AZA hoặc mycophenolate phối hợp glucocorticoids.
- Không cần điều trị duy trì vì hiếm khi bệnh tái phát (chỉ 0%-6% các trường hợp), nhất là khi không còn kháng thể anti-GBM sau 6 tháng. Cần yêu cầu BN bỏ hút thuốc.
- Bệnh nhân VCT dương tính kép với anti-GBM và ANCA cần được điều trị duy trì như với BN bị AAV. Khoảng 5% BN mắc AAV có kháng thể anti-GBM và khoảng 1/3 BN mắc VCT do kháng thể anti-GBM có ANCA. Mặc dù BN có kháng thể dương tính kép bị bệnh thận nặng và thường bị xuất huyết phổi nhưng lại có cơ hội hồi phục chức năng thận cao hơn so với những BN chỉ có kháng thể anti-GBM, tuy nhiên họ lại có tỷ lệ tái phát tương tự như BN mắc AAV. Những BN này cần được điều trị tích cực sớm như đối với bệnh do kháng thể anti-GBM và điều trị duy trì như đối với AAV.
Bảng 54. Phác đồ điều trị VCT do kháng thể kháng màng đáy
| Can thiệp điều trị | Liều lượng | Thời gian |
| Thay huyết tương | 40-50ml/kg hàng ngày với albumin 5% Truyền thêm plasma tươi đông lạnh cuối buổi thay huyết tương cho BN có xuất huyết phế nang và/hoặc sau sinh thiết thận | Cho đến khi không còn phát hiện kháng thể anti-GBM trong máu; thường 14 ngày |
| Cyclophosphamide | - Uống 2-3mg/kg/ngày (BN >55 tuổi 2mg/kg). Giảm liều CYC nếu có giảm bạch cầu - BN không dung nạp hoặc không đáp ứng CYC có thể thử dùng RTX hoặc mycophenolate mofetil | 3 tháng |
| Glucocorticoids | - Truyền TM MethylPrednisolon liều cao, có thể tới 1000mg/ngày trong 3 ngày liên tiếp - Prednisolon 1mg/kg/ngày - Giảm dần tới 20mg/ngày tại tuần 6 | 6 tháng |
- Bệnh nhân có bệnh kháng trị có thể thử dùng RTX
- Bệnh nhân có suy thận cấp nặng cần cân nhắc lọc máu và hấp phụ miễn dịch
- Bệnh nhân suy thận mạn cần trì hoãn ghép thận cho tới khi kháng thể anti-GBM trong máu không còn phát hiện được từ 6 tháng trở lên.
Tử vong phần lớn là do suy hô hấp khi có xuất huyết phế nang. Chỉ khoảng 5% số BN có tỷ lệ cầu thận bị tổn thương hình liềm cao (85-100%), thiểu niệu/vô niệu và/hoặc giảm chức năng thận tiến triển đến suy thận cần lọc máu có thể phục hồi chức năng thận. Điều trị ƯCMD có thể ngăn ngừa tổn thương thận tiếp tục nhưng không thể đảo ngược tổn thương thận mạn tính đã hình thành. Từ vài tuần đến vài tháng với thay huyết tương và điều trị ƯCMD, sự hình thành kháng thể anti-GBM sẽ tự nhiên chấm dứt và bệnh rất hiếm khi tái phát (hầu hết là ở người hút thuốc), vì vậy không cần điều trị ƯCMD duy trì. Tỷ lệ tái phát bệnh sau ghép thận rất thấp nếu kháng thể anti-GBM âm tính kéo dài.
Cần đảm bảo cân bằng dịch, Oxy hỗ trợ, chống đông phù hợp và sử dụng huyết tương tươi đông lạnh hoặc các yếu tố đông máu để phòng ngừa chảy máu khi thay huyết tương.
Bệnh nhân cần được tầm soát nhiễm trùng và điều trị phù hợp. Khi dùng CYC cần dự phòng viêm phổi do pneumocystis bằng TMP-SMX. Những BN bị nhiễm trùng nặng khi điều trị cần dùng kháng sinh và cân nhắc truyền Immunoglobulin tĩnh mạch ngay sau thay huyết tương.
Cần yêu cầu BN bỏ hút thuốc.
BỆNH THẬN ĐA NANG DI TRUYỀN TRỘI NHIỄM SẮC THỂ THƯỜNG Ở NGƯỜI LỚN
Bệnh thận đa nang di truyền trội qua nhiễm sắc thể thường (Autosomal dominant polycystic kidney disease, ADPKD) là một rối loạn đa cơ quan, biểu hiện đặc trưng là có nhiều nang thận hai bên và nang ở một số cơ quan khác như gan, tụy và màng nhện. Nguyên nhân là do đột biến gen và được di truyền theo kiểu trội trên nhiễm sắc thể thường, với biểu hiện khác nhau.
ADPKD xảy ra ở mọi chủng tộc, tỷ lệ mắc khi sinh ước tính là 1/400-1/1000, tỷ lệ các trường hợp được chẩn đoán dao động từ 1/543 đến 1/4000. ADPKD có thể dẫn đến bệnh thận giai đoạn cuối và là nguyên nhân ở khoảng 5-10% các trường hợp suy thận.
Trong 86- 96% trường hợp, ADPKD là do đột biến gen PKD1 trên nhiễm sắc thể 16, là gen mã hóa cho protein polycystin 1; hầu hết các trường hợp còn lại là do đột biến gen PKD2 trên nhiễm sắc thể 4, là gen mã hóa cho protein polycystin 2. Một số trường hợp là do đột biến các gen khác, hoặc do hiệu ứng giữa các gen hoặc các allen.
3.1. Lâm sàng
Cần khai thác kỹ tiền sử gia đình.
Biểu hiện lâm sàng của ADPKD đa dạng tùy thuộc vào gen gây bệnh. Bệnh liên quan đến PKD1 thường nghiêm trọng hơn bệnh liên quan đến PKD2, do xuất hiện sớm hơn. Ngoài thận, có thể có nang ở các cơ quan khác và các bất thường mạch máu.
Kích thước thận tăng dần theo tuổi và tương quan với mức độ giảm MLCT.
Đau hông lưng mạn tính khi thận rất to. Đau hông lưng cấp tính xuất hiện khi có xuất huyết trong nang, nhiễm trùng, sỏi, u.
Đái máu tương đối thường gặp và hay tái phát.
Nhiễm trùng tiết niệu, sỏi thận-tiết niệu hay gặp hơn so với quần thể chung.
Bệnh nhân ít thiếu máu hơn, hoặc thiếu máu có mức độ nhẹ hơn so với các bệnh thận mạn khác cùng giai đoạn.
Tăng huyết áp rất phổ biến, là yếu tố nguy cơ quan trọng gây tiến triển bệnh đến giai đoạn cuối, gây biến chứng và tử vong do tim mạch.
Bệnh nhân có thể có nang ở gan, tụy, lách, buồng trứng; có thể có dị dạng phình mạch não hoặc các mạch máu khác, sa van tim.
3.2. Cận lâm sàng
- Siêu âm thận: chẩn đoán bằng siêu âm dựa vào số lượng nang ở thận và độ tuổi. Ở người trưởng thành có nguy cơ, chẩn đoán xác định khi có ít nhất 3 nang (một bên hoặc hai bên thận) với độ tuổi từ 15 đến 39; 2 nang trong mỗi thận với độ tuổi từ 40 đến 59; từ 4 nang trở lên trong mỗi thận với tuổi ≥ 60 tuổi. Kích thước thận thường tăng.
- Chụp CT- scan hoặc MRI thận: thấy rõ nang kèm các biến chứng nếu có. Có thể đo thể tích mỗi thận.
- Xét nghiệm di truyền có thể cần thiết khi cần chẩn đoán chính xác và kết quả hình ảnh không xác định.
- Xét nghiệm nước tiểu thường không phát hiện bất thường ở giai đoạn sớm; có thể có hồng cầu niệu, ít khi có albumin/protein niệu.
- Xét nghiệm máu không đặc hiệu, ở giai đoạn có giảm chức năng thận hoặc tổn thương các cơ quan ngoài thận có thể thấy rối loạn các chỉ số chức năng thận, gan…
3.3. Chẩn đoán xác định
Chẩn đoán xác định dựa vào tiêu chuẩn hình ảnh điển hình với nhiều nang ở 2 thận, kích thước thận to lên theo tuổi, có thể có nang gan, BTM giai đoạn 3-5 ở người lớn tuổi; có thể dựa vào tiền sử gia đình kèm theo triệu chứng lâm sàng gợi ý. Xét nghiệm gen có thể được cân nhắc cho những trường hợp không điển hình, không có yếu tố gia đình hoặc có nhiều biến thể trong cùng một gia đình.
3.4. Chẩn đoán phân biệt
Nang thận có thể là biểu hiện của nhiều bệnh lý toàn thân khác, trong đó có một số là bệnh di truyền. Khi có biểu hiện ADPKD không điển hình cần phân biệt với PKD di truyền lặn qua nhiễm sắc thể thường, phức hợp xơ cứng củ, bệnh von Hippel-Lindau, u nang thận và bệnh tiểu đường do đột biến HNF1β, hội chứng orofaciodigital loại I, xốp tủy thận và nang thận đơn giản.
4.1. Nguyên tắc chung
Phát hiện sớm, kiểm soát tốt các yếu tố nguy cơ tiến triển BTM và các biến chứng thận (ví dụ THA, nhiễm trùng, sỏi, …) cũng như biến chứng ngoài thận.
4.2. Điều trị cụ thể
- Đau mạn sườn và thắt lưng: cần loại trừ các nguyên nhân gây đau khác ngoài ADPKD (cơ học, cột sống, u) hoặc các biến chứng của ADPKD (nhiễm trùng, sỏi). Ưu tiên chọn các biện pháp không xâm lấn trước. Chỉ cân nhắc giải ép nang khi nguyên nhân gây đau là do các nang quá lớn gây ra và các biện pháp điều trị bảo tồn thất bại. Chọc hút nang dưới hướng dẫn của siêu âm hoặc CT có thể kèm theo tiêm các chất gây xơ như ethanol 95%, dung dịch acid của minocycline hoặc natri tetradecyl sulfat. Khi đã suy thận và không có giải pháp nào giảm đau hiệu quả có thể cân nhắc cắt thận.
- Xuất huyết nang thận: các đợt xuất huyết nang có thể tự giới hạn và BN đáp ứng tốt với điều trị bảo tồn (nghỉ ngơi tại giường, thuốc giảm đau, uống tăng nước). Hiếm khi bị chảy máu trầm trọng gây tụ máu dưới bao thận hoặc sau phúc mạc lan rộng ảnh hưởng huyết động. Có thể cân nhắc dùng Acid tranexamic nhưng cần thận trọng với BN suy thận. Thuốc có thể gây huyết khối và tắc nghẽn niệu quản do cục máu đông. Có thể làm thuyên tắc động mạch cho BN bị xuất huyết nặng bất thường hoặc kéo dài. Nếu không thành công, có thể phải phẫu thuật cắt thận để kiểm soát chảy máu.
- Đái máu: có thể tự hết. Nếu có triệu chứng (đau, sốt) hoặc sau hoạt động mạnh cần điều trị nguyên nhân. BN cần uống tăng nước và tránh chấn thương thận
- Nhiễm trùng nang thận: kháng sinh khó xâm nhập vào biểu mô nang để đạt được nồng độ điều trị trong nang. Các thuốc có thể được lựa chọn là TMP/SMX và fluoroquinolones do cả hai đều có chênh lệch nồng độ điều trị thuận lợi trong nang ở pH sinh lý. Thời gian điều trị đề xuất từ 4-6 tuần.
- Nhiễm trùng tiết niệu: điều trị tương tự như đối với quần thể chung
- Sỏi thận: đánh giá yếu tố nguy cơ gây sỏi thận để có thể can thiệp làm thay đổi; can thiệp tán sỏi ngoài cơ thể hoặc nội soi ngược dòng có thể được ưu tiên hơn tán sỏi qua da, nhưng đều khó thực hiện hơn so với ở quần thể chung, vì vậy cần được thực hiện ở các cơ sở có kinh nghiệm.
- Tăng huyết áp: thuốc hạ áp được ưu tiên lựa chọn là ƯCMC (ACEi) hoặc ƯCTT angiotensin (ARB). Mục tiêu HA tâm thu cần đạt là ≤ 110/75mmHg cho người 18-49 tuổi và <120mmHg cho người ≥ 50 tuổi.
- Làm chậm tiến triển bệnh thận: áp dụng các biện pháp thay đổi lối sống, chế độ ăn, uống nhiều nước và tránh các yếu tố nguy cơ cho mọi BN bị ADPKD. Một số thuốc đặc hiệu khác gồm:
+ Ức chế arginin vasopressin (AVP): Tolvaptan là thuốc đối kháng thụ thể V2 của AVP, làm giảm tốc độ tiến triển ADPKD đến giai đoạn cuối, được chỉ định cho BN từ 18-55 tuổi có MLCT ≥ 25ml/phút/1,73m2 và có nguy cơ tiến triển bệnh nhanh (MLCT giảm ≥ 3ml/phút/1,73m2/năm theo dõi trong ≥ 5 năm) và/hoặc theo phân loại Mayo vào nhóm 1D hoặc 1E; hoặc vào nhóm 1C kèm bằng chứng tiến triển nhanh. Bắt đầu từ liều thấp nhất được khuyến cáo và tăng dần đến liều đạt hiệu quả thải nước và dung nạp được. Thuốc gây khát, đái nhiều, đái đêm, cần bù đủ nước và ngừng ngay khi mất nước. Cần theo dõi chức năng gan để phát hiện tác dụng độc gan. Cân nhắc nguy cơ/lợi ích và giá thành khi điều trị.
+ Đồng vận somatostatin: chỉ dùng cho BN bị ADPKD có triệu chứng nặng do thận quá to gây ra để làm giảm tốc độ tăng kích thước nang, khi không còn có lựa chọn nào tốt hơn. Các thuốc đồng vận somatostatin như octreotide thường dung nạp tốt.
- Suy thận: các BN bị ADPKD có huyết sắc tố cao hơn so với các bệnh lý gây BTM khác cùng giai đoạn. Bệnh nhân suy thận có thể được ghép thận hoặc lọc máu. Đối với lọc máu thường ưu tiện chọn thận nhân tạo hơn lọc màng bụng.
- Ghép thận: ghép thận là lựa chọn ưu tiên cho BN suy thận do ADPKD. Phác đồ ƯCMD chống thải ghép tương tự như với các BN suy thận do các bệnh lý khác. Chỉ cắt thận có nang khi có chỉ định đặc biệt và cần cân nhắc nguy cơ/lợi ích. Khuyến cáo chỉ nên cắt bỏ 1 thận nếu có thể.
Trung bình, MLCT giảm khoảng 5 ml/phút/năm sau 40 tuổi. Các yếu tố tiên lượng tốc độ tiến triển nhanh đến suy thận bao gồm: bệnh được chẩn đoán ở độ tuổi trẻ, giới nam, người mang gen bệnh hồng cầu hình liềm, kiểu gen PKD1, thận to và kích thước tăng nhanh, đái máu đại thể và hay tái phát, THA, chủng tộc da đen, tăng protein niệu, thừa cân/béo phì, ăn mặn.
Đo kích thước thận và thể tích thận (tốt nhất là sử dụng chỉ số thể tích đo bằng MRI hoặc CT scan được hiệu chỉnh theo chiều cao) để tiên lượng nguy cơ tiến triển bệnh đến giai đoạn cuối, thường là trước khi có những thay đổi trên xét nghiệm thường quy. Cũng có thể theo dõi thể tích thận bằng siêu âm, hoặc theo dõi động học MLCT ước tính hoặc theo tuổi để tiên lượng tốc độ giảm chức năng thận.
Cần tầm soát, theo dõi và tư vấn di truyền cho người là F1 của BN bị ADPKD.
Cần tư vấn cho BN kiểm soát cân, kiểm soát các yếu tố nguy cơ (như THA), lối sống lành mạnh, chế độ ăn giàu chất xơ và giảm muối, uống nhiều nước để hạn chế tiến triển bệnh đến giai đoạn cuối.
1. Jeremy Levy. (2009). Hemodialysis Presciption. Jeremy Levy. Third Edition. Oxford handbook of dialysis. Oxford University Press.
2. Bach Nguyen, Fukuuchi. Survival Rates and Causes of death in Vietnamese Chronic Hemodialysis patients. Renal Replacement Therapy (2017): 3: 22, DOI 10, 1186/s41100-17-0099-6.
3. KDOQI clinical practice guideline for hemodialysis adequacy. Update. Am J Kidney Dis. 2015;66(5):884-93
4. Li PK, Chow KM, Cho Y, et al. ISPD peritonitis guideline recommendations: 2022 update on prevention and treatment. Perit Dial Int. 2022;42(2):110-153.
5. Szeto CC, Li PK. Peritoneal dialysis-associated peritonitis. Clin J Am Soc Nephrol. 2019;14(7):1100-1105.
6. Piraino B, Bernardini J, Brown E, et al. ISPD position statement on reducing the risks of peritoneal dialysis-related infections. Perit Dial Int. 2011;31(6):614-630.
7. Bethany Roehm, Gaurav Gulati, Daniel E. Weiner. Heart Failure Management in Dialysis Patients: Many Treatment Options with No Clear Evidence. Semin Dial. 2020 May ; 33(3): 198-208. doi:10.1111/sdi.12878.
8. Bộ Y tế. Thải ghép thận cấp. Hướng dẫn chẩn đoán và điều trị một số bệnh về thận tiết niệu 2015: 194-202.
9. Hội ghép tạng Việt nam. Hướng dẫn ghép thận Việt nam. Nhà xuất bản Y học 2017.
10. Donavitch GM. Handbook of Kidney Transplantation, 5th Edition, 2010.
11. KDIGO. Clinical practice guideline for the care of kidney transplant recipients, 2009.
12. McCullough PA, Philbin EF, Spertus JA, et al. Confirmation of a heart failure epidemic: findings from the Resource Utilization Among Congestive Heart Failure (REACH) study. J Am Coll Cardiol. 2002;39:60- 69.
13. Hill NR, Fatoba ST, Oke JL, et al. Global prevalence of chronic kidney disease-a systematic review and meta-analysis. PLoS One. 2016;11: e0158765.
14. McCullough PA, Bakris GL, Owen WF Jr, et al. Slowing the progression of diabetic nephropathy and its cardiovascular consequences. Am Heart J. 2004;148:243-251.
15. Haase M, Muller C, Damman K, et al. Pathogenesis of cardiorenal syndrome type 1 in acute decompensated heart failure: workgroup statements from the eleventh consensus conference of the Acute Dialysis Quality Initiative (ADQI). Contrib Nephrol. 2013;182:99-11
16. Skrabic R, Kumric M, Vrdoljak J, et al. SGLT2 Inhibitors in Chronic Kidney Disease: From Mechanisms to Clinical Practice. Biomedicines. 2022;10(10):2458. Published 2022 Oct 1. doi:10.3390/biomedicines10102458
17. Chronic Kidney Disease Prognosis Consortium, Matsushita K, van der Velde M, et al. Association of estimated glomerular filtration rate and albuminuria with all-cause and cardiovascular mortality in general population cohorts: a collaborative meta-analysis. Lancet 2010;375:2073-81.
18. Go AS, Chertow GM, Fan D, McCulloch CE, Hsu CY. Chronic kidney disease and the risks of death, cardiovascular events, and hospitalization. N Engl J Med 2004;351:1296-305.
19. Manjunath G, Tighiouart H, Ibrahim H, et al. Level of kidney function as a risk factor for atherosclerotic cardiovascular outcomes in the community. J Am Coll Cardiol 2003;41:47-55.
20. Sosnov J, Lessard D, Goldberg RJ, Yarzebski J, Gore JM. Differential symptoms of acute myocardial infarction in patients with kidney disease: a community-wide perspective. Am J Kidney Dis 2006;47:378-84.
21. Herzog CA, Littrell K, Arko C, Frederick PD, Blaney M. Clinical characteristics of dialysis patients with acute myocardial infarction in the United States: a collaborative project of the United States Renal Data System and the National Sarnak et al. JACC VOL. 74, NO. 14, 2019 CKD and Coronary Artery Disease: A KDIGO Confe rence Report OCTOBER 8, 2019:1823 - 3 8 1836 Registry of Myocardial Infarction. Circulation 2007;116:1465-72.
22. Acharya, Tushar, Huang, Jian, Tringali, Christopher R et al. Statin Use and the Risk of Kidney Disease With Long-Term Follow-Up (8.4-Year Study); American Journal of Cardiology, 647-655.
23. Diehm C, Schuster A, Allenberg JR, et al. High prevalence of peripheral arterial disease and co-morbidity in 6880 primary care patients: Cross-sectional study. Atherosclerosis 2004;172:95-105
24. Suhail Allaqaband, Fuad Jan, Tanvir Bajwa. Endovascular Treatment of Peripheral Vascular Disease. Curr Probl Cardiol 2009;34:359-476.
25. Hirsch AT, Criqui MH, Treat-Jacobson D, et al. Peripheral arterial disease detection, awareness, and treatment in primary care. JAMA 2001; 286:1317-1324.
26. McLafferty RB, Dunnington GL, Mattos MA, et al. Factors affecting the diagnosis of peripheral vascular disease before vascular surgery referral. J Vasc Surg 2000;31:870-879.
27. Belch J, Topol E, Agnelli G, Bertrand M. Critical issues in peripheral arterial disease detection and management. Arch Intern Med 2003;163:884-92.
28. National Kidney Foundation. KDOQI clinical practice guidelines for chronic kidney disease: evaluation, classification, and stratification. Am J Kidney Dis. 2002;39(2 Suppl1):S1-S266.
29. Kidney Disease: Improving Global Outcomes (KDIGO) CKD Work Group. KDIGO 2012 clinical practice guideline for the evaluation and management of chronic kidney disease. Kidney Int Suppl. 2013;3(1):1-150.
30. American Diabetes Association. Standards of medical care in diabetes--2019. Diabetes Care. 2019;42(Suppl 1):S90-S102.
31. Perazella MA. Drug-induced acute kidney injury: diverse mechanism of tubular injury. Current Opinion in Critical Care. 2019;25(6):550-570.
32. Perazella MA. Drug-induced acute interstitial nephritis. Expert Opin Drug Saf. 2005;4(4):723-731.
33. Lapi F, Azoulay L, Yin H, Nessim SJ, Suissa S. Concurrent use of diureticsangiotensin converting enzyme inhibitors, and angiotensin receptor blockers with NSAID and risk of acute kidney injury: nestled case-control study. BMJ. 2013;346:e8525.
34. Davenport MS, Perazella MA, Yee J, et al. Use of Intravenous Iodinated Contrast Media in Patients with Kidney Disease: Consensus Statements from the American College of Radiology and the National Kidney Foundation. Radiology. 2020;294(3):660-668. doi:10.1148/radiol.2019192094
35. Khwaja A. KDIGO clinical practice guidelines for acute kidney injury. Nephron Clin Pract. 2012;120(4):c179-c184. doi:10.1159/000339789
36. Macdonald DB, Hurrell C, Costa AF, et al. Canadian Association of Radiologists Guidance on Contrast Associated Acute Kidney Injury. Can Assoc Radiol J.2022;73(3):499-514. doi:10.1177/08465371221083970
37. Wintermark M, Sanelli PC, Albers GW, et al. Imaging recommendations for acute stroke and transient ischemic attack patients: A joint statement by the American Society of Neuroradiology, the American College of Radiology, and the Society of NeuroInterventional Surgery. AJNR Am J Neuroradiol 2013; 34:E117.
38. Keberle M, Tschammler A, Hahn D. Single-bolus technique for spiral CT of laryngopharyngeal squamous cell carcinoma: Comparison of different contrast material volumes, flow rates, and start delays. Radiology 2002; 224:171.
39. Yamashita Y, Komohara Y, Takahashi M, et al. Abdominal helical CT: evaluation of optimal doses of intravenous contrast material--a prospective randomized study. Radiology 2000; 216:718
40. Fayad LM, Bluemke DA, Fishman EK. Musculoskeletal imaging with computed tomography and magnetic resonance imaging: when is computed tomography the study of choice? Curr Probl Diagn Radiol 2005; 34:220.
41. Schieda N, Blaichman JI, Costa AF, et al. Gadolinium-Based Contrast Agents in Kidney Disease: A Comprehensive Review and Clinical Practice Guideline Issued by the Canadian Association of Radiologists. Can J Kidney Health Dis.2018;5:2054358118778573. Published 2018 Jun 12. doi:10.1177/2054358118778573
42. Use of Intravenous Gadolinium-based Contrast Media in Patients with Kidney Disease: Consensus Statements from the American College of Radiology and the National Kidney Foundation (2020)
43. Stevens L.A., Nolin T.D., Richardson M.M. và cộng sự. (2009). Comparison of drug dosing recommendations based on measured GFR and kidney function estimating equations. Am J Kidney Dis, 54(1), 33-42.
44. Munar M.Y. và Singh H. (2007). Drug dosing adjustments in patients with chronic kidney disease. Am Fam Physician, 75(10), 1487-1496.
45. Matzke G.R., Aronoff G.R., Atkinson A.J. và cộng sự. (2011). Drug dosing consideration in patients with acute and chronic kidney disease-a clinical update from Kidney Disease: Improving Global Outcomes (KDIGO). Kidney Int, 80(11), 1122-1137.
46. Demirovic J.A., Pai A.B., và Pai M.P. (2009). Estimation of creatinine clearance in morbidly obese patients. Am J Health Syst Pharm, 66(7), 642-648.
47. Winter M.A., Guhr K.N., và Berg G.M. (2012). Impact of various body weights and serum creatinine concentrations on the bias and accuracy of the Cockcroft-Gault equation. Pharmacotherapy, 32(7), 604-612.
48. Salazar D.E. và Corcoran G.B. (1988). Predicting creatinine clearance and renal drug clearance in obese patients from estimated fat-free body mass. Am J Med, 84(6), 1053-1060.
49. Cockcroft D.W. và Gault M.H. (1976). Prediction of creatinine clearance from serum creatinine. Nephron, 16(1), 31-41.
50. Venkatachalam M.A., Griffin K.A., Lan R. và cộng sự. (2010). Acute kidney injury: a springboard for progression in chronic kidney disease. Am J Physiol Renal Physiol, 298(5), F1078-1094.
51. He L., Wei Q., Liu J. và cộng sự. (2017). AKI on CKD: heightened injury, suppressed repair, and the underlying mechanisms. Kidney Int, 92(5), 1071-1083.
52. Doi K., Nishida O., Shigematsu T. và cộng sự. (2018). The Japanese clinical practice guideline for acute kidney injury 2016. Clin Exp Nephrol, 22(5), 985-1045.
53. Hapca S., Siddiqui M.K., Kwan R.S.Y. và cộng sự. (2021). The Relationship between AKI and CKD in Patients with Type 2 Diabetes: An Observational Cohort Study. Journal of the American Society of Nephrology, 32(1), 138.
54. Hsu R.K. và Hsu C. (2016). THE ROLE OF ACUTE KIDNEY INJURY IN CHRONIC KIDNEY DISEASE. Semin Nephrol, 36(4), 283-292.
55. Levey A.S., Atkins R., Coresh J. và cộng sự. (2007). Chronic kidney disease as a global public health problem: approaches and initiatives - a position statement from Kidney Disease Improving Global Outcomes. Kidney Int, 72(3), 247-259.
56. KDIGO 2021 Clinical Practice Guideline for the Management of Glomerular Diseases. Kidney International (2021):100, S96-S98
57. Pugh-Clarke K., Donlon S., và McCann M. (2010). CE: continuing education article. Prevention of infection in patients with chronic kidney disease part 1: application of infection control principles to the renal care environment. J Ren Care, 36(4), 191-198.
58. Stevens P.E., Levin A., và Kidney Disease: Improving Global Outcomes Chronic Kidney Disease Guideline Development Work Group Members (2013). Evaluation and management of chronic kidney disease: synopsis of the kidney disease: improving global outcomes 2012 clinical practice guideline. Ann Intern Med, 158(11), 825-830.
59. Descamps-Latscha B., Jungers P., và Witko-Sarsat V. (2002). Immune system dysregulation in uremia: role of oxidative stress. Blood Purif, 20(5), 481-484.
60. Donlon S., Redmond A., McCann M. và cộng sự. (2011). Prevention of infection in patients with chronic kidney disease part III: surveillance and auditing in a renal care environment. J Ren Care, 37(3), 167-173.
61. Redmond A., Donlon S., Boyle G. và cộng sự. (2011). Prevention of infection in patients with chronic kidney disease. Part II: healthcare-associated infections. J Ren Care, 37(1), 52-62.
62. Ma B.M., Yap D.Y.H., Yip T.P.S. và cộng sự. (2021). Vaccination in patients with chronic kidney disease-Review of current recommendations and recent advances. Nephrology (Carlton), 26(1), 5-11.
63. Hội Tim Mạch học quốc gia Việt nam (2022), Khuyến cáo của phân hội Tăng huyết áp - Hội tim mạch quốc gia Việt Nam (VSH/VNHA) về chẩn đoán & điều trị tăng huyết áp
64. Dan Pugh, Peter J. Gallacher, Neeraj Dhaun, Management of Hypertension in Chronic Kidney Disease, Drugs (2019) 79:365-379
65. Dhaybi OA, Bakris G. Mineralocorticoid antagonists in chronic kidney disease. Curr Opin Nephrol Hypertens. 2017;26:50-55
66. Rajiv Agarwal, Peter Kolkhof, George Bakris. Steroidal and non-steroidal mineralocorticoid receptor antagonists in cardiorenal medicine, European Heart Journal (2021) 42, 152-161
67. Ashraf Mikhail, Christopher Brown, Jennifer Ann Williams et al: Renal Association Clinical Practice Guideline - Anaemia of Chronic Kidney Disease, BMC Nephrol. 2017 Nov 30;18(1):345. doi: 10.1186/s12882-017-0688-1
68. Jose Portoles, Leyre Martin et al: Anemia in Chronic Kidney Disease: From Pathophysiology and Current Treatments, to Future Agents, Front Med. 2021 Mar 26;8:642296. doi: 10.3389/fmed.2021.642296
69. Kerry Willis, PhD et KDIGO Staff: KDIGO Clinical Practice Guideline for Anemia in Chronic Kidney Disease, Kidney International Supplements (2012), vol 2, iss 4
70. Steven Fishbane, Stephen Brunton: Improving Detection and Management of Anemia in CKD, J Fam Pract. 2022 Jul;71(6 Suppl):S23-S28. doi: 10.12788/jfp.0411
71. Jodie l Babitt, Michele L Eisenga, Volker H Haase et al: Controversies in optimal anemia management: conclusions from a Kidney Disease: Improving Global Outcomes (KDIGO) Conference, Kidney Int. 2021 Jun;99(6):1280-1295. doi: 10.1016/j.kint.2021.03.020. Epub 2021 Apr 8.
72. Steven Fishbane, Bruce Spinowitz: Update on Anemia in ESRD and Earlier Stages of CKD: Core Curriculum 2018, Am J kidney Dis. 2018 Mar;71(3):423-435. doi: 10.1053/j.ajkd.2017.09.026. Epub 2018 Jan 11.
73. Hướng dẫn chẩn đoán và điều trị Đái tháo đường type 2- 2020- Bộ Y tế
74. Nuha A Elsayed, Grazia Aleppo, Vanita R Aroda et al: Chronic Kidney Disease and Risk Management: Standards of Care in Diabetes-2023, Diabetes Care 2023;46(Supplement_1): S191-S202
75. KDIGO 2022 Clinical Practice Guideline for Diabetes Management in Chronic Kidney Disease. Kidney Int (2022): 102, pp. S1-S127.
76. William G. Herrington, Andrew H. Frankel et al: UKKA guideline_SGLT2i in adults with kidney disease v1 20.10.21, UKKA 28 September, 2021
77. 2018 AHA/ACC/ AACVPR/ AAPA/ABC/ ACPM/ ADA/ AGS/ APhA/ASPC/NLA/ PCNA Guideline on the Management of Blood Cholesterol
78. Kiểm soát Lipid máu trong phòng ngừa bệnh tim mạch do xơ vữa động mạch 2020 - tim mạch học
79. 2022 ACC Expert Consensus Decision Pathway on the Role of Nonstatin Therapies for LDL-Cholesterol Lowering in the Management of Atherosclerotic Cardiovascular Disease Risk
80. 2022 Taiwan lipid guidelines for primary prevention
81. KDIGO Clinical Practice Guideline for Lipid Management in Chronic Kidney Disease Management of dyslipidaemia in patients with chronic kidney disease: a position paper endorsed by the Italian Society of Nephrology
82. KDIGO 2017. Clinical practice guideline update for the diagnosis, evaluation, prevention, and treatment of chronic kidney disease-mineral and bone disorder (CKD- MBD). Kidney International Supplements. Vol 1. Issue 1.
83. Brenner & Rector’s The Kidney 2016. Elsevier, Tenth Edition.
84. Comprehensive Clinical Nephrology 2019. Elsevier, Sixth Edition.
85. Schrier's Diseases of The Kidney 2019. Ninth Edition.Volume 2
86. KDIGO 2012. Clinical practice guideline for acute kidney injury. Kidney International Supplements. Vol 2. Issue 1.
87. Garthwaite, E., Reddy, V., Douthwaite, S. et al. Clinical practice guideline management of blood-borne viruses within the hemodialysis unit. BMC Nephrol 20, 388 (2019). https://doi.org/10.1186/s12882-019-1529-1
88. John T. Daugirdas and al, “Infectious Disease”, Handbook of Dialysis, 5th Edition (2015), Wolters Kluwer.
89. Kidney Disease: Improving Global Outcomes (KDIGO) (2008). KDIGO clinical practice guidelines for the prevention, diagnosis, evaluation, and treatment of hepatitis C in chronic kidney disease. Kidney international. Supplement, (109), S1-S99. https://doi.org/10.1038/ki.2008.81.
90. Shah, AS, Amarapurkar, DN. Spectrum of hepatitis B and renal involvement. Liver Int. 2018; 38: 23- 32. https://doi.org/10.1111/liv.13498
91. Martin, P., Awan, A. A., Berenguer, M. C., Bruchfeld, A., Fabrizi, F., Goldberg, D. S., Jia, J., Kamar, N., Mohamed, R., Pessôa, M. G., Pol, S., Sise, M. E., Balk, E. M., Gordon, C. E., Adam, G., Cheung, M., Earley, A., & Jadoul, M. (2022). Executive Summary of the KDIGO 2022 Clinical Practice Guideline for the Prevention, Diagnosis, Evaluation, and Treatment of Hepatitis C in Chronic Kidney Disease. Kidney International, 102(6), 1228-1237. https://doi.org/10.1016/j.kint.2022.07.012
92. Chan CT, Blankestijn PJ, Dember LM, et al. Dialysis initiation, modality choice, access, and prescription: conclusions from a Kidney Disease: Improving Global Outcomes (KDIGO) Controversies Conference. Kidney Int. 2019;96(1):37-47. doi:10.1016/j.kint.2019.01.017
93. Ku E, McCulloch CE, Johansen KL. Starting Renal Replacement Therapy: Is It About Time?. Am J Nephrol. 2019;50(2):144-151. doi:10.1159/000501510
94. Yu MK, O'Hare AM, Batten A, et al. Trends in Timing of Dialysis Initiation within Versus Outside the Department of Veterans Affairs. Clin J Am Soc Nephrol. 2015;10(8):1418-1427. doi:10.2215/CJN.12731214
95. Cooper BA, Branley P, Bulfone L, et al. A randomized, controlled trial of early versus late initiation of dialysis. N Engl J Med. 2010;363(7):609-619. doi:10.1056/NEJMoa1000552
96. Levey AS, de Jong PE, Coresh J, El Nahas M, Astor BC, Matsushita K, Gansevoort RT, Kasiske BL, Eckardt KU. The definition, classification, and prognosis of chronic kidney disease: a KDIGO Controversies Conference report. Kidney Int. 2011 Jul;80(1):17-28
97. Levey AS, Coresh J. Chronic kidney disease. Lancet. 2012 Jan 14;379(9811):165-80. doi: 10.1016/S0140-6736(11)60178-5. Epub 2011 Aug 15. PMID: 21840587.
98. García-Maset R, Bover J, Segura de la Morena J, Goicoechea Diezhandino M, Cebollada Del Hoyo J, Escalada San Martin J, Fácila Rubio L, Gamarra Ortiz J, García- Donaire JA, García-Matarín L, Gràcia Garcia S, Isabel Gutiérrez Pérez M, Hernández Moreno J, Mazón Ramos P, Montađés Bermudez R, Muđoz Torres M, de Pablos- Velasco P, Pérez-Maraver M, Suárez Fernández C, Tranche Iparraguirre S, Luis Górriz J. Information and consensus document for the detection and management of chronic kidney disease. Nefrologia (Engl Ed). 2022 May-Jun;42(3):233-264.
99. Kidney Disease: Improving Global Outcomes (KDIGO) Blood Pressure Work Group. KDIGO 2021 Clinical Practice Guideline for the Management of Blood Pressure in Chronic Kidney Disease. Kidney Int. 2021 Mar;99(3S):S1-S87.
100. ACC/AHA/AAPA/ABC/ACPM/AGS/APhA/ASH/ASPC/NMA/PCNA Guideline for the Prevention, Detection, Evaluation, and Management of High Blood Pressure in Adults: Executive Summary: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. Hypertension. 2018 Jun;71(6):1269-1324
101. Martinez YV, Benett I, Lewington AJP, Wierzbicki AS; Guideline Committee. Chronic kidney disease: summary of updated NICE guidance. BMJ. 2021 Sep 6;374:n1992
102. National Kidney Foundation. KDIGO 2012 clinical practice guideline for the evaluation and management of chronic kidney disease. Kidney Int Suppl 2013;3:19-62
103. Smart NA, Titus TT. Outcomes of early versus late nephrology referral in chronic kidney disease: a systematic review. Am J Med. 2011 Nov;124(11):1073-80
104. Liu P, Quinn RR, Oliver MJ, Ronksley PE, Hemmelgarn BR, Quan H, Hiremath S, Bello AK, Blake PG, Garg AX, Johnson J, Verrelli M, Zacharias JM, Abd ElHafeez S, Tonelli M, Ravani P. Association between Duration of Predialysis Care and Mortality after Dialysis Start. Clin J Am Soc Nephrol. 2018 Jun 7;13(6):893-899
105. Isnard Bagnis C, Crepaldi C, Dean J, Goovaerts T, Melander S, Nilsson EL, Prieto- Velasco M, Trujillo C, Zambon R, Mooney A. Quality standards for predialysis education: results from a consensus conference. Nephrol Dial Transplant. 2015 Jul;30(7):1058-66
106. McLaughlin K, Manns B, Culleton B, Donaldson C, Taub K. An economic evaluation of early versus late referral of patients with progressive renal insufficiency. Am J Kidney Dis. 2001 Nov;38(5):1122-8
107. Saggi SJ, Allon M, Bernardini J, Kalantar-Zadeh K, Shaffer R, Mehrotra R; Dialysis Advisory Group of the American Society of Nephrology. Considerations in the optimal preparation of patients for dialysis. Nat Rev Nephrol. 2012 Apr 10;8(7):381-9
108.Vachharajani TJ, Hassanein M, Liaqat A, Haddad N. Vessel Preservation in Chronic Kidney Disease Adv Chronic Kidney Dis. 2020 May;27(3):177-182
109. Davidson S. Supportive care in advanced chronic kidney disease. In Brenner and Rector’s The Kidney, Elsevier, 11th ed, Ch 62, Vol 2, p 2015-2037
110. Varkey B. Principles of Clinical Ethics and Their Application to Practice. Med Princ Pract. 2021;30(1):17-28
111. Schell OJ, Arnold RM, Davison S. Uptodate 2023- Kidney palliative care: Conservative kidney management
112. Sijpkens YW, Berkhout-Byrne NC, Rabelink TJ. Optimal predialysis care. NDT Plus. 2008 Oct;1(Suppl 4):iv7-iv13
113. McCullough PA, Kellum JA, Haase M, et al. Pathophysiology of the cardiorenal syndromes: executive summary from the eleventh consensus conference of the Acute Dialysis Quality Initiative (ADQI). Contrib Nephrol. 2013;182:82-98
114. American Diabetes Association (2022). Chapter 11: Chronic kidney disease and Risk management. In: Standards of Medical Care in Diabetes-2022, Diabetes Care (2022); 45(Suppl.1), S175-S184. https://doi.org/10.2337/dc22-S011
115. De Boer IH, Khunti K, Sadusky T, et al. (2022). Diabetes management in chronic kidney disease: A consensus report by the American Diabetes Association (ADA) and Kidney Disease: Improving Global Outcomes (KDIGO). https://doi.org/10.2337/dci220027.
116. Fornoni A., Nelson R., Najafian B., et al. (2020), “Chapter 39 : Epidemiology of Diabetic kidney disease”, In: Yu A.S.L. et al. (eds), Brenner & Rectors’s THE KIDNEY, 11th edition, pp. 1327-1379, Elsevier.
117. Tong L.L., Adler S., Wanner C. (2019), “Prevention and treatment of Diabetic kidney disease”. In: Feehally J., Floege J., Tonelli M., Johnson R. (eds), Comprehensive clinical nephrology, 6th edition, pp. 376- 384, Elsevier
118. Bajema IM, Wilhelmus S, Alpers CE, et al. “Revision of the International Society of Nephrology /Renal Pathology Society classification for lupus nephritis: clarification of definitions, and modified National Institutes of Health activity and chronicity indices”, Kidney Int 2018, 93, pp. 789 - 796.
119. Fanouriakis A, Kostopoulou M, Cheema K, et al. “2019 Update of the joint European League Against Rheumatism and European Renal Association - European Dialysis and Transplantation Association (EULAR/ERA-EDTA) recommendations for the management of lupus nephritis” Ann Rheum Dis 2020, 79, pp. 713 - 723.
120. Huỳnh Ngọc Phương Thảo. “Đánh giá chỉ số hoạt động, mạn tính NIH trong viêm thận do lupus”. Y học TP Hồ Chí Minh (2018), Phụ bản tập 22, số 2: tr. 277 - 283.
121. Kostopoulou M, Fanouriakis A, Cheema K, et al. “Management of lupus nephritis: a systematic literature review informing the 2019 update of the joint EULAR and European Renal Association - European Dialysis and Transplant Association (EULAR/ERA-EDTA) recommendations”. RMD Open 2020: 6, e001263.
122. Radhakrishnan J, Appel GB, D’Agati V, et al. “Systemic Lupus Erythematosus”. In: Yu A, et al. eds. Brenner & Rector’s THE KIDNEY, Elsevier 2020, pp. 1092 - 1106.
123. Wadhwani S, Jayne D, Rovin BH, et al. “Lupus nephritis”. In: Feehally J et al. eds, Comprehensive clinical nephrology, 6th edition, Elsevier 2019, pp. 306 - 319.
124. Feehally J, Floege J. “Immunoglobulin A Nephropathy and IgA Vasculitis (Henoch Schonlein purpura)”. In: Feehally J et al. eds, Comprehensive clinical nephrology, 6th edition, Elsevier 2019, pp. 270 - 280.
125. Lv J, Zhang H, Wong MG, et al. Effect of oral methylprednisolone on clinical outcomes in patients with IgA nephropathy: the TESTING randomized clinical trial. JAMA 2017; 318: 432 - 442.
126. Lv J, Zhang H, Chen Y, et al. Combination therapy of prednisone and ACE inhibitor versus ACE-inhibitor therapy alone in patients with IgA nephropathy: a randomized controlled trial. Am J Kidney Dis: 2009; 53: 26 - 32.
127. Manno C, Torres DD, Rossini M, et al. Randomized controlled clinical trial of corticosteroids plus ACE-inhibitors with long-term follow-up in proteinuric IgA nephropathy. Nephrol Dial Transplant. 2009; 24: 3694 - 3701.
128. Saha MK, Pendergraft III WF, Jennett JC et al. “Chapter 31: Primary glomerular disease”. In: Yu A, et al. eds. Brenner & Rector’s THE KIDNEY, Elsevier 2020, pp. 1007 - 1091.
129. Lionaki, S., Mantios, E., et al. (2021). Clinical Characteristics and Outcomes of Adults with Nephrotic Syndrome Due to Minimal Change Disease. Journal of clinical medicine, 10(16), 3632. https://doi.org/10.3390/jcm10163632
130. Xue, C., Yang, B., et al. (2020). Efficacy and safety of rituximab in adult frequent- relapsing or steroid-dependent minimal change disease or focal segmental glomerulosclerosis: a systematic review and meta-analysis. Clinical kidney journal, 14(4), 1042-1054. https://doi.org/10.1093/ckj/sfaa191
131. Rosenberg, A. Z., & Kopp, J. B. (2017), Focal Segmental Glomerulosclerosis. Clinical Journal of the American Society of Nephrology: CJASN, 12(3), 502-517.
132. Zand, L., Glassock, R. J., et al (2017), What are we missing in the clinical trials of focal segmental glomerulosclerosis? European Dialysis and Transplant Association - European Renal Association, 32(1), i14-i21.
133. Couser W. G. (2017). Primary Membranous Nephropathy. Clinical Journal of the American Society of Nephrology: CJASN, 12(6), 983-997.
134. Sethi S. (2021). New 'Antigens' in Membranous Nephropathy. Journal of the American Society of Nephrology: JASN, 32(2), 268-278.
135. Kanjanabuch T., Kittikowit W., et al. (2009). An update on acute postinfectious glomerulonephritis worldwide. Nature reviews. Nephrology, 5(5), 259-269.
136. ANCA Glomerulonephritis and Vasculitis, Jennette, J. Charles; Nachman, Patrick H. Clinical Journal of the American Society of Nephrology 12(10):p 1680-1691, October 2017. | DOI: 10.2215/CJN.02500317
137. Efficacy of Rituximab and Plasma Exchange in Antineutrophil Cytoplasmic Antibody-Associated Vasculitis with Severe Kidney Disease, Casal Moura, Marta; Irazabal, Maria V.; Eirin, Alfonso, JASN 31(11):p 2688-2704, November 2020. | DOI: 10.1681/ASN.2019111197
138. William F.Pendergraft, Patrick H.Nachman, J.Charles Jannette, Ronald J.Falk: Pauci- Immune Crescentis Glomerulonephritis Disease, Brenner and Rector’s the Kidney, vol 1, Elsevier(2016), chapter 32, p 1081- 1089.
139. Agnes B. Fogo, Mark A. Lusco, Behzad Najafian, and Charles E. Alpers: AJKD Atlas of Renal Pathology: Pauci-immune Necrotizing Crescentic Glomerulonephritis. Am J Kidney Dis.2016;68(5):e29-e30.
140. Van Daalen, Emma E.; Jennette, J. Charles; McAdoo, Stephen P. Et al: Predicting Outcome in Patients with Anti-GBM Glomerulonephritis, Clinical Journal of the American Society of Nephrology 13(1):p 63-72, January 2018. | DOI: 10.2215/CJN.04290417
141. William F.Pendergraft, Patrick H.Nachman, J.Charles Jannette, Ronald J.Falk: Anti-Glomerular Basement membrane Glomerulonephritis, Brenner and Rector’s the Kidney, vol 1, Elsevier(2016), chapter 32, p 1076-1081.
142. Richard G. Phelps, A. Neil Turner: Anti-Glomerular Basement Membrane Disease and Goodpasture Disease. Comprehensive Clinical Nephrology, 6th edition, Elsevier(2019), section IV, p281
143. Agnes B. Fogo, Mark A. Lusco, Behzad Najafian and Charles E. Alpers: AJKD Atlas of Renal Pathology: Anti-Glomerular Basement Membrane Antibody-Mediated Glomerulonephritis. Am J Kidney Dis.2016;68(5):e29-e30.
144. Torres VE, Chapman AB, Devuyst O: Tolvaptan in later-stage autosomal dominant polycystic kidney disease. N Engl J Med 16;377(20):1930-1942, 2017. doi: 10.1056/NEJMoa1710030
145. Friedhelm Hildebrandt, Rannar Airik and John A. Sayer: Autosomal Dominant Polycystic Kidney Disease. Shrier’s Diseases of the Kidney, 9th edition, vol 1, Wolters Kluwer(2013): p501-518
146. Vicente E. Torres, Peter C. Harris: Autosomal Dominant Polycystic Kidney Disease. Comprehensive Clinical Nephrology, 6th edition, Elsevier (2019), section IX, p:532-543
147. Arlene B.Chapman, Olivier Devuyst, Kai-Uwe Eckardt, et al: Autosomal Dominant Polycystic Kidney Disease (ADPKD): Report from a kidney disease: Improving Global Outcomes (KDIGO) Controversies Conference 2017.
148. KDIGO 2024 Clinical practice guideline for the evaluation and management of chronic kidney disease. Kidney International 2024, Vol 105 (6): S117-S314.
149. KDIGO 2024 Clinical Practice guidelines for the management of lupus nephritis. Kidney International (2024) 105 Suppl 1s, S1 - S69.
150. Kidney Disease: Improving Global Outcomes (KDIGO) ANCA Vasculitis Work Group. KDIGO 2024 Clinical Practice Guideline for the Management of Antineutrophil Cytoplasmic Antibody (ANCA)-Associated Vasculitis. Kidney Int. 2024;105(3S):S71- S116.
151. McMurray JJV, Solomon SD, Inzucchi SE, et al. Dapagliflozin in Patients with Heart Failure and Reduced Ejection Fraction. N Engl J Med. 2019;381(21):1995-2008. doi:10.1056/NEJMoa1911303
152. Packer M, Anker SD, Butler J, et al. Cardiovascular and Renal Outcomes with Empagliflozin in Heart Failure. N Engl J Med. 2020;383(15):1413-1424. doi:10.1056/NEJMoa2022190
153. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: Developed by the Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC) With the special contribution of the Heart Failure Association (HFA) of the ESC, European Heart Journal, Volume 42, Issue 36, 21 September 2021, Pages 3599-3726
- 1Quyết định 2246/QĐ-BYT năm 2024 về Tài liệu chuyên môn "Hướng dẫn khám sức khỏe định kỳ cho trẻ em dưới 24 tháng tuổi" do Bộ trưởng Bộ Y tế ban hành
- 2Quyết định 2175/QĐ-BYT năm 2024 tài liệu chuyên môn "Hướng dẫn thực hiện kỹ thuật chăm sóc trẻ bằng phương pháp Kangaroo" do Bộ trưởng Bộ Y tế ban hành
- 3Quyết định 2341/QĐ-BYT năm 2024 về Tài liệu chuyên môn "Hướng dẫn Xử trí lồng ghép chăm sóc trẻ bệnh" do Bộ trưởng Bộ Y tế ban hành
- 4Quyết định 2681/QĐ-BYT năm 2024 về Tài liệu chuyên môn "Hướng dẫn tổ chức thực hiện công tác chăm sóc, điều trị sơ sinh tại các cơ sở khám bệnh, chữa bệnh" do Bộ trưởng Bộ Y tế ban hành
- 5Quyết định 2855/QĐ-BYT năm 2024 về Hướng dẫn chẩn đoán và điều trị bệnh viêm gan vi rút C do Bộ trưởng Bộ Y tế ban hành
- 6Quyết định 3261/QĐ-BYT năm 2024 tài liệu chuyên môn “Hướng dẫn quốc gia về các dịch vụ chăm sóc sức khỏe sinh sản - nội dung Chăm sóc sức khỏe sinh sản vị thành niên và thanh niên” do Bộ trưởng Bộ Y tế ban hành
- 7Quyết định 3651/QĐ-BYT năm 2024 về Tài liệu chuyên môn “Hướng dẫn chẩn đoán và điều trị bệnh nấm Aspergillus phổi mạn tính” do Bộ trưởng Bộ Y tế ban hành
Quyết định 2388/QĐ-BYT năm 2024 về Tài liệu chuyên môn “Hướng dẫn chẩn đoán và điều trị bệnh thận mạn và một số bệnh lý thận” do Bộ trưởng Bộ Y tế ban hành
- Số hiệu: 2388/QĐ-BYT
- Loại văn bản: Quyết định
- Ngày ban hành: 12/08/2024
- Nơi ban hành: Bộ Y tế
- Người ký: Trần Văn Thuấn
- Ngày công báo: Đang cập nhật
- Số công báo: Đang cập nhật
- Ngày hiệu lực: 12/08/2024
- Tình trạng hiệu lực: Kiểm tra