Để sử dụng toàn bộ tiện ích nâng cao của Hệ Thống Pháp Luật vui lòng lựa chọn và đăng ký gói cước.
| Banh m oiBỘ Y TẾ | CỘNG HÒA XÃ HỘI CHỦ NGHĨA VIỆT NAM |
| Số: 1830/QĐ-BYT | Hà Nội, ngày 26 tháng 05 năm 2014 |
BỘ TRƯỞNG BỘ Y TẾ
Căn cứ Nghị định số 63/2012/NĐ-CP ngày 31/8/2012 của Chính phủ Quy định chức năng, nhiệm vụ, quyền hạn và cơ cấu tổ chức của Bộ Y tế;
Xét đề nghị của Viện trưởng Viện Vệ sinh dịch tễ Trung ương - Chủ tịch Hội đồng chuyên môn xây dựng các Hướng dẫn về tiêm chủng tại Công văn số 311/VSDTTƯ-TCQG ngày 24/3/2014;
Xét đề nghị của Cục trưởng Cục Y tế dự phòng - Bộ Y tế,
QUYẾT ĐỊNH:
Điều 1. Ban hành kèm theo Quyết định này “Hướng dẫn giám sát, điều tra, phân tích, đánh giá nguyên nhân phản ứng sau tiêm chủng”.
Điều 2. “Hướng dẫn giám sát, điều tra, phân tích, đánh giá nguyên nhân phản ứng sau tiêm chủng” là tài liệu hướng dẫn được áp dụng trong các cơ sở tiêm chủng Nhà nước và tư nhân trên phạm vi toàn quốc.
Điều 4. Các ông, bà: Chánh Văn phòng Bộ, Chánh Thanh tra Bộ, Vụ trưởng; Cục trưởng; Tổng Cục trưởng các Vụ, Cục, Tổng cục thuộc Bộ Y tế; Giám đốc các cơ sở khám bệnh, chữa bệnh trực thuộc Bộ Y tế; Giám đốc Sở Y tế các tỉnh, thành phố trực thuộc Trung ương; Thủ trưởng y tế các Bộ, ngành; Thủ trưởng các đơn vị có liên quan chịu trách nhiệm thi hành Quyết định này./.
|
| KT. BỘ TRƯỞNG |
GIÁM SÁT, ĐIỀU TRA, PHÂN TÍCH, ĐÁNH GIÁ NGUYÊN NHÂN PHẢN ỨNG SAU TIÊM CHỦNG
(Ban hành kèm theo Quyết định số 1830/QĐ-BYT ngày 26/5/2014 của Bộ trưởng Bộ Y tế)
Giám sát phản ứng sau tiêm chủng (PƯSTC) bao gồm theo dõi, phát hiện sớm, xử trí và báo cáo các PƯSTC để giảm bớt tác động không tốt đến sức khỏe của người được tiêm chủng và cung cấp số liệu thực tế về tính an toàn của vắc xin, thực hành tiêm chủng.
1. Định nghĩa, phân loại phản ứng sau tiêm chủng
1.1. Định nghĩa: Phản ứng sau tiêm chủng là hiện tượng bất thường về sức khỏe bao gồm các biểu hiện tại chỗ tiêm chủng hoặc toàn thân xảy ra sau tiêm chủng bao gồm phản ứng thông thường sau tiêm chủng và tai biến nặng sau tiêm chủng.
1.2. Phân loại
a) Theo mức độ
- Phản ứng thông thường sau tiêm chủng bao gồm các phản ứng tại chỗ như ngứa, đau, sưng và/hoặc đỏ tại chỗ tiêm; phản ứng toàn thân bao gồm sốt và các triệu chứng khác (khó chịu, mệt mỏi, chán ăn) có thể là một phần của đáp ứng miễn dịch bình thường. Các phản ứng này thông thường là nhẹ và tự khỏi.
- Tai biến nặng sau tiêm chủng là phản ứng bất thường sau tiêm chủng có thể đe dọa đến tính mạng người được tiêm chủng (bao gồm các triệu chứng như khó thở, sốc phản vệ hay sốc dạng phản vệ, hội chứng sốc nhiễm độc, sốt cao co giật, trẻ khóc kéo dài, tím tái, ngừng thở) hoặc để lại di chứng hoặc làm người được tiêm chủng tử vong.
b) Theo nguyên nhân
- Do trùng hợp ngẫu nhiên: xảy ra sau khi tiêm chủng nhưng nguyên nhân không phải do vắc xin hoặc sai sót trong tiêm chủng hoặc lo sợ do bị tiêm mà do trùng hợp ngẫu nhiên với bệnh lý sẵn có hoặc nguyên nhân khác.
- Do tâm lý lo sợ: xảy ra do sự lo sợ hoặc do bị tiêm đau, không phải do vắc xin hoặc sai sót trong thực hành tiêm chủng.
- Do vắc xin: Phản ứng sau tiêm chủng xảy ra do các đặc tính cố hữu của vắc xin hoặc do vắc xin không đạt chất lượng.
- Do sai sót trong thực hành tiêm chủng: xảy ra do sai sót trong quá trình thực hành tiêm chủng (chuẩn bị, pha hồi chỉnh, kỹ thuật tiêm, bảo quản và sử dụng vắc xin không đúng).
- Không rõ nguyên nhân: Không xác định được nguyên nhân.
2. Hướng dẫn giám sát phản ứng sau tiêm chủng
2.1. Sơ đồ hệ thống giám sát
Hệ thống báo cáo tai biến nặng sau tiêm chủng
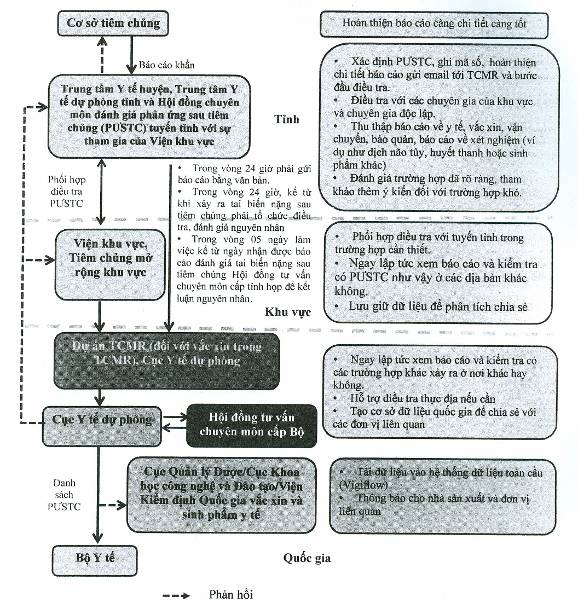
2.2. Quy định về chế độ báo cáo và quản lý hồ sơ trường hợp phản ứng sau tiêm chủng: Thực hiện theo Điều 13, Điều 15 Thông tư số 12/2014/TT-BYT ngày 20/3/2014 của Bộ Y tế hướng dẫn việc quản lý sử dụng vắc xin trong tiêm chủng và theo mẫu báo cáo tại Phụ lục 1 của Hướng dẫn này.
3. Điều tra tai biến nặng sau tiêm chủng
3.1. Thành phần đoàn điều tra: theo quy định tại Thông tư số 21/2011/TT-BYT ngày 07/6/2011 của Bộ Y tế quy định việc thành lập, tổ chức và hoạt động của Hội đồng tư vấn chuyên môn đánh giá tai biến trong quá trình sử dụng vắc xin, sinh phẩm y tế.
3.2. Quy trình điều tra
- Sử dụng phiếu điều tra (theo Phụ lục 2 của Hướng dẫn này)
- Điền đầy đủ các thông tin trong phiếu điều tra
- Điền mã số trường hợp tai biến nặng sau tiêm bao gồm chữ viết tắt của tỉnh, huyện và điểm tiêm chủng, cuối cùng là số thứ tự trường hợp tai biến tại điểm tiêm chủng đó được viết dưới dạng số ví dụ trường hợp thứ nhất tai biến nặng sau tiêm chủng tại xã A huyện B, tỉnh C: mã số được viết như sau: VNCBA01
- Các bước điều tra cụ thể như sau:
| TT | Các bước | Hành động |
| 1 | Xác minh các thông tin trong báo cáo | - Thu thập hồ sơ bệnh án (hoặc ghi chép về lâm sàng) - Kiểm tra hồ sơ chi tiết về bệnh nhân, tình trạng diễn biến sức khỏe. - Phỏng vấn cán bộ y tế tiếp nhận, điều trị trường hợp tai biến nặng sau tiêm chủng, rà soát hồ sơ bệnh án. - Thu thập thêm thông tin còn thiếu trong báo cáo. - Xác định những trường hợp khác cần điều tra. |
| 2 | Điều tra tai biến nặng sau tiêm chủng | |
|
| 2.1. Điều tra và thu thập thông tin từ bệnh nhân hoặc người nhà | - Tiền sử tiêm chủng. - Tiền sử bệnh tật, bao gồm tiền sử về phản ứng tương tự hoặc những tình trạng dị ứng khác. - Tiền sử về gia đình đối với những phản ứng tương tự. - Phỏng vấn trực tiếp bà mẹ hoặc người chăm sóc trẻ, rà soát hồ sơ liên quan tới trường hợp phản ứng sau tiêm chủng do người nhà giữ. |
|
| 2.2. Điều tra trường hợp tai biến nặng sau tiêm chủng | - Bệnh sử, mô tả lâm sàng, tất cả các xét nghiệm liên quan đến tai biến nặng sau tiêm chủng và chẩn đoán. - Điều trị, kết quả |
|
| 2.3. Điều tra vắc xin nghi ngờ | - Điều kiện vận chuyển vắc xin, điều kiện bảo quản hiện tại, tình trạng bảo quản lọ vắc xin, bảng theo dõi nhiệt độ tủ lạnh. - Bảo quản vắc xin trước khi đến cơ sở y tế, phiếu tiếp nhận vắc xin, thẻ chỉ thị nhiệt. |
|
| 2.4. Điều tra những người liên quan | - Những người đã được tiêm chủng cùng loại vắc xin trong cùng một buổi tiêm chủng có phản ứng hay không? phản ứng tương tự hay không? - Điều tra dịch vụ tiêm chủng. |
| 3 | Đánh giá thực hành tiêm chủng | |
|
| 3.1. Đánh giá dịch vụ bằng cách hỏi | - Đánh giá điểm tiêm chủng: Hỏi, quan sát việc cung cấp dịch vụ tiêm chủng, bảo quản vắc xin. - Cách bảo quản vắc xin (kể cả những lọ đã mở), việc phân phối và hủy bỏ vắc xin. - Cách bảo quản và phân phối dung môi. - Việc pha hồi chỉnh vắc xin (kỹ thuật và thời gian sử dụng sau khi pha). - Cách sử dụng và vô trùng bơm, kim tiêm. - Những chi tiết về huấn luyện thực hành tiêm chủng, về giám sát các kỹ thuật tiêm chủng. |
|
| 3.2. Quan sát dịch vụ tiêm chủng | - Tủ lạnh: ngoài vắc xin còn bảo quản thêm những gì trong tủ lạnh (cần ghi chép nếu có những lọ tương tự được để cạnh những lọ vắc xin có thể nhầm lẫn); những loại vắc xin hoặc dung môi nào để cùng với những loại thuốc khác; có lọ vắc xin, sinh phẩm y tế nào mất nhãn, quá hạn sử dụng không? - Thực hành tiêm chủng (hồi chỉnh vắc xin, mở nút lọ, kỹ thuật tiêm, đảm bảo an toàn bơm, kim tiêm, vứt bỏ những lọ đã mở). |
| 4 | Đặt giả thuyết | - Nguyên nhân có thể xảy ra |
| 5 | Kiểm tra giả thuyết | - Trường hợp phản ứng có phù hợp với giả thuyết? - Chỉ lấy mẫu và yêu cầu kiểm định vắc xin nếu nghi ngờ nguyên nhân do vắc xin. |
| 6 | Kết thúc điều tra | - Hoàn chỉnh phiếu điều tra. - Kết luận của đoàn điều tra. - Khuyến nghị. |
![]() 3.3. Lấy mẫu vắc xin để kiểm định
3.3. Lấy mẫu vắc xin để kiểm định
- Lấy mẫu và yêu cầu kiểm định vắc xin: tùy thuộc vào giả thuyết về nguyên nhân của tai biến sau tiêm chủng. Chỉ lấy mẫu vắc xin khi nghi ngờ nguyên nhân do vắc xin. Trung tâm Y tế dự phòng tỉnh, thành phố lấy mẫu vắc xin, ghi phiếu theo Phụ lục 3 của Hướng dẫn này.
- Lấy đúng lọ vắc xin và dung môi liên quan tới tai biến sau tiêm chủng, nếu đã dùng hết thì lấy vỏ lọ. Trong trường hợp không xác định được vỏ lọ dùng tiêm chủng cho đối tượng thì không lấy.
- Lấy thêm vắc xin cùng loại, cùng số lô, hạn dùng, cùng địa điểm xảy ra tai biến nặng sau tiêm chủng với số lọ đủ để kiểm tra an toàn, tối thiểu là 15 ml hoặc theo hướng dẫn của Viện Kiểm định quốc gia vắc xin và sinh phẩm y tế.
- Đối với vắc xin đông khô cần lấy thêm dung môi.
- Mẫu vắc xin nghi ngờ gửi tới Viện Kiểm định quốc gia vắc xin và sinh phẩm y tế phải bảo quản trong dây chuyền lạnh (như đối với các vắc xin được cấp phát cho các đơn vị để sử dụng) trong suốt quá trình vận chuyển.
- Trên mẫu gửi ghi rõ ngày, tháng, địa điểm xảy ra tai biến nặng sau tiêm chủng.
- Gửi mẫu kèm theo phiếu điều tra tai biến nặng sau tiêm chủng
3.4. Lấy mẫu bệnh phẩm
- Trong trường hợp có tiến hành giám định pháp y thực hiện theo các quy định về giám định pháp y.
- Thu thập mẫu bệnh phẩm để kiểm tra nhiễm trùng, miễn dịch, mô bệnh học và vi rút học theo hướng dẫn của các phòng xét nghiệm liên quan và theo Phụ lục 4 của Hướng dẫn này.
4. Phân tích kết quả điều tra tai biến nặng sau tiêm chủng
4.1. Nhập số liệu theo các biến: địa điểm, con người, thời gian, loại vắc xin và các triệu chứng theo mẫu tại Phụ lục 5 của Hướng dẫn này bằng phần mềm.
4.2. Thống kê số liệu
- Thống kê số trường hợp tai biến nặng sau tiêm chủng theo loại vắc xin.
- Thống kê nguyên nhân tai biến (dựa trên kết luận của Hội đồng cấp tỉnh và Hội đồng cấp Bộ)
- Thống kê số trường hợp đã tổ chức họp Hội đồng, thời gian điều tra, thời gian họp Hội đồng kể từ khi phát hiện tai biến sau nặng sau tiêm chủng.
- Thống kê các số liệu khác khi cần thiết.
4.3. So sánh, đánh giá kết quả: So sánh kết quả về tỉ lệ phản ứng thông thường, tai biến nặng sau tiêm chủng của từng loại vắc xin với tỉ lệ ước tính của các phân tích trước đó hoặc theo thống kê của Tổ chức Y tế thế giới (theo Phụ lục 6 của Hướng dẫn này).
5. Đánh giá nguyên nhân tai biến nặng sau tiêm chủng
Đánh giá nguyên nhân là sự xem xét một cách có hệ thống các thông tin về trường hợp tai biến nặng sau tiêm chủng để xác định mối liên quan giữa các phản ứng và tiêm chủng để:
- Xác định các vấn đề liên quan tới vắc xin.
- Xác định các vấn đề liên quan tới lỗi của dịch vụ tiêm chủng.
- Loại trừ các trường hợp trùng hợp.
5.1. Các trường hợp cần đánh giá nguyên nhân
- Trường hợp tai biến nặng sau tiêm chủng.
- Chùm phản ứng vượt quá số lượng thống kê về phản ứng chung của Tổ chức Y tế thế giới hoặc có mức độ nghiêm trọng ảnh hưởng tới cộng đồng.
5.2. Đánh giá nguyên nhân và phân loại các trường hợp tai biến nặng sau tiêm chủng
- Đánh giá nguyên nhân theo Phụ lục 7 của Hướng dẫn này
- Phân loại các trường hợp dựa vào những thông tin ghi nhận:
+ Các trường hợp có đầy đủ thông tin để kết luận nguyên nhân có thể được phân loại như sau:
A. Có liên quan tới tiêm chủng
A1: Liên quan tới đặc tính cố hữu của vắc xin
A2: Liên quan tới việc vắc xin không đạt chất lượng
A3: Liên quan tới thực hành tiêm chủng
A4: Liên quan tới những lo sợ do bị tiêm chủng.
B. Chưa xác định
B1: Có mối liên quan tạm thời tới tiêm chủng nhưng chưa có đủ bằng chứng để kết luận (có thể do vắc xin mới), phải tiến hành điều tra thêm.
B2: Không xác định được nguyên nhân.
C. Không liên quan tới tiêm chủng do trùng hợp ngẫu nhiên hoặc do nguyên nhân khác.
+ Các trường hợp không có đủ thông tin để kết luận nguyên nhân được coi là “không phân loại được” và cần phải thu thập thêm thông tin để đánh giá nguyên nhân.
- Sơ đồ phân loại nguyên nhân theo Phụ lục 8 của Hướng dẫn này.
MẪU BÁO CÁO TAI BIẾN NẶNG SAU TIÊM CHỦNG
Mã số trường hợp tai biến nặng sau tiêm chủng……….
1. Thông tin chung
| Họ và tên: ………………………………………… Ngày tháng năm sinh: -----/-----/---------------- Giới: Nam £ Nữ £ Dân tộc:.......................................... Họ và tên mẹ/bố (khi người được tiêm chủng là trẻ em): …………………… Điện thoại.......... Địa chỉ: Thôn/ấp: ……………………………………. Xã: ………………………………………….. Huyện: ……………………………………… Tỉnh: ………………………………………… Cơ sở tiêm chủng: ……………………………………………………………………………………. Tiêm chủng mở rộng £ Tiêm chủng dịch vụ £ Tại Trạm y tế £ Tại bệnh viện/phòng khám £ Ngoài trạm £ khác £
|
| Người báo cáo: …………………………………………………………………………………….. Đơn vị:..……………………………………………………………………………………………… Địa chỉ: ………………………………………………………………………………………………. Điện thoại & email: ………………………………………………………………………………….
|
2. Thông tin về tiêm chủng trong lần này
| Loại vắc xin | Liều thứ mấy | Đường tiêm | Vị trí tiêm | Người tiêm | Ngày, giờ tiêm chủng | Ngày, giờ bắt đầu xảy ra phản ứng |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3. Thông tin về loại vắc xin, dung môi tiêm chủng trong lần này
| Loại vắc xin, dung môi | Tên vắc xin, dung môi | Nhà sản xuất | Đơn vị cung cấp | Số lô | Hạn dùng |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4. Mô tả phản ứng
| Sốt cao ³39°C | | Bệnh não trong vòng 7 ngày | |
| Sưng, nóng, đỏ tại vị trí tiêm | | Những cơn co giật trong vòng 3 ngày | |
| Áp xe tại chỗ tiêm | | Sốc trong vòng 72 giờ | |
Khác ghi rõ ....................................................................................................................
.........................................................................................................................................
5. Tiền sử về bệnh tật (kể cả tiền sử về phản ứng tương tự hay dị ứng)
………………………………………………………………………………………………………...
………………………………………………………………………………………………………...
………………………………………………………………………………………………………...
………………………………………………………………………………………………………...
………………………………………………………………………………………………………...
………………………………………………………………………………………………………...
6. Xử trí phản ứng sau tiêm chủng
Có Không
Nơi xử trí
Tại nhà Trạm Y tế
Bệnh viện tuyến huyện Bệnh viện tuyến tỉnh, trung ương
Y tế tư nhân Khác
Họ và tên người xử trí ......................................................................................................
7. Tình trạng hiện tại
Khỏi
Di chứng
Tử vong Ngày tử vong ----/----/--------
Khác (ghi rõ) ..............................................................................................................
|
| …..….., Ngày….tháng….năm 20….. |
PHIẾU ĐIỀU TRA TAI BIẾN NẶNG SAU TIÊM CHỦNG
Mã số trường hợp tai biến nặng sau tiêm chủng ………..
Ngày tháng năm nhận được báo cáo: -----/-----/------- Ngày Điều tra: -----/-----/------------------
Nơi báo cáo trường hợp phản ứng: ………………………………………………………………….
Thành phần đoàn điều tra (họ và tên, đơn vị công tác)
1. ………………………………………………………………………………………………………..
2. ………………………………………………………………………………………………………..
3. ………………………………………………………………………………………………………..
4. ………………………………………………………………………………………………………..
5. ………………………………………………………………………………………………………..
1. Thông tin chung
| Họ và tên trẻ: …………………………………………. Giới: ………………… Dân tộc................... Ngày tháng năm sinh: …../…../………..(…….. tháng tuổi, nếu trẻ sơ sinh …….. ngày tuổi) Con thứ mấy trong gia đình:........................................................ Họ và tên mẹ (bố): ………………………………….. Số điện thoại: ……………………………….. Địa chỉ: Thôn/ấp: …………………………………… Xã: …………………………………………….. Huyện: …………………………………….. Tỉnh: ……………………………………………. Cơ sở tiêm chủng:......................................................................................................................... Tiêm chủng mở rộng £ Tiêm chủng dịch vụ £ Tiêm chủng thường xuyên £ Tiêm chủng chiến dịch £ Tại trạm y tế £ Tại bệnh viện/phòng khám £ Ngoài trạm £ khác £ |
2. Thông tin về tiêm chủng trong lần này
| Vắc xin | Liều thứ mấy | Đường tiêm | Vị trí tiêm | Người tiêm | Giờ, ngày tiêm chủng | Giờ, ngày bắt đầu xảy ra phản ứng |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3. Thông tin về loại vắc xin, dung môi tiêm chủng trong lần này
| Loại vắc xin, dung môi | Tên vắc xin, dung môi | Nhà sản xuất | Đơn vị cung cấp | Số lô | Hạn dùng |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4. Diễn biến tai biến nặng sau tiêm chủng
4.1. Triệu chứng và dấu hiệu lâm sàng
a/ Thông tin từ mẹ hoặc người trực tiếp chăm sóc trẻ và hồ sơ người nhà giữ (Mô tả thời gian xuất hiện, triệu chứng đầu tiên của tai biến, diễn biến triệu chứng từ sau khi tiêm chủng)
…………………………………………………………………………………………………………..
…………………………………………………………………………………………………………..
…………………………………………………………………………………………………………..
b/ Thông tin từ cán bộ y tế và từ hồ sơ bệnh án tại cơ sở y tế (Mô tả thời gian đến cơ sở y tế, tình trạng ban đầu, diễn biến triệu chứng theo trình tự thời gian)
…………………………………………………………………………………………………………..
…………………………………………………………………………………………………………..
4.2. Kết quả xét nghiệm cận lâm sàng (máu/nước tiểu/dịch não tủy...tại các cơ sở y tế nơi trẻ được điều trị)
…………………………………………………………………………………………………………..
…………………………………………………………………………………………………………..
4.3. Chẩn đoán cuối cùng của cơ sở y tế điều trị
…………………………………………………………………………………………………………..
…………………………………………………………………………………………………………..
4.4. Trường hợp tử vong
a/ Mô tả tình trạng khi phát hiện tử vong (tư thế, vị trí, chất tiết,..)
…………………………………………………………………………………………………………..
…………………………………………………………………………………………………………..
b/ Kết quả giám định pháp y (thu thập kết quả giám định bằng văn bản nếu có)
Cơ quan giám định: ……………………………………………………………………………………
Kết quả giám định: ……………………………………………………………………………………..
5. Tình trạng tại thời điểm điều tra
£ Đang điều trị
£ Khỏi Sau tiêm chủng bao lâu: ……………………….
£ Tử vong Sau tiêm chủng bao lâu: ……………………….
£ Di chứng (ghi rõ) ……………..Sau tiêm chủng bao lâu …………………….
6. Tiền sử
a/ Tiền sử sản khoa
- Tiền sử mẹ khi mang thai: …………………………………………………………………………..
…………………………………………………………………………………………………………..
- Số tuần thai khi sinh: ……………………… Cân nặng khi sinh: ………………………………..
- Các vấn đề sức khỏe của trẻ khi sinh: ……………………………………………………………
……………………………………………………………………………………………………………
b/ Tiền sử bệnh tật của trẻ từ khi sinh đến khi được tiêm chủng lần này
……………………………………………………………………………………………………………
c/ Tiền sử tiêm chủng và phản ứng sau các lần tiêm chủng trước (loại vắc xin, thời gian tiêm, nêu rõ phản ứng sau tiêm chủng nếu có).
……………………………………………………………………………………………………………
d/ Tiền sử dùng thuốc ngay trước khi tiêm chủng lần này (trong vòng 1 tuần trước khi tiêm chủng)
……………………………………………………………………………………………………………
e/ Trước, trong và sau tiêm chủng lần này trẻ ăn, uống hay bú mẹ có gì bất thường không? có té, ngã không?
……………………………………………………………………………………………………………
……………………………………………………………………………………………………………
f/ Tiền sử gia đình (dị ứng hoặc phản ứng với vắc xin ...nếu có)
……………………………………………………………………………………………………………
7. Điều tra thực hiện quy trình tiêm chủng tại cơ sở tiêm chủng
| a/ Điều kiện bảo quản vắc xin, dung môi (Nhận vắc xin từ đâu, thời gian nào, phương tiện nhận vắc xin, bảo quản vắc xin tại xã, có thiết bị theo dõi nhiệt độ bảo quản vắc xin? Kiểm tra nhiệt độ bảo quản vắc xin hiện tại, biểu đồ theo dõi nhiệt độ (nếu bảo quản vắc xin bằng tủ lạnh) …………………………………………………………………………………………………………… …………………………………………………………………………………………………………… …………………………………………………………………………………………………………… b/ Cách tổ chức buổi tiêm chủng (Số đối tượng trong 1 buổi tiêm? Số cán bộ tham gia tiêm chủng? Có khám phân loại, tư vấn trước và theo dõi sau tiêm chủng?) …………………………………………………………………………………………………………… …………………………………………………………………………………………………………… …………………………………………………………………………………………………………… c/ Thực hành tiêm chủng (Cán bộ trực tiếp tiêm chủng được tập huấn không? Kiểm tra kiến thức về thực hành khám chỉ định và chống chỉ định, bảo quản vắc xin, chuẩn bị vắc xin, pha hồi chỉnh (kỹ thuật pha, thời gian sử dụng), sử dụng BKT, kỹ thuật tiêm chủng, hủy vắc xin, BKT sau buổi tiêm chủng) …………………………………………………………………………………………………………… …………………………………………………………………………………………………………… d/ Ghi chép và quản lý sổ sách (Kiểm tra sổ quản lý vắc xin, sổ quản lý tiêm chủng, sổ theo dõi phản ứng bất thường sau tiêm chủng) e/ Tình hình tiêm chủng · Số đối tượng cùng tiêm trong buổi tiêm chủng của từng loại vắc xin …………………………………………………………………………………………………………… …………………………………………………………………………………………………………… …………………………………………………………………………………………………………… · Số trẻ tiêm chủng cùng loại vắc xin: ……………… cùng lô vắc xin: ………….. cùng lọ vắc xin (nếu lọ nhiều liều): ……………….với trường hợp tai biến sau tiêm chủng. · Số trường hợp tai biến nặng sau tiêm chủng tại cơ sở tiêm chủng trong thời gian gần đây …… · Tình hình bệnh tật, tử vong tại địa bàn trong thời gian gần đây có gì đặc biệt …………………………………………………………………………………………………………… …………………………………………………………………………………………………………… |
8. Điều tra tại cộng đồng (kết hợp hỏi cán bộ y tế và thăm hộ gia đình)
· Tổng số đối tượng được điều tra: ………….
· Số đối tượng có phản ứng với cùng loại vắc xin: ………..
· Các vấn đề khác: ………………………………………………………………………………….
9. Tình hình tiếp nhận, bảo quản, phân phối và sử dụng lô vắc xin có trường hợp tai biến nặng sau tiêm chủng tại tuyến tỉnh, huyện
9.1. Tình hình tiếp nhận, bảo quản, phân phối lô vắc xin tại tuyến tỉnh, huyện
| Thông tin điều tra | Tuyến tỉnh | Tuyến huyện |
| Nguồn gốc lô vắc xin |
|
|
| Thời gian tiếp nhận |
|
|
| Số lượng nhận |
|
|
| Phương tiện vận chuyển |
|
|
| Số lượng đã cấp cho tuyến dưới |
|
|
| Số lượng còn tồn tại kho đơn vị |
|
|
| Phương tiện bảo quản lô vắc xin này |
|
|
| Nhiệt độ bảo quản lúc kiểm tra |
|
|
| Chỉ thị đông băng điện tử lúc kiểm tra |
|
|
| Chỉ thị nhiệt độ lọ vắc xin lúc kiểm tra (nếu có) |
|
|
| Có bảng theo dõi nhiệt độ hàng ngày | Có £ Không £ | Có £ Không £ |
| Nhiệt độ có trong giới hạn cho phép không? | Có £ Không £ | Có £ Không £ |
| Có sự cố dây chuyền lạnh trong thời gian bảo quản lô vắc xin này không? | Có £ Không £ | Có £ Không £ |
| Có sổ quản lý vắc xin, BKT, HAT | Có £ Không £ | Có £ Không £ |
| Sổ ghi chép đúng quy định không? | Có £ Không £ | Có £ Không £ |
| Lô vắc xin này có được quản lý đúng quy định trong sổ không? | Có £ Không £ | Có £ Không £ |
| Có phiếu xuất, nhập kho không? | Có £ Không £ | Có £ Không £ |
| Phiếu có ghi chép đúng quy định không? | Có £ Không £ | Có £ Không £ |
| Cán bộ quản lý kho vắc xin tại tuyến tỉnh đã được tập huấn về bảo quản vắc xin không? | Có £ Không £ | Có £ Không £ |
| Kiểm tra kiến thức về bảo quản vắc xin của cán bộ quản lý kho có đạt yêu cầu không? | Có £ Không £ | Có £ Không £ |
9.2. Tình hình sử dụng lô vắc xin và tai biến nặng sau tiêm chủng tuyến tỉnh, huyện
| Thông tin điều tra | Tuyến tỉnh | Tuyến huyện |
| Số đối tượng tiêm chủng cùng loại vắc xin |
|
|
| Số đối tượng tiêm chủng cùng lô vắc xin |
|
|
| Số trường hợp phản ứng sau tiêm chủng lô vắc xin này |
|
|
| Số trường hợp phản ứng sau tiêm chủng khác |
|
|
10. Các hoạt động đã triển khai
a/ Tuyến xã
…………………………………………………………………………………………………………….
b/ Tuyến tỉnh, huyện
…………………………………………………………………………………………………………….
Có lấy mẫu vắc xin gửi kiểm định không? Có £ Không £
Số lượng mẫu: …………………….. Tuyến được lấy mẫu: ………………………………………..
Ngày gửi mẫu ……./…../…….. Kết quả kiểm định (nếu có) ………………………………….
11. Nhận định và đánh giá sơ bộ
· Nguồn gốc vắc xin liên quan (vd: là vắc xin thuộc TCMR, được cấp theo hệ thống của TCMR) ……………………………………………………………………………………………………
· Quá trình vận chuyển, bảo quản vắc xin đúng quy định không? Có £ Không £
· Qui trình thực hành tiêm chủng có đảm bảo an toàn không? Có £ Không £
· Nhận định ban đầu về nguyên nhân của trường hợp tai biến sau tiêm chủng:
……………………………………………………………………………………………………………
12. Đề xuất, khuyến nghị
……………………………………………………………………………………………………………
……………………………………………………………………………………………………………
|
| Ngày …..tháng ..... năm 20 ….. |
PHIẾU LẤY VÀ GỬI MẪU KIỂM ĐỊNH VẮC XIN
Cơ quan gửi mẫu (Trung tâm Y tế dự phòng tỉnh, thành phố lấy mẫu và gửi):
…………………………………………………………………………………………………………….
Lý do gửi mẫu: ………………………………………………………………………………………….
Giả thuyết về nguyên nhân sau khi điều tra: ………………………………………………………..
Yêu cầu kiểm tra: An toàn chung: ……………………………………………………………………
An toàn đặc hiệu: ………………………….. Khác, ghi rõ: ………………………
Ngày gửi mẫu: ………………………………………………………………………………………….
Cơ quan nhận mẫu: ……………………………………………………………………………………
| Tên vắc xin | Nhà sản xuất | Số lô | Hạn dùng | Nơi lấy mẫu | Ngày lấy mẫu | Tình trạng nhiệt độ/ chỉ thị nhiệt độ | Số lượng | Nhận xét về tình trạng nhãn, nút, màu sắc cảm quan (đã sử dụng, pha hồi chỉnh,..) | Ghi chú |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Nhiệt độ khi nhận mẫu tại đơn vị tiếp nhận:………..
| Người gửi mẫu | Lãnh đạo đơn vị |
HƯỚNG DẪN LẤY MẪU BỆNH PHẨM ĐỐI VỚI CÁC TRƯỜNG HỢP TAI BIẾN NẶNG SAU TIÊM CHỦNG
| Tình trạng phản ứng | Mẫu bệnh phẩm |
| Phản ứng tại chỗ | Máu |
| Áp xe | Bệnh phẩm tại ổ viêm, máu |
| Viêm hạch | Máu |
| Hội chứng thần kinh trung ương không liệt | Dịch não tủy, máu |
| Hội chứng thần kinh trung ương có liệt | Phân |
| Sốc | Máu |
| Hội chứng sốc nhiễm độc | Máu, nuôi cấy máu |
| Tử vong | Xét nghiệm tử thi, mô, cơ quan Làm tối đa các xét nghiệm cận lâm sàng có thể trước khi tử vong |
BIỂU MẪU NHẬP THÔNG TIN VỀ TAI BIẾN NẶNG SAU TIÊM CHỦNG
| TT | Họ tên | Tuổi | Địa chỉ | Mã số | Loại vắc xin, mũi số mấy ngày sản xuất, hạn sử dụng, nhà sản xuất | Thời gian sử dụng vắc xin (giờ, ngày) | Thời gian xuất hiện phản ứng (giờ, ngày) | Triệu chứng chính | Diễn biến lâm sàng | Tình trạng | Xử trí | Thời gian tiến hành điều tra (giờ, ngày) | Kết luận (nguyên nhân, loại tai biến nặng sau tiêm chủng) | Hội đồng (cấp tỉnh, Bộ) | Ngày họp Hội đồng | Ngày báo cáo tuyến trên | Ghi chú | |
| Nam | Nữ | |||||||||||||||||
| 1. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| 2. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| 3. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
BẢNG TỶ LỆ PHẢN ỨNG SAU TIÊM CHỦNG CỦA TỪNG LOẠI VẮC XIN THEO TỔ CHỨC Y TẾ THẾ GIỚI
Bảng 1: Các phản ứng thông thường
| TT | Loại vắc xin | Phản ứng tại chỗ (sưng, đau, đỏ) | Sốt (>38°C) | Các triệu chứng toàn thân |
| 1 | BCG | 90-95% | - |
|
| 2 | Viêm gan B | Người lớn £ 15% Trẻ em £ 5% | 1-6% |
|
| 3 | Hib | 5-15% | 2-10% |
|
| 4 | Cúm bất hoạt | 10-64% | 5-12% |
|
| 5 | Cúm sống | - | 16-31% | 4-23% |
| 6 | Viêm não Nhật Bản bất hoạt | <4% |
| <1% |
| 7 | Viêm não Nhật Bản sống | <1% |
|
|
| 8 | Sởi/MR/MMR | 10% | 5-15% | 5% (Phát ban) |
| 9 | OPV |
| <1% | <1% |
| 10 | DTP toàn tế bào | £ 50% | £ 50% | £55% |
| 11 | Phế cầu cộng hợp | 10% | 20% | 20% |
| 12 | Thủy đậu | 7-30% |
|
|
| 13 | Uốn ván | 10% | 10% | 25% |
Bảng 2: Các tai biến nặng sau tiêm chủng
| TT | Loại vắc xin | Loại phản ứng | Tỷ lệ/số liều sử dụng |
| 1 | BCG | Viêm hạch | 1-10/104 |
| Viêm xương | 1-700/106 | ||
| Nhiễm khuẩn BCG lan tỏa | 0,19-1,56/106 | ||
| 2 | Viêm gan B | Sốc phản vệ | 1,1/106 |
| 3 | Cúm (bất hoạt) | Sốc phản vệ | 0,7/106 |
| Hội chứng Guillain Barre | 1-2/106 | ||
| Hội chứng hô hấp kết hợp | 76/106 | ||
| 4 | Cúm sống giảm độc lực | Sốc phản vệ Thở khò khè (trẻ 6-11 tháng) | 2/106 14/100 |
| 5 | Viêm não Nhật Bản (bất hoạt) | Hội chứng thần kinh (viêm não, thần kinh ngoại biên | 1 - 2,3/106 |
| 6 | Sởi/MR/MMR | Sốt cao co giật | 3/103 |
| Giảm tiểu cầu | 3/104 | ||
| Sốc phản vệ | ~ 1/106 | ||
| Bệnh não | <1/106 | ||
| 7 | OPV | Liệt | 2-4/106 |
| 8 | DTP toàn tế bào | Khóc dai dẳng | <1/100 |
| Co giật | <1/100 | ||
| Giảm trương lực | 1 - 2/103 | ||
| Sốc phản vệ | 20/106 | ||
| Bệnh não | 0 - 1/106 | ||
| 9 | Uốn ván | Viêm dây thần kinh cánh tay | 5 - 10/106° |
| Sốc phản vệ | 1-6/106 | ||
| 10 | Sốt vàng | Bệnh nội tạng liên quan đến vắc xin | 1/106 |
| 11 | Thủy đậu | Giảm tiểu cầu | 4-9/104 |
ĐÁNH GIÁ NGUYÊN NHÂN TAI BIẾN NẶNG SAU TIÊM CHỦNG
| I. Có bằng chứng chắc chắn về mối liên quan với nguyên nhân khác không? | ||
|
| Y N UK NA | |
| Kết quả xét nghiệm hoặc kiểm tra lâm sàng có mối liên quan với nguyên nhân khác không? | £ £ £ £ |
|
| II. Có mối liên quan nào đã được biết tới trước đó với vắc xin/tiêm chủng? | ||
| Vắc xin | ||
| Có bằng chứng nào về loại vắc xin được bảo quản đúng quy định này có liên quan đến các trường hợp tai biến được báo cáo? | £ £ £ £ |
|
| Có bằng chứng cụ thể nào chứng minh nguyên nhân là do vắc xin hoặc thành phần của vắc xin? | £ £ £ £ |
|
| Lỗi tiêm chủng | ||
| Sai sót trong chỉ định tiêm chủng hoặc không tuân thủ các khuyến cáo sử dụng (sử dụng vắc xin đã quá hạn, chỉ định sai,...)? | £ £ £ £ |
|
| Vắc xin hoặc các thành phần của vắc xin được bảo quản riêng biệt? | £ £ £ £ |
|
| Vắc xin có thay đổi tính chất vật lý (màu, kết tủa,...)? | £ £ £ £ |
|
| Sai sót trong quá trình chuẩn bị (sai loại, không đúng nước pha hồi chỉnh,....)? | £ £ £ £ |
|
| Sai sót trong bảo quản, vận chuyển và sử dụng vắc xin? (hỏng, vỡ dây chuyền lạnh trong quá trình vận chuyển, bảo quản,...)? | £ £ £ £ |
|
| Sai sót khi tiêm (sai liều, vị trí và đường tiêm, sai kích cỡ bơm kim tiêm,...)? | £ £ £ £ |
|
| Lo lắng do tiêm chủng | ||
| Các tai biến do sự lo lắng về tiêm chủng (ngất, thở nhanh hoặc liên quan đến stress)? | £ £ £ £ |
|
| II (Thời gian) Nếu trả lời có, tai biến có xảy ra trong khoảng thời gian hợp lý không? | ||
| Tai biến xảy ra trong khoảng thời gian hợp lý sau tiêm chủng ? | £ £ £ £ |
|
| III. Có bằng chứng rõ ràng xác định không có mối liên quan tới tiêm chủng không? | ||
| Có bằng chứng rõ ràng xác định không có mối liên quan tới tiêm chủng không? | £ £ £ £ |
|
| IV. Các yếu tố chất lượng khác để phân loại | ||
| Tai biến có thể không liên quan đến vắc xin. | £ £ £ £ |
|
| Tai biến có liên quan đến điều kiện sức khỏe nào khác không? | £ £ £ £ |
|
| So sánh với những tiền sử tai biến với loại vắc xin tương tự đã sử dụng? | £ £ £ £ |
|
| Có tiền sử phơi nhiễm với những yếu tố nguy cơ tiềm ẩn/độc hại trước tai biến không? | £ £ £ £ |
|
| Có bị ốm trước khi tai biến không ? | £ £ £ £ |
|
| Những tai biến trước đây không liên quan đến vắc xin không? | £ £ £ £ |
|
| Người được tiêm chủng có đang dùng thuốc hoặc điều trị gì trước khi tiêm vắc xin hay không? | £ £ £ £ |
|
| Có bằng chứng sinh học nào chứng minh vắc xin gây ra tai biến sau tiêm chủng | £ £ £ £ |
|
Ghi chú: Y: Có; N: Không; UK: Không biết; NA: Không có thông tin.
SƠ ĐỒ PHÂN LOẠI NGUYÊN NHÂN TAI BIẾN SAU TIÊM CHỦNG

- 1Chỉ thị 01/CT-BYT năm 2013 tăng cường an toàn tiêm chủng và giám sát phản ứng sau tiêm chủng do Bộ Y tế ban hành
- 2Công văn 4594/BYT-DP năm 2013 triển khai hoạt động liên quan đến phản ứng sau tiêm chủng do Bộ Y tế ban hành
- 3Quyết định 1357/QĐ-BYT năm 2019 công bố Danh mục hướng dẫn của Bộ Y tế về hoạt động tiêm chủng hết hiệu lực toàn bộ
- 1Quyết định 2228/QĐ-BYT năm 2015 sửa đổi mục 3.1. và mục 3.3. tại hướng dẫn giám sát, điều tra, phân tích, đánh giá nguyên nhân phản ứng sau tiêm chủng kèm theo Quyết định 1830/QĐ-BYT do Bộ trưởng Bộ Y tế ban hành
- 2Quyết định 1357/QĐ-BYT năm 2019 công bố Danh mục hướng dẫn của Bộ Y tế về hoạt động tiêm chủng hết hiệu lực toàn bộ
- 1Thông tư 21/2011/TT-BYT quy định việc thành lập, tổ chức và hoạt động của Hội đồng tư vấn chuyên môn đánh giá tai biến trong quá trình sử dụng vắc xin, sinh phẩm y tế do Bộ Y tế ban hành
- 2Nghị định 63/2012/NĐ-CP quy định chức năng, nhiệm vụ, quyền hạn và cơ cấu tổ chức của Bộ Y tế
- 3Chỉ thị 01/CT-BYT năm 2013 tăng cường an toàn tiêm chủng và giám sát phản ứng sau tiêm chủng do Bộ Y tế ban hành
- 4Công văn 4594/BYT-DP năm 2013 triển khai hoạt động liên quan đến phản ứng sau tiêm chủng do Bộ Y tế ban hành
- 5Thông tư 12/2014/TT-BYT hướng dẫn việc quản lý sử dụng vắc xin trong tiêm chủng do Bộ trưởng Bộ Y tế ban hành
Quyết định 1830/QĐ-BYT năm 2014 về Hướng dẫn giám sát, điều tra, phân tích, đánh giá nguyên nhân phản ứng sau tiêm chủng do Bộ trưởng Bộ Y tế ban hành
- Số hiệu: 1830/QĐ-BYT
- Loại văn bản: Quyết định
- Ngày ban hành: 26/05/2014
- Nơi ban hành: Bộ Y tế
- Người ký: Nguyễn Thanh Long
- Ngày công báo: Đang cập nhật
- Số công báo: Đang cập nhật
- Ngày hiệu lực: 01/06/2014
- Ngày hết hiệu lực: 01/01/2019
- Tình trạng hiệu lực: Kiểm tra

